西红花苷通过调控TLR4/MyD88/NF-κB通路改善糖尿病大鼠视网膜病变机制研究
2023-05-13王桂青杜竹君
孟 宏,王桂青,杜竹君
(邯郸市中心医院,河北 邯郸 056000)
糖尿病视网膜病变(Diabetic retinopathy,DR)是糖尿病最常见的眼部微血管并发症,是糖尿病患者视力受损和致盲的主要原因。根据国际糖尿病联盟2021年数据,我国居民糖尿病发病率约9.98%(约1.41亿人),其中22.40%的患者并发DR,已经成为严重威胁人们生活质量和生命健康的公共卫生问题[1]。研究[2-3]表明,持续高血糖导致肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)等促炎因子和趋化因子大量释放而引发慢性炎症,损伤内皮细胞,是DR等糖尿病并发症的病理基础。Toll样受体4(TLR4)/髓样分化因子88(MyD88)/核转录因子-κB(NF-κB)通路是介导炎症因子释放的重要途径,在炎性机制中发挥着关键的作用[4]。有研究[5-7]报道,通过抑制TLR4/MyD88/NF-κB通路可有效减轻DR以及糖尿病心肌病、肾病等并发症。西红花苷是由鸢尾科植物番红花的干燥柱头中提取的一种水溶性类胡萝卜素,具有抗炎、抗氧化、降血脂等生物学活性[8-9]。研究[10]报道,西红花苷能够通过抑制TLR4/MyD88/NF-κB通路介导的炎性反应对缺血性脑卒中大鼠起到保护作用。西红花苷能够通过抑制氧化应激和炎性反应减轻糖尿病大鼠肾脏损伤[11],但西红花苷是否对DR具有影响尚未见文献报道。本研究通过制备DR大鼠模型,研究西红花苷对糖尿病大鼠视网膜病变的影响,并基于TLR4/MyD88/NF-κB通路探索其机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:清洁级7周龄雄性SD大鼠105只,体重210~250 g,由河北伊维沃生物科技有限公司提供,许可证号SCXK(冀)2020-002。分笼饲养,维持室温(24±1)℃、相对湿度(50±10)%,光暗12 h/12 h交替。
1.1.2 主要试剂:西红花苷(纯度≥98%)购自上海源叶生物科技有限公司(批号B21336);瑞沙托维(TLR4抑制剂)、核蛋白提取试剂盒、ECL发光液购自北京索莱宝生物科技有限公司;TNF-α、IL-1β、IL-8、可溶性细胞间黏附分子1(sICAM-1)ELISA法检测试剂盒购自南京建成生物工程研究所;兔抗大鼠TLR4、MyD88、NF-κB p65、高迁移率族蛋白B1(HMGB1)、β-actin、H3抗体购自北京博奥森生物技术公司;羊抗兔IgG二抗购自美国 SantaCruz公司。
1.2 实验方法
1.2.1 DR大鼠模型制备与给药:随机取20只大鼠设置为正常组,继续给予常规饲料喂养。剩余85只参照朱晓燕等[12]报道的方法制备DR大鼠模型:给予高糖高脂饲料喂养4周,禁食16 h后腹腔注射(IP)链脲佐菌素30 mg/kg,24 h和72 h后检测空腹血糖(FBG)均≥16.7 mmol/L,即可判定糖尿病大鼠模型制备成功;继续高糖高脂饲料喂养3个月后,检测FBG水平≥16.7 mmol/L,通过眼底血管荧光造影检测,出现眼底微血管荧光素渗漏和血管新生,则可判定DR大鼠模型制备成功。共造模成功82只,去除空腹血糖(FBG)水平最高和最低各1只后,将剩余80只DR大鼠模型随机分为模型组、西红花苷组、瑞沙托维组和西红花苷+瑞沙托维组,每组20只。西红花苷组IP给药30 mg/kg[11],瑞沙托维组IP给药3 mg/kg[13],西红花苷+瑞沙托维组IP给药30 mg/kg+3 mg/kg,正常组和模型组IP给予0.9%氯化钠溶液,注射体积均为5 ml/kg,1次/d,疗程12周。
1.2.2 视网膜厚度和血管通透性检测: ①治疗完成后,每组分别随机取10只大鼠,IP水合氯醛0.35 mg/kg麻醉后,左眼滴托品酰胺扩瞳,通过动物视网膜影像系统行光学相干断层扫描(10帧/s)进行视网膜厚度检测,测量点选择距视盘沿1.5 mm的位置,每隔30°角度测量1次,取平均值。②通过尾静脉注射伊文思蓝45 mg/kg,0.5 h后心脏灌流300 ml多聚甲醛溶液(浓度4%,速度先快后慢),取右侧眼球剥离视网膜、称重,研磨匀浆后加甲酰胺70 ℃恒温孵育12 h,3000 r/min离心10 min取上清液,测定610 nm处吸光度值后计算伊文思蓝含量。
1.2.3 视网膜病理学检查:取各组剩余的10只大鼠,颈椎脱臼处死,取左侧眼球视网膜,部分视网膜置于10 %中性甲醛溶液固定3 d,石蜡浸润包埋、4 μm切片、贴附于涂有多聚赖氨酸的防脱载玻片上、烤片,脱蜡水化后行HE染色,通过光学显微镜观察视网膜病理学改变。
1.2.4 视网膜细胞超微结构病变观察:取剩余部分左侧眼球视网膜,修饰成约1 mm×1 mm×1 mm小块后,分别于4%戊二醛溶液、2%锇酸中恒温4 ℃固定2 h,脱水后树脂包埋、60 nm超薄切片、醋酸铀和柠檬酸铅电子双染色处理后,通过透射电子显微镜观察视网膜细胞超微结构病变。
1.2.5 视网膜TNF-α、IL-1β、IL-8、sICAM-1含量检测:取右侧眼球视网膜,部分视网膜加入适量4 ℃预冷0.9%氯化钠溶液,研磨匀浆后3000 r/min离心10 min取上清液,按照试剂盒操作说明进行检测。
1.2.6 视网膜TLR4、MyD88、总NF-κB p65、胞核NF-κB p65、HMGB1蛋白表达检测:取部分右侧眼球视网膜,加入适量4 ℃预冷RIPA裂解液研磨匀浆、冰上静置30 min后,12 000 r/min离心25 min取上清液即为总蛋白;取剩余部分右侧眼球视网膜,遵照核蛋白提取试剂盒说明提取核蛋白。BCA法测定蛋白含量并配平后,以40 μg蛋白量上样、SDS-PAGE凝胶电泳(80 V、0.5 h,100 V、1.5 h)分离蛋白、湿法转膜(300 mA、1 h),5%脱脂牛奶室温封闭2 h,一抗稀释液4 ℃避光孵育过夜,二抗稀释液室温孵育1.5 h,ECL显色,通过Image J软件分析蛋白条带灰度值后,分别以β-actin和H3为内参计算目标蛋白的相对表达量。
2 结 果
2.1 各组大鼠视网膜厚度和血管通透性比较 与正常组比较,模型组视网膜厚度降低、血管通透性升高(均P<0.05)。与模型组比较,西红花苷组、瑞沙托维组和西红花苷+瑞沙托维组视网膜厚度升高、血管通透性降低(均P<0.05)。与西红花苷组或瑞沙托维组比较,西红花苷+瑞沙托维组视网膜厚度升高、血管通透性降低(均P<0.05)。见表1。
表1 各组大鼠视网膜厚度和血管通透性比较
2.2 各组大鼠视网膜病理性改变比较 正常组大鼠视网膜组织结构完整,分层清晰,各层细胞形态正常、排列规则。模型组视网膜可见结构紊乱、分层界限不清,内外核层变薄,神经节细胞和内外核层细胞数量减少、排列不规则、空泡样变,神经纤维层水肿、炎性细胞浸润,新生血管形成等病理性改变。与模型组比较,西红花苷组、瑞沙托维组和西红花苷+瑞沙托维组视网膜病理性改变均明显改善,西红花苷+瑞沙托维组效果优于西红花苷组和瑞沙托维组。见图1。
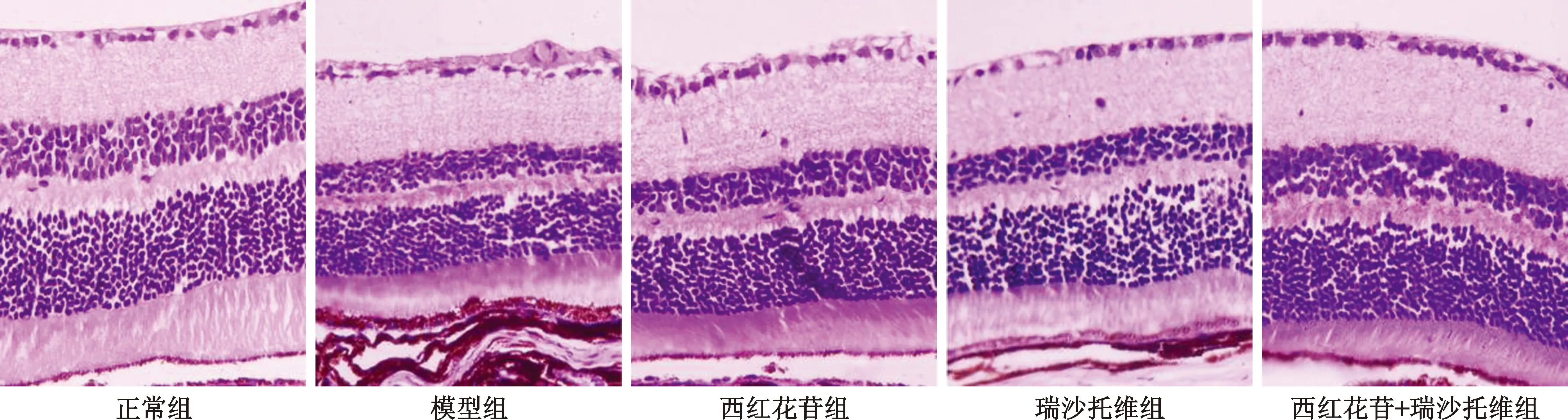
图1 各组大鼠视网膜病理性改变比较(HE染色,×200)
2.3 各组大鼠视网膜细胞超微结构改变比较 正常组大鼠视网膜内外节层细胞和内外核层细胞超微形态正常,线粒体结构完整,未见新生毛细血管。模型组视网膜感受器外节层细胞排列疏松紊乱、水肿;感受器内节层细胞可见胞膜破裂,内质网扩张、颗粒脱落;外核层细胞可见数量减少、间隙增大,线粒体肿大、嵴断裂;内核层细胞可见线粒体基质空泡化,囊性细胞器扩张;可见毛细血管新生。与模型组比较,西红花苷组、瑞沙托维组和西红花苷+瑞沙托维组视网膜感受器内外节层及内外核层细胞超微结构病变明显改善,新生毛细血管明显减少,其中西红花苷+瑞沙托维组效果优于西红花苷组和瑞沙托维组。见图2。
2.4 各组大鼠视网膜TNF-α、IL-1β、IL-8、sICAM-1含量比较 与正常组比较,模型组视网膜TNF-α、IL-1β、IL-8、sICAM-1含量升高(均P<0.05)。与模型组比较,西红花苷组、瑞沙托维组和西红花苷+瑞沙托维组TNF-α、IL-1β、IL-8、sICAM-1含量降低(均P<0.05)。与西红花苷组或瑞沙托维组比较,西红花苷+瑞沙托维组TNF-α、IL-1β、IL-8、sICAM-1含量降低(均P<0.05)。见表2。

表2 各组大鼠视网膜TNF-α、IL-1β、IL-8、sICAM-1含量比较(ng/L)
2.5 各组大鼠视网膜TLR4、MyD88、总NF-κB p65、胞核NF-κB p65、HMGB1蛋白表达比较 与正常组比较,模型组视网膜TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白相对表达量及胞核NF-κB p65/总NF-κB p65比值升高(均P<0.05)。与模型组比较,西红花苷组、瑞沙托维组和西红花苷+瑞沙托维组TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白相对表达量及胞核NF-κB p65/总NF-κB p65比值降低(均P<0.05)。与西红花苷组或瑞沙托维组比较,西红花苷+瑞沙托维组TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白相对表达量及胞核NF-κB p65/总NF-κB p65比值降低(均P<0.05)。见表3。
表3 各组大鼠视网膜TLR4、MyD88、总NF-κB p65、胞核NF-κB p65、HMGB1蛋白相对表达量及胞核NF-κB p65/总NF-κB p65比值比较
3 讨 论
西红花苷为番红花的主要活性成分,邢甜甜等[11]报道西红花苷能够通过抑制氧化应激和炎性反应减轻糖尿病大鼠肾脏损伤。本研究采用普遍认可的高糖高脂饲料喂养加IP链脲佐菌素的方法构建DR大鼠模型,结果显示,经西红花苷治疗能够明显提高DR大鼠视网膜厚度、降低血管通透性,减轻视网膜结构紊乱、分层界限不清,内外核层变薄,神经节细胞和内外核层细胞数量减少、排列不规则、空泡样变等病理性改变;改善感受器内外节层细胞、内外核层细胞超微结构病变,抑制毛细血管新生。这与Rong等[14]和Yang等[15]研究报道相似。提示西红花苷对DR大鼠视网膜组织病变和细胞超微结构病变具有保护作用。
炎性反应是DR发生和进行性加重的重要因素,Tang等[16]研究发现持续高血糖将破坏内皮细胞,引发白细胞聚集并释放TNF-α、IL-1β、IL-8、sICAM-1等炎症因子,诱发炎性反应。TNF-α、IL-1β、IL-8可促进白细胞、巨噬细胞等聚集和释放炎症因子,sICAM-1可促进炎性浸润,加重炎性反应[17-18]。Toll样受体 (TLRs)属于Ⅰ型跨膜糖蛋白受体,是机体免疫及炎性反应的关键介质,其中TLR4亚型在哺乳动物细胞广泛表达,李晓洁等[19]报道TLR4信号通路在DR进展过程中发挥着重要调控作用。MyD88是TLR4信号通路的关键衔接因子和信号配体,MyD88由C-端TIR结构域、中间域、N端死亡域共三部分构成,TLR4能够与C-端TIR结构域结合激活MyD88。生理状态下,NF-κB与其抑制剂(IκBα)结合定位于细胞质中,激活态MyD88的N端死亡域可诱导IκBα磷酸化,促使NF-κB游离活化与核转位,进而诱导TNF-α、IL-1β、sICAM-1等炎症因子转录表达。HMGB1为哺乳动物细胞广泛表达的一种高度保守的核蛋白,可诱导炎症因子表达而促进炎性反应[20-21]。Alomar等[22]报道HMGB1可激活TLR4信号通路介导的炎性反应。本研究结果显示,经西红花苷治疗能够明显降低DR大鼠视网膜TNF-α、IL-1β、IL-8、sICAM-1含量和TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白表达量,降低胞核NF-κB p65/总NF-κB p65比值,提示西红花苷具有抑制DR大鼠炎性反应的作用,其机制可能与抑制TLR4/MyD88/NF-κB通路和NF-κB核转位有关。
为了验证上述推论,本实验设置了瑞沙托维(TLR4抑制剂)组和西红花苷+瑞沙托维组,结果显示,瑞沙托维对DR大鼠视网膜厚度和血管通透性、视网膜组织病理性改变和超微结构病变、炎性反应及TLR4/MyD88/NF-κB通路相关蛋白的调控方向与西红花苷相同,西红花苷+瑞沙托维对DR大鼠上述各指标的调控作用明显优于西红花苷组和瑞沙托维组。从而进一步证实了西红花苷对DR大鼠视网膜的保护作用与抑制TLR4/MyD88/NF-κB通路和NF-κB核转位有关。
综上所述,西红花苷可降低DR大鼠视网膜血管通透性,减轻视网膜组织病变和细胞超微结构病变,其机制可能与抑制TLR4/MyD88/NF-κB通路和NF-κB核转位,减少促炎因子释放有关。本实验结果为西红花苷做为DR治疗备选药物提供了理论依据,但本研究仅在动物体内实验水平进行了考察,其作用机制还有待于在体外细胞实验水平进一步验证。
