生物模板辅助水热合成介孔氧化镁及其除氟性能
2023-05-13张家祺杨海明
张家祺,李 荻,李 颖,杨海明
(1.辽宁科技大学 化学工程学院,辽宁 鞍山 114051;2.辽宁科技大学 国际教育学院,辽宁 鞍山 114051)
在地球上水资源中广泛存在氟离子[1]。受人类活动影响,部分水体中氟离子超标,当人体摄入过量时,会引起一系列毒性反应。世界卫生组织建议饮用水中氟离子浓度的可接受限度为0.5 至1.5 mg/L[2]。
为解决水体中氟离子污染,常用除氟方法为膜分离法、混凝-沉淀法、离子交换法和吸附法等。吸附法具有成本低、操作简易、绿色环保等优点,很有发展前景。康宁等[3]以MgCl2为镁源,尿素为沉淀剂,采用均匀沉淀法,经过水热-煅烧后得到多孔球状氧化镁,比表面积高达65.19 m2/g。在初始氟离子质量浓度为9.9 mg/L 时,吸附量达到18.72 mg/g,除氟率达到86.14%。黄洋龙等[4]采用微波-煅烧法制备镁铁比依次为4∶1、2∶1 和1∶2 三种磁性氧化镁样品。当水体pH 值为5.0~8.0 时,磁性氧化镁具有较强的除氟能力,饱和吸附量达到62.35 mg/g。汪爱河等[5]采用双滴共沉淀法制备MgO-LDH水滑石去除溶液中氟。适宜的MgOLDH 投加量为10 g/L,溶液初始pH 值为6.40,MgO-LDH对氟的最大吸附量为16.60 mg/g。已有研究表明,在制备氧化镁过程中存在颗粒团聚问题,导致氧化镁比表面积减小,吸附活性位点减少。针对这个问题,本文提出利用废弃物香蒲绒为生物模板,采用生物模板辅助水热合成介孔氧化镁,生物模板经过高温煅烧后部分基团被去除,留下孔隙结构,使氧化镁的比表面积增加,避免介孔氧化镁的团聚。
1 实验材料与方法
1.1 CFs-MH的制备
将香蒲绒(CFs)放入25%的无水乙醇中洗涤后捞出烘干,称取1.5 g于烧杯中,先加入10 mL无水乙醇,再加入0.25 mol/L 的MgCl2和0.25 mol/L的CO(NH2)2,配成50 mL 混合溶液,搅拌后超声20 min,使CFs均匀分散在溶液中。将上述混合溶液转移至100 mL聚四氟乙烯衬里的不锈钢高压釜中,密封并在180 ℃水热处理12 h,自然冷却至室温,经离心洗涤得到黑色沉淀,在60 ℃下干燥。再将黑色沉淀于马弗炉中500 ℃煅烧3 h,升温速度5 ℃/min,得到白色介孔氧化镁吸附材料,记做CFs-MH。为了方便对比观察,按照上述条件,不加MgCl2得到CFs的遗留态样品,制备过程中未加入香蒲绒的MgO样品为H-MgO。
1.2 静态吸附实验
将制备的CFs-MH 投加到100 mL 含氟溶液中,在120 r/min转速的恒温摇床中反应90 min,并在预定时间从悬浮液中取出约1 mL,通过离心快速分离残余吸附剂,并用0.22 μm 过滤头过滤,以备后期检测。分析吸附剂用量、pH值、共存离子等因素对CFs-MH脱氟效果的影响,建立吸附等温模型和吸附动力学模型。
1.3 吸附剂再生实验
将使用过的吸附剂,用0.5 mol/L NaOH 浸泡1 h后,进行离心,用去离子水洗至中性,在恒温烘干箱中60 ℃干燥,将烘干所得样品放入马弗炉中450 ℃煅烧1 h,得到的试样为吸附剂再生样。
1.4 吸附等温模型
分别用Langmuir[6]和Freundlich[7]模型拟合静态吸附实验数据。Langmuir等温吸附模型主要假设:吸附剂表面均匀,吸附位点的吸附能均相同,吸附过程属于单分子层吸附;当吸附剂表面被单层吸附质分子覆盖时,吸附量达到理论最大值,从而预测吸附剂的饱和吸附量[8]。Freundlich等温吸附模型主要假设:吸附剂表面存在许多吸附能不同的吸附点位,吸附过程属于多层非均匀吸附[9]。
Langmuir等温方程
式中:qe为氟离子的平衡吸附量,mg/g;Ce为吸附平衡时溶液中剩余氟离子的量,mg/L;qe,m为饱和吸附量,mg/g;K为吸附系数,L/mg。
Freundlich等温方程
式中:Kf为吸附常数,L/mg;n为Freundlich常数。
1.5 吸附动力学模型
吸附动力学能够准确预测吸附过程中污染物从溶液中被去除的速率,而反应速率是催化反应动力学研究中最重要的参数。为了进一步探究吸附机理,分别采用准一级动力学模型[10]和准二级动力学模型[11]对样品的吸附过程进行拟合。
准一级动力学模型表达方程式
式中:qe为氟离子的平衡吸附量,mg/g;qt为时间t时刻氟离子的吸附量,mg/g;K1准一级反应方程速率常数,min-1。
准二级动力学模型表达方程式
式中:qe为氟离子的平衡吸附量,mg/g;qt为时间在t时刻氟离子的吸附量,mg/g;K2为准二级反应方程速率常数,g/(mg·min-1)。
2 CFs-MH吸附试样表征及分析
采用XRD 对CFs-MH 的晶体结构进行表征,结果如图1所示。与活性氧化镁(JCPDS 89-4248)的PDF 卡库对比发现,CFs-MH 的(111)、(200)、(220)、(311)和(222)面具有活性氧化镁六角结构,强度较高的五个衍射峰分别出现在36.7°、42.8°、62.1°、74.6°、78.5°处,与活性氧化镁的相似度极高,峰强几乎相近,表明经过高温煅烧成功制备出活性氧化镁[12]。

图1 CFs-MH的XRD图谱分析及活性氧化镁的PDF卡(JCPDS 89-4248)Fig.1 XRD analysis of CFs-MH and PDF card of active magnesium oxide(JCPDS 89-4248)
采用SEM 对CFs 和CFs-MH 的形貌进行表征,结果如图2所示。相同条件下制备的CFs具有管状形态。加入镁盐后制备的CFs-MH,有珊瑚状的氧化镁包覆在CFs管状表面,形成部分管状的介孔氧化镁材料,既有助于氧化镁的成型,也增加了氧化镁的比表面积。

图2 CFs和CFs-MH的SEM图Fig.2 SEM images of CFs and CFs-MH
利用N2吸附/脱附等温线对H-MgO、CFs-MH的微观结构进行表征,结果如图3所示。两种材料吸附等温线均属于Ⅳ型等温线。H-MgO 的BET比表面积为40.028 9 m²/g,平均孔径为7.12 nm,而CFs-MH 的BET 比表面积为76.444 3 m²/g,平均孔径为17.29 nm。H-MgO 和CFs-MH 均为介孔材料[13]。CFs的加入增大了MgO的比表面积及平均孔径。
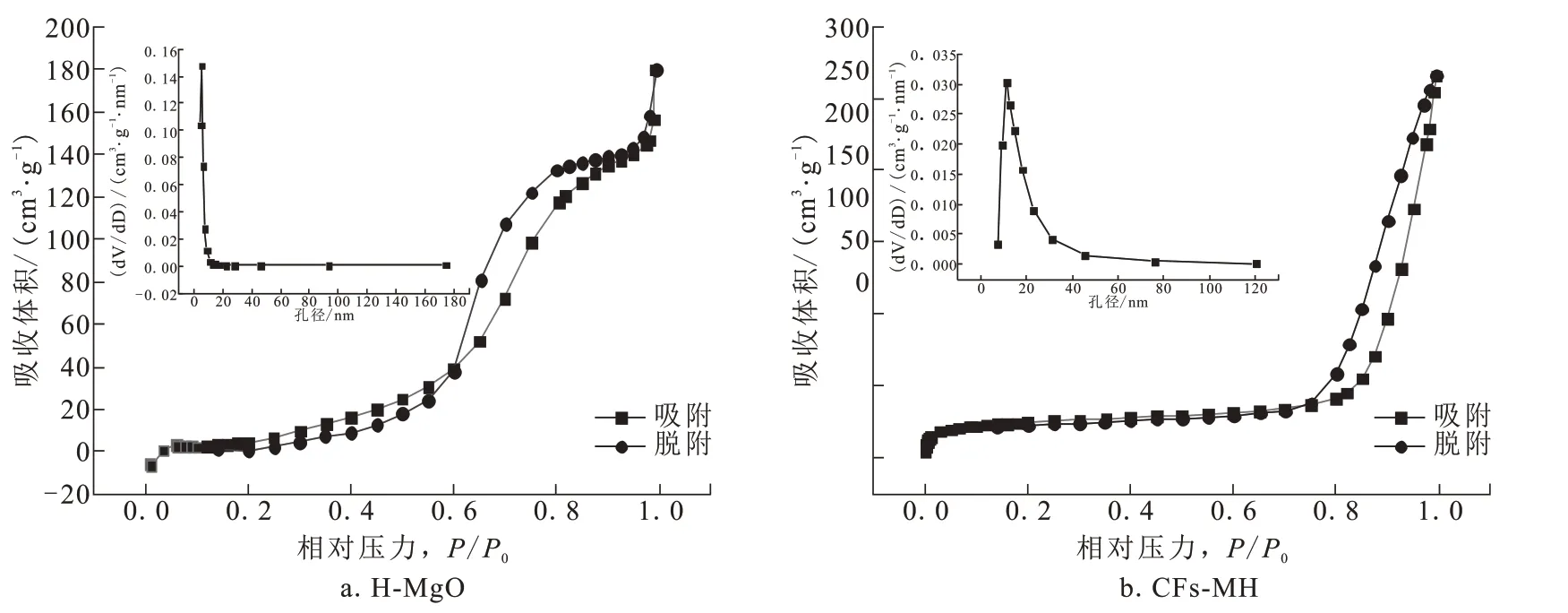
图3 H-MgO和CFs-MH的BET表征分析图Fig.3 BET characterization analysis diagram of H-MgO and CFs-MH
将除氟前的CFs-MH 和除氟后的CFs-MH-F进行FT-IR 表征,结果如图4 所示。CFs-MH 在3 700 cm-1和3 300 cm-1处的吸收峰较弱,因为CFs-MH 吸附空气中的水分,表面有少量Mg(OH)2产生[14]。440 cm-1峰与Mg-O拉伸振动有关。除氟后在3 700 cm-1和3 300 cm-1处的吸收峰明显加强,CFs-MH在水溶液中发生水化反应生成Mg(OH)2。在509 cm-1出现一个新的吸收峰,为Mg-F 拉伸振动峰。除氟前后的FT-IR 图谱表明,CFs-MH 在水中发生水化反应,生成Mg(OH)2,表面存在大量的羟基,F-与-OH 进行离子交换,从而达到除氟的目的[3]。

图4 CFs-MH、CFs-MH-F的FT-IR图Fig.4 FT-IR diagram of CFs-MH and CFs-MH-F
3 静态吸附实验
3.1 吸附剂用量
将CFs-MH 按吸附剂用量为0.2~2 g/L 投加到100 mL浓度为50 mg/L的含氟溶液中,在25 ℃、pH=7.0 和120 r/min 的恒温摇床中反应90 min,考察吸附剂用量对除氟效果的影响,结果如图5 所示。随着吸附剂用量的增加,除氟率先快速增加,之后逐渐趋于稳定。因为吸附剂量增加,增大F-与吸附剂的接触机会,即增加了吸附剂的表面活性位点[15]。当吸附剂量超过1.2 g/L 时,反应90 min的脱氟率达到98%以上,吸附量达到49 mg/g 以上,对F-的吸附趋于饱和,去除率几乎不再变化。
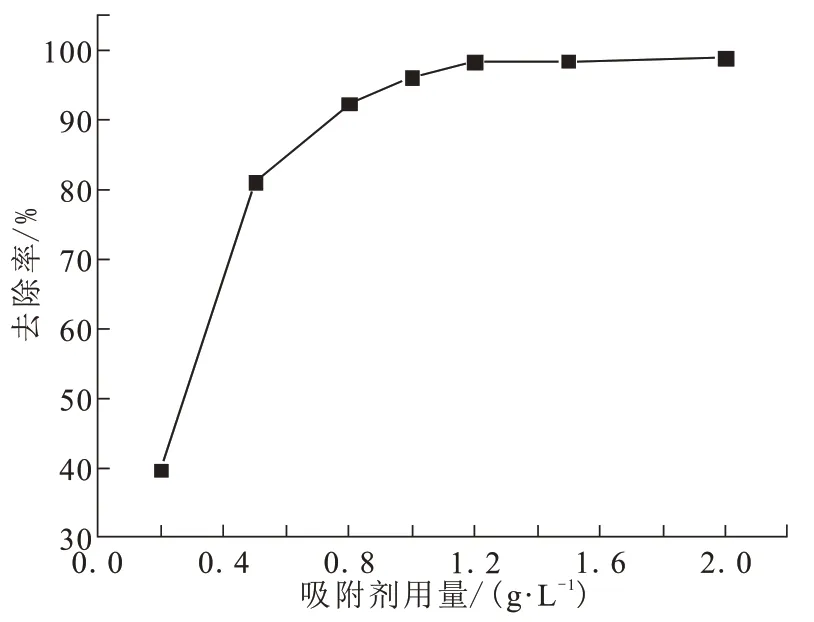
图5 不同吸附剂用量对除氟率的影响Fig.5 Influence of different adsorbent dosage on fluoride removal rate
对于50 mg/L氟离子溶液,按1.2 g/L的固液比投加CFs-MH,反应90 min 后,溶液中剩余氟离子浓度能够达到《国家生活饮用水卫生标准GB5749-2006》的1 mg/L以下。因此,后续实验中吸附剂投加量取1.2 g/L。
3.2 pH值
pH值对脱氟效果的影响如图6所示。当溶液初始pH 值在2~11 范围内,吸附剂对氟离子的去除率变化不大,在92%~98%;当pH值为12时,氟离子的去除率迅速下降至58%。因为pH 值较低时,溶液中大量的H+与CFs-MH 的OH-基团结合,遇到溶液中呈负电的F-时,会发生静电吸引,从而促进反应的进行;在pH 值较高时,溶液中大量的OH-与CFs-MH 的基团结合,使CFs-MH 表面呈负电,与溶液中的F-产生静电排斥,从而抑制F-的吸附[4]。

图6 pH值对除氟率的影响Fig.6 Effects of pH values on fluoride removal rate
3.3 共存离子
在实际废水中常常会有Cl-、SO42-等阴离子,吸附过程中可能会与F-产生竞争,对脱氟效率产生影响。将CFs-MH 分别投加到与F-单独共存的Cl-、SO42-、NO3-、HCO3-、CO32-、PO43-溶液中,共存阴离子浓度分别为100、200、300、400、500 mg/L,实验结果如图7 所示。随着共存离子浓度的增加,Cl-、SO42-、NO3-、HCO3-、CO32-对F-去除率影响不大;随着PO43-浓度的增加,对F-的去除率明显降低,当PO43-浓度为500 mg/L 时,F-的去除率降至84.33%。这是由于MgO 基吸附材料对PO43-同样有吸附作用,因此PO43-和F-会在材料表面发生竞争吸附[16]。

图7 不同共存离子对氟去除率的影响Fig.7 Influence of different coexisting ions on fluorine removal rate
3.4 吸附再生实验
CFs-MH吸附氟完成后,用0.5 mol/L的NaOH浸泡1 h后,离心洗涤至中性,60 ℃干燥后,450 ℃煅烧1 h,使CFs-MH再生。利用再生后的CFs-MH进行吸附氟实验,循环5 次,实验结果如图8 所示。随着循环次数的增加,F-的去除率逐渐降低,由首次使用的98.39%降至55.65%,吸附量从40.96 mg/g降至23.19 mg/g。这是由于在循环实验过程中,随着吸附剂煅烧次数的增加,吸附剂的孔道逐渐坍塌,孔径变小,吸附位点减少,吸附效果逐渐接近于氧化镁原料[17]。

图8 循环使用次数对氟去除率的影响Fig.8 Effect of recycling times on fluorine removal rate
3.5 吸附等温模型
吸附,当吸附剂表面被单层吸附质分子覆盖时,吸附量达到理论最大值,饱和吸附量为109.82 mg/g。随着温度的升高,饱和吸附量逐渐降低,表明吸附过程是放热反应,升高温度不利于氟离子的吸附[18]。
相同条件下,初始氟浓度为10、20、30、40、50、100、150、200 mg/L,温度为298、308、318 K,分别采用Langmuir 吸附等温模型和Freundich 吸附等温模型拟合平衡吸附量,如图9 所示,模型参数详见表1。Langmuir 模型的R2更接近1,表明CFs-MH 的吸附过程更符合Langmuir 吸附等温模型。CFs-MH吸附剂表面均匀,吸附过程属于单分子层

表1 Langmuir和Freundich吸附等温模型参数Tab.1 Parameters of Langmuir and Freundich adsorption isothermal models
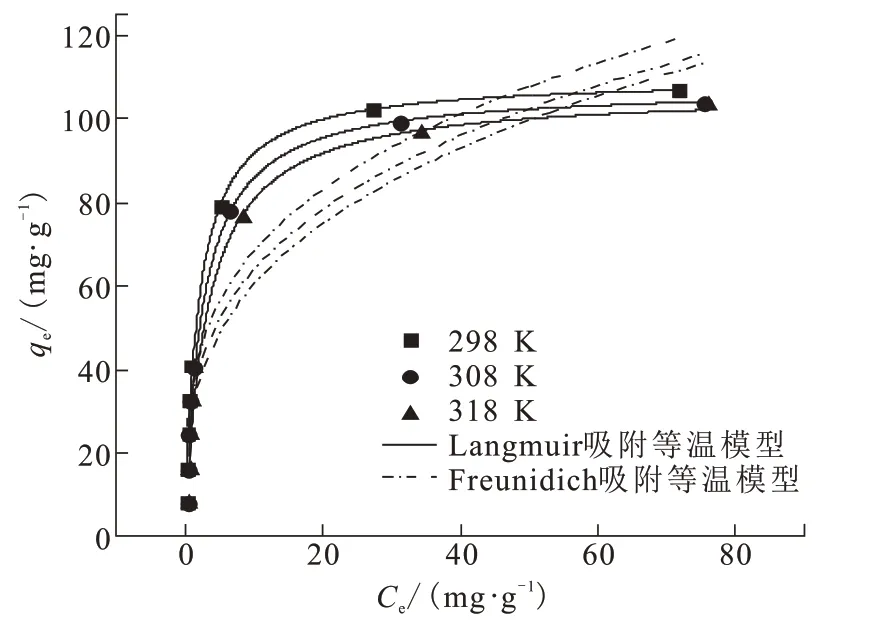
图9 不同温度下的Langmuir和Freunidich吸附等温模型Fig.9 Langmuir and Freunidich adsorption isotherm models at different temperatures
3.6 吸附动力学
采用初始F-浓度为10、20、30、40、50 mg/L 进行吸附实验,吸附剂用量1.2 g/L,25 ℃,90 min,摇床转速120 r/min。采用准一级动力学模型和准二级动力学模型拟合吸附曲线,并计算动力学参数,结果详见表2。以20 mg/L 的F-吸附过程为例,采用准一级动力学和准二级动力学拟合实验结果,如图10所示。准一级动力学模型的理论吸附量为16.3 mg/g,R2=0.761;准二级动力学模型的理论吸附量为16.303,R2=0.999:表明CFs-MH 除氟的动力学过程符合准二级动力学模型,CFs-MH吸附F-主要为化学吸附,通过离子交换去除氟离子。

图10 20 mg/L氟离子的吸附动力学曲线Fig.10 Adsorption kinetics curves of 20mg/L fluorion
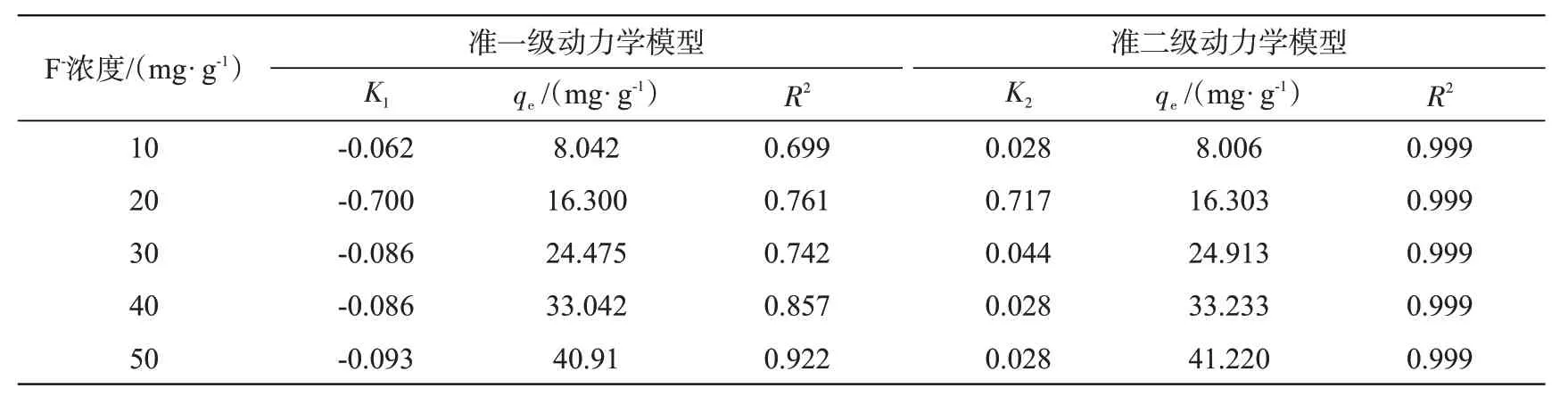
表2 不同温度下的动力学参数Tab.2 Dynamic parameters at different temperatures
4 结 论
以香蒲绒为生物模板、MgCl2为镁源、尿素为沉淀剂,成功制备介孔氧化镁材料。对于50 mg/L氟离子溶液,按1.2 g/L的固液比投加该材料,反应90 min 后,脱氟率达到98%以上,溶液中剩余氟离子浓度低于1 mg/L,符合国家生活饮用水卫生标准。
(1)当氟离子初始浓度为50 mg/L,吸附剂用量为1.2 g/L,pH 值2~11,25 ℃时,氟离子去除率几乎不受Cl-、SO42-、NO3-、HCO3-、CO32-共存离子影响,但受PO43-影响较大。
(2)5 次循环使用实验表明,随着循环次数的增加,氟离子的去除率逐渐降低,去除率由首次的98.39%降低到55.65%,吸附量从40.96 mg/g 降低到23.19 mg/g。
(3)Langmuir 吸附等温模型更符合CFs-MH的吸附过程,饱和吸附量为109.82 mg/g,吸附过程近似为单分子层吸附的放热过程。准二级动力学更符合CFs-MH 的吸附过程特征,主要为化学吸附,通过离子交换去除氟离子。
