甜瓜遗传转化技术的优化及DRs类基因的应用
2023-05-12万丽丽王转茸张学军曾红霞孙玉宏朱志坤
万丽丽, 王转茸, 汤 谧, 张学军, 任 俭, 曾红霞, 张 娜, 孙玉宏, 朱志坤
(1.武汉市农业科学院,湖北武汉 430065; 2.新疆农业科学院哈密瓜研究中心,新疆乌鲁木齐 830091;3.新疆农业科学院海南三亚农作物育种试验中心,海南三亚 572014; 4.湖北省武汉市蔡甸区农业农村局,湖北武汉 430199)
甜瓜是葫芦科甜瓜属一年生蔓性草本植物,果实营养丰富,是一种色、香、味俱佳的重要水果。甜瓜的类型品种非常丰富,根据植物学、生态学、农业生物学特征特性,将甜瓜分为两大类,即厚皮甜瓜和薄皮甜瓜。随着栽培技术、生长环境以及农产品供应市场的变化,现代园艺作物育种目标除了丰产、抗病、优质、早熟性状的要求更具体化,又提出了更多新的目标如可观赏性、营养强化以及与农业全产业链配套相结合等。种质资源是新品种选育的基础,目前种质资源创新的主要途径有3个,一是利用育种过程中产生的新品系及种质材料;二是利用天然突变或者诱变育种获得新育种材料;三是利用全基因组及泛基因组测序、来源不同种质资源的全基因组关联研究(GWAS)分析、重要性状遗传群体构建及目标基因精细定位等获得有育种价值的基因资源,进而利用分子标记技术、基因工程技术如转基因、基因编辑技术等创制丰富的种质资源[1-2]。
植物的遗传转化是通过将生物体基因组中所需的目的基因构建到表达载体中,通过科学技术方法将其转入到植物体内并成功表达,定向改变原材料遗传性状并获得稳定遗传表型的新品种的过程[3]。常用的遗传转化方法有直接转化法[包括聚乙二醇(PEG)介导法、电穿孔法、超声波法、基因枪法]、花粉管通道法和细胞转化法等。第二载体转化系统,主要包括农杆菌介导法和病毒介导法。目前最常用的转化方法为农杆菌介导法,包括含有Ti质粒的根癌农杆菌(Agrobacteriumtumefaciens)和含有Ri质粒的发根农杆菌(A.rhizogenes)。在农杆菌介导植物细胞转化过程中,Ti(Ri)质粒上的一段可转移的DNA(T-DNA)会随机插入植物基因组中,在植物体内转化后表达使得植物再生。目前农杆菌介导法应用最为广泛,适用于几乎所有的双子叶和单子叶植物。该方法具有转化效率高、遗传稳定性强、多以单拷贝或者低拷贝形式整合到植物基因组、基因沉默发生概率低等优势。目前已经在水稻、玉米、小麦、大豆、番茄等主要农作物中成功应用[4-5]。在甜瓜遗传转化研究中,离体再生是农杆菌介导转化的前提,目前以子叶为外植体进行离体再生是最为成熟的方法,器官直接再生途径对甜瓜具有普适性从而奠定了遗传转化的基础[6]。然而目前甜瓜遗传体系不完善,转化再生植株阳性率低。为了提高转化再生效率,研究者从2个关键因素入手开展研究。一方面是农杆菌介导的遗传转化率。不同葫芦科作物基因型对农杆菌的敏感性存在差异,比如在西瓜遗传转化试验中,EHA105的最高转化效率为0.92%,GV3101的转化效率为0.88%,LBA4404转化率为0%[7]。农杆菌的生长状态和活力对浸染效率影响较大,-80 ℃储存的农杆菌需要进行1~2次活化,达到对数生长期时活力最强。转化方法同样是提高转化效率的核心,利用再生能力强的细胞与农杆菌充分接触,采用纳米刷、超声波和真空渗透处理等方式可以减小农杆菌进入植物细胞的阻力[8]。另一方面是提高转化后细胞诱导胚再生能力。近年来,研究者通过超表达发育调控因子(DRs)可以极大地提高遗传转化效率[9-13]。在西瓜中超表达拟南芥AtGRF5、嵌合基因TaGRF4-OsGIF1和ZmWUS-ZmBBM能够显著提高遗传转化再生植株阳性率[7]。利用西瓜内源嵌合基因ClGRF4-GIF1可以将西瓜遗传转化效率提高9倍,突变ClGRF4内部的miR396的靶向位点能够将遗传转化效率提高到67.2%[14]。除了激素诱导芽再生,植物组织受伤也能够促进器官发生,AP2/ERF转录因子WOUNDINDUCEDDEDIFFERENTIATION1(WIND1)能够促使受伤位点的细胞脱分化并诱导愈伤组织形成,超表达WIND1以及同源基因WIND2-4能使得愈伤组织在无外源施加激素下继续生长[15-16]。此外,AP2/ERF转录因子PLT3、PLT5和PLT7参与机械损伤后维管组织的修复和再生,主要是通过与CUC2基因启动子直接结合后上调其表达,提高内源生长素含量从而促进维管组织再生[17]。
本研究以5种不同基因型厚皮甜瓜和4种不同基因型薄皮甜瓜为材料,利用农杆菌介导子叶外植体转化方法,从而筛选最优诱导芽再生培养基激素组合,适用于甜瓜的Basta除草剂浓度,促进农杆菌介导甜瓜子叶的浸染方法以及超表达不同发育调控基因(AtGRF5、AtWUS、AtPLT5、AtWIND1)对甜瓜遗传转化再生及转化效率等方面的研究,建立稳定高效的遗传转化技术体系,为甜瓜的基因功能鉴定及生物技术育种提供有效的途径。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 本试验所用厚皮甜瓜材料为都蜜5号(A1)、玉菇(A2)、雪蜜(A3)、柠檬蜜(A4)、虹玉(A5),21C-1自交系(C1),21C-2自交系(C2),薄皮甜瓜材料为美浓(B1)、绿宝(B2)、武农青玉(B3)、羊角蜜(B4),121自交系(D1),LB自交系(D2)。其中自交系种质在武汉市农业科学院武湖试验基地繁殖。
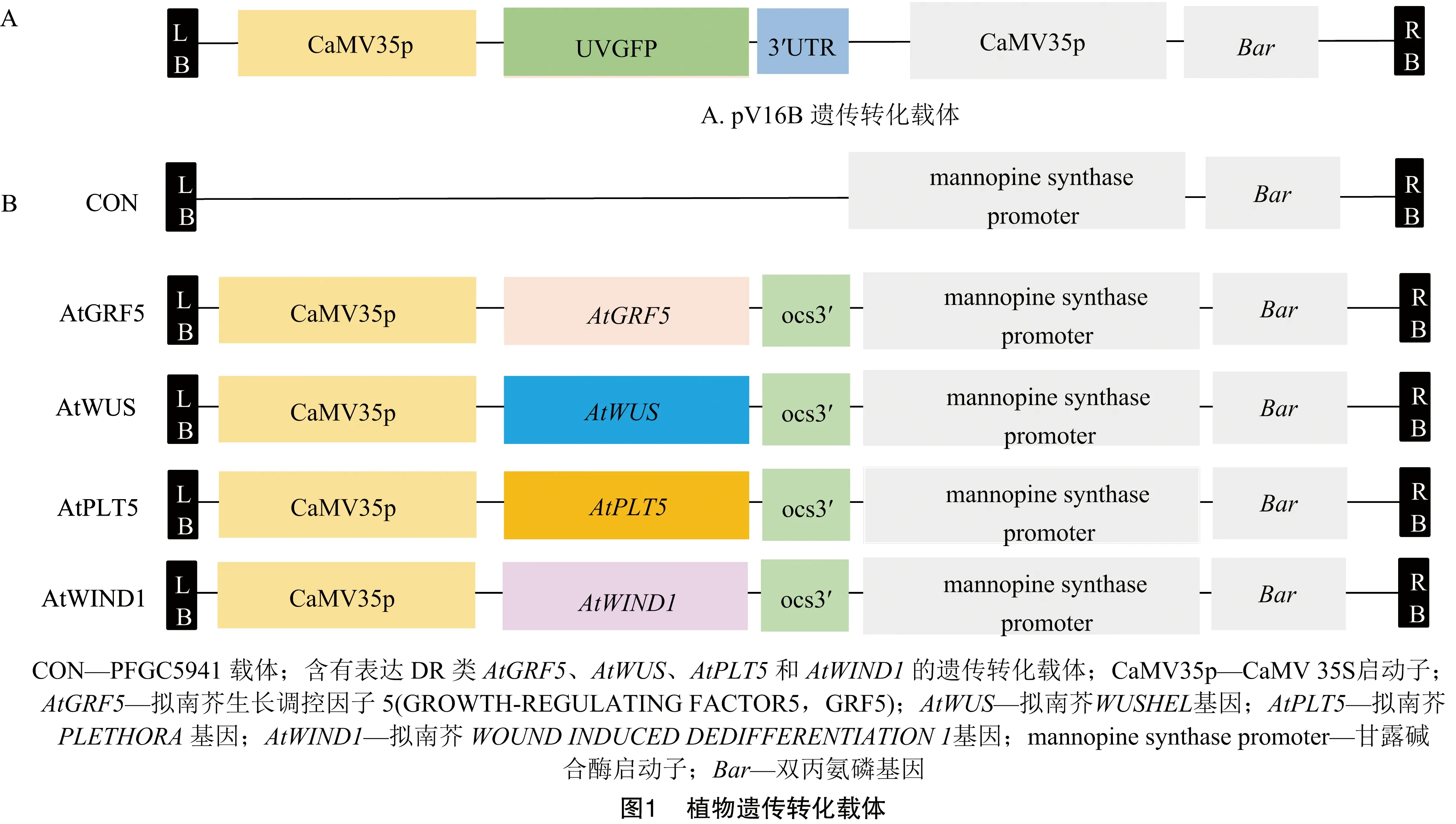
1.1.2 遗传转化载体和菌株 植物表达载体pV16B和PFGC5941载体图谱如图1所示。试验所使用的大肠杆菌(Escherichiacoli)感受态为DH10B,农杆菌感受态为EH105。
1.2 试验方法
1.2.1 发育调控基因的扩增 从拟南芥TAIR数据库中筛选得到AtGRF5(AT3G13960)、AtWUS(At2g17950)、AtPLT5(At5g57390)和AtWIND1(At1g78080)的编码序列(CDS),参考ClonExpress Ⅱ one step Cloning Kit (C112,Vazyme Biotech Co.,Ltd,南京) 引物设计方法(表1),由天一辉远生物科技有限公司合成。PCR反应体系:拟南芥cDNA 2 μL(50 ng/μL)、上游引物2 μL(50 μmol/L)、下游引物2 μL(10 μmol/L),2×Phanta Max Buffer 25 μL,Phanta Max Super-Fidelity DNA Polymerase 1 μL,用ddH2O定容至50 μL。混匀上述PCR反应体系后按照如下程序扩增,反应程序:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1.5 min,35个循环;72 ℃ 10 min。经过琼脂糖凝胶电泳检测,将正确的目标条带回收。

表1 DRs类表达载体构建相关引物
1.2.2 重组载体构建 用限制性内切酶NcoⅠ和BamH Ⅰ对PFGC5941质粒进行酶切。反应体系:
PFGC5941质粒 1 μg、NcoⅠ内切酶 0.7 μL(10 U)、BamHⅠ内切酶 0.7 μL(10 U)、10×Reaction Buffer 5 μL,用ddH2O定容至50 μL。37 ℃酶切3~4 h后胶回收。将“1.2.1”节中的目标片段与线性化PFGC5941载体通过同源重组连接,具体步骤参考ClonExpress Ⅱ one step Cloning Kit详细说明,37 ℃ 30 min后转化大肠杆菌,过夜培养筛选阳性克隆进行菌液PCR鉴定阳性重组子并送武汉擎科生物科技有限公司测序。
1.2.3 遗传转化载体 植物表达载体pV16B,包含植物抗性选择标记Bar(图1-A)。以PFGC5941载体为骨架,利用NcoⅠ和BamHⅠ酶切位点将AtGRF5(AT3G13960)、AtWUS(At2g17950)、AtPLT5(At5g57390)和AtWIND1(At1g78080)的CDS导入,所得的植物双元表达载体命名为AtGRF5、AtWUS、AtPLT5、AtWIND1(图1-B),转化农杆菌EHA105。
1.2.4 菌液制备及侵染 取5 μL 重组载体质粒转化农杆菌感受态EHA105,28 ℃培养2 d,挑取单克隆于5 mL含有50 μg/mL卡那霉素、25 μg/mL 利福平的液体LB培养基中,28 ℃摇菌(200 r/min)培养14~16 h。之后吸取200 μL菌液于装有20 mL液体LB培养基的150 mL三角瓶中,28 ℃摇菌(200 r/min)培养12~16 h。
1.2.5 不同浓度Basta除草剂筛选 取未浸染农杆菌的子叶外植体接种在3种浓度(2、5、10 mg/L) Basta除草剂的SIM培养基上筛选,培养环境为 25~26 ℃,7~14 d继代1次,4周后观察再生,考察外植体褐化数量。根据外植体褐化死亡的数量确定合适的筛选浓度。
1.2.6 在不同浓度激素组合培养基中诱导不定芽分化试验 为了确定适合于不同甜瓜材料子叶外植体不定芽诱导再生的激素组合,本试验参考黄瓜遗传转化试验中激素组合6-BA和ABA[8],设置3个不同浓度组合(0.5 mg/L 6-BA+1 mg/L ABA,1 mg/L 6-BA+1 mg/L ABA,2 mg/L 6-BA+1 mg/L ABA),用于筛选获得诱导不定芽的激素组合。计算再生外植体比例=(能产生再生芽的外植体数/接种外植体总数)×100%。
1.2.7 农杆菌介导的遗传转化试验培养基种类 发芽培养基(germination medium,GM)基础培养基为MS培养基(蔗糖30 g/L,琼脂粉8 g/L),0.5 mg/L 6-BA和1 mg/L ABA,pH值为5.85。农杆菌浸染培养基(inoculation medium,IM)基础培养基为MS培养基(蔗糖30 g/L),0.5 mg/L 6-BA和1 mg/L ABA,1.25 mmol/L吗啉乙磺酸(MES),pH值为5.70,高温灭菌后,加入200 mmol/L 乙酰丁香酮(AS)。共培养培养基(co-cultivation medium,COM)基础培养基为MS培养基(蔗糖30 g/L,琼脂粉8 g/L),0.5 mg/L 6-BA和1 mg/L ABA,1.25 mmol/L MES,250 μmol/L硫辛酸(LA),pH值为5.70,高温灭菌后,加入 200 mmol/L 乙酰丁香酮AS。不定芽诱导培养基(shoot induction medium,SIM)基础培养基为MS培养基(蔗糖30 g/L,琼脂粉8 g/L),根据不同基因型材料子叶外植体在 6-BA和ABA激素组合上不定芽再生率确定合适的浓度,pH值调节为5.85,高温灭菌后,加入200 mg/L Timentin抑菌剂和2 mg/L AgNO3。生根培养基(root induction medium,RIM)基础培养基为MS培养基(蔗糖30 g/L,琼脂粉 8 g/L),pH值为5.85,高温灭菌后,加入200 mg/L Timentin抑菌剂和2 mg/L AgNO3。
1.2.8 农杆菌介导的子叶外植体的遗传转化 (1)子叶外植体准备。挑选饱满甜瓜种子,温汤浸种2~3 h,剥除种壳,用75%乙醇消毒1 min,1.5%次氯酸钠处理10~15 min,无菌ddH2O冲洗3次,8~10 min/次。种子消毒后置于GM培养基上,28 ℃ 暗培养48 h,观察种子露白后将子叶横切成两半,保留近胚根端的一半,将胚根从胚上掰除,使得胚上出现“U”形缺口,此时的胚用于农杆菌浸染试验。(2)浸染农杆菌的准备。农杆菌EHA105包含植物双元表达载体pV16B(包含植物抗性选择标记Bar和GFP表达组件)。在LB(含50 mg/L卡那霉素和 25 mg/L 利福平)固体平板上划线,28 ℃培养48 h,挑取单克隆接种于YEB(含有50 mg/L 卡那霉素和 25 mg/L 利福平)液体培养基中,28 ℃,200 r/min 振荡培养24 h至D600 nm为0.5~0.6。5 000 r/min 离心收集菌体,用IM培养基重悬收集菌体,调节至D600 nm为0.3~0.4备用。(3)农杆菌浸染方法。用纳米刷(KITA,Nanotek Brush)对外植体近“U”形口区域一个方向轻刷表面4~5次以保证胚的表面出现微伤口,之后置于含有农杆菌悬浮液的三角瓶中。将外植体置于超声波仪器(KQ-100DV)中10 s,之后转移到真空干燥箱中,分别在-0.3、-0.5、-1.0 kPa压力下处理90 s。上述试验结束后将外植体置于无菌滤纸上吸干多余菌液,转移到铺上1层滤纸的COM培养基上,其中外植体背面朝下与滤纸直接接触。在26 ℃条件下暗培养72 h。(4)不定芽诱导培养。将共培养结束后的外植体用含有200 mg/L Timentin抑菌剂的无菌水漂洗3次,用无菌滤纸吸干表面水分,转移到SIM培养基(含合适浓度的Basta)中,其中“U”形口端插入培养基中,培养3 d后在荧光显微镜下观察外植体表面是否有荧光,培养14 d后继代培养,直到再生芽出现在荧光显微镜下观察。转化GFP外植体阳性率=(GFP荧光外植体数量/接种外植体总数)×100%;转化GFP再生植株比例=(能再生GFP阳性芽的外植体数量/接种外植体总数)×100%。(5)生根培养。将有GFP荧光芽的外植体转移到生根培养基中,直至根系正常发育后移至营养钵成苗。上述遗传转化试验在武汉市农业科学院作物所实验室完成,一个完整的试验周期大约需要3个月。
1.2.9 DRs类表达载体转化甜瓜外植体再生率以及阳性率分析 将DRs类表达载体(如图1-B)转化甜瓜A1、A2、B1、B2的外植体,在0.3 mg/L 6-BA 和Basta筛选剂的培养基上生长,统计能够再生芽的外植体数量。根据DRs载体上Bar基因设计引物BarF:5′-ATCGAGACAAGCACGGTCAA-3′、BarR:5′-CTGAAGTCCAGCTGCCAGAA-3′,检测再生芽转化的阳性率。再生芽外植体比例=(能再生芽的外植体数量/接种外植体总数)×100%。
1.3 数据处理
试验数据采用单因素方差分析和Duncan’s 多重比较分析不同处理之间的差异,差异显著性水平为α=0.01或者α=0.001,所有的统计分析均在SPSS 26.0中完成。
2 结果与分析
2.1 甜瓜子叶外植体对Basta筛选剂的耐受性分析
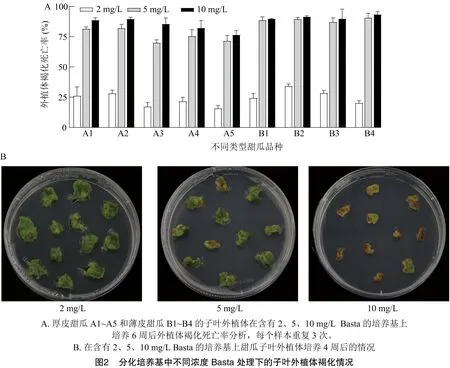
将厚皮甜瓜A1~A5,薄皮甜瓜B1~B4在施加2、5、10 mg/L Basta除草剂的MS培养基上,培养4周后开始统计外植体褐化死亡数量。如图2可见,大多数厚皮甜瓜和薄皮甜瓜外植体在2 mg/L Basta培养基上能够正常生长6周,但是第8周会开始褐化死亡。在 5 mg/L Basta培养基上生长4周后外植体变黄色并于6周褐化死亡,死亡率在80%以上,在10 mg/L Basta培养基上生长4周外植体全部褐化死亡。因此选择5 mg/L Basta作为遗传转化的筛选浓度。
2.2 不同浓度激素组合甜瓜不定芽诱导再生分析
甜瓜子叶外植体置于3种不同浓度激素组合的不定芽诱导培养基,分别为0.5 mg/L 6-BA和 1 mg/L ABA (简称T1),1 mg/L 6-BA和 1 mg/L ABA (简称T2),2 mg/L 6-BA和 1 mg/L ABA(简称T3)。1周后“U”形口区域开始膨大,14 d后产生不定芽(图3-A)。统计14 d后能够再生长度≥1 cm 不定芽的外植体比例,不同基因型甜瓜子叶在T2和T3培养基中诱导≥1 cm长度不定芽的再生频率极显著地高于T1培养基的诱导率。但是随着6-BA浓度从1 mg/L提高至2 mg/L,在大多数材料子叶外植体的“U”形口区域会产生大量芽丛或者类似于芽的结构,而正常叶形且长度≥1 cm芽的数量相比T1培养基再生芽的数量有所减少(图3-B)。
2.3 不同真空渗透压下转化效率和再生效率分析
为了提高农杆菌浸染转化外植体的效率,本试验对A1~A5、B1~B4甜瓜子叶用纳米刷处理后置于含有pV16B的农杆菌菌液中超声波处理10 s,之后分别置于-0.3、-0.5、-1.0 kPa压力的真空渗透仪器中处理90 s,共培养3 d后,转移到SIM培养基培养4~5 d,在荧光显微镜下观察,统计有GFP荧光的外植体数量并计算转化率(图4-A)。继续培养6周后统计外植体的存活率以及含有GFP荧光的不定芽数量并计算转化GFP再生芽的比例。结果显示,上述甜瓜子叶外植体在-1.0 kpa真空渗透压下转化率最高(图4-B),3种真空渗透压作用下甜瓜子叶外植体的存活率没有显著差异(图4-C)。经过在SIM培养基上培养8周,统计具有GFP荧光的不定芽数量,结果显示,在-1.0 kPa真空渗透压处理后转化pV16B外植体具有GFP荧光的不定芽数量极显著(P<0.001)高于-0.3 kPa和 -0.5 kPa 真空渗透压处理(图4-D)。

2.4 在甜瓜中超表达不同类型DRs表达载体统计再生出芽外植体的比例
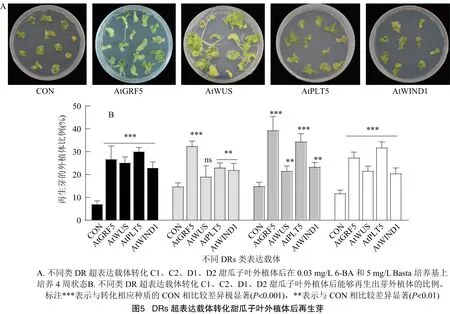
选择优良厚皮甜瓜种质C1、C2和薄皮甜瓜种质D1、D2分别转化CON(未含有DR表达组件对照载体)、AtGRF5、AtWUS、AtPLT5和AtWIND1遗传转化载体,之后将子叶外植体转移到低浓度6-BA (0.03 mg/L)和5 mg/L Basta培养基上培养,4周后统计产生不定芽的外植体数(图5-A),计算具有再生能力外植体比例。结果显示,在低浓度细胞分裂素以及Basta筛选剂作用下,在C1和D2种质中4种DRs元件的外植体再生出芽能力极显著高于不含有DRs表达元件的外植体再生能力;C2和D1的AtGRF5以及D1的AtPLT5转化后再生率极显著高于CON;C2中表达AtPLT5和AtWIND1,D1中表达AtWUS和AtWIND1的再生率显著高于CON(图5-B)。对所得到的超表达DRs再生植株进行PCR鉴定分析,分析再生阳性苗率(再生阳性苗率=再生阳性苗/接种外植体×100%)(表2),超表达AtGRF5和AtPLT5的C1和C2、超表达AtPLT5的D1,超表达AtGRF5的D2的转基因阳性苗占外植体比例极显著高于相应的对照CON。

表2 超表达DRs遗传转化甜瓜种质的分析
3 讨论与结论
选择适宜的外植体是遗传转化成功的关键因素之一,子叶、茎段、顶芽、幼胚、茎尖、胚轴等都具有转化能力。不同外植体或者同一外植体的不同发育阶段转化效率差异较大。具备分裂能力的细胞转化的效率最高。本研究在不同基因型甜瓜遗传转化试验中,选取种子在28 ℃预培养24~48 h,此时胚根长度为0.2~0.5 cm时的子叶外植体近轴端芽再生能力最强,并且在预培养基中加入细胞分裂素促进细胞分裂提高代谢活跃性,对遗传转化至关重要。另一方面提高农杆菌浸染外植体效率也是遗传转化试验中关键技术环节,很多研究者通过超声波处理、玻璃微珠处理、刀片微创和硼酸铝晶须等方法对外植体造成创伤[18-20],促进农杆菌与伤口区域充分接触。本研究采用纳米刷对甜瓜子叶外植体创制微伤口,此外与超声波和真空渗透处理相结合,减小农杆菌进入子叶外植体细胞的阻力[8]。试验结果显示,在-1.0 kPa真空渗透压处理后外植体的转化率最高,然而造伤和农杆菌双重因素极易产生严重损伤,进而影响外植体的存活率和再生能力。研究表明,在培养基中添加一些抗氧化剂如硝酸银(AgNO3)、半胱氨酸(Cys)、聚乙烯吡咯烷酮(PVP)、硫辛酸(LA)和二硫苏糖醇(DTT)等降低浸染后外植体褐化和死亡率[21-24]。其中LA是一种含硫抗氧化剂,广泛存在于原核和真核生物中,主要通过直接清除活性氧和活性氮,螯合金属离子发挥抗氧化作用,循环再生其余内源抗氧化剂,增加线粒体膜电位和细胞氧消耗来降低活性氧产生等,最终实现有效减少氧化应激反应的发生[25]。本研究在共培养基中添加低浓度的LA以减轻外植体造伤胁迫后的褐化,在诱导芽再生培养基中加入乙烯抑制剂AgNO3能够提高细胞中酶的活性,促进不定芽的再生。除了采用物理的方式提高农杆菌侵染外植体的效率,利用革兰氏阴性细菌如丁香假单胞杆菌的分泌系统T3SS在农杆菌中表达,将三型效应子T3Es如AvrPto、AvrPtoB、HopAO1运送到细胞中,以阻断植物PTI反应来提高农杆菌介导的转化效率[26]。
注:同列数据后不同大写字母表示每种甜瓜种质处理间差异极显著(P<0.001)。“ns”表示没有统计。
植物的再生和遗传转化是基因工程应用的基础。然而遗传转化及细胞再生能力由受体植物基因型与植物生长调节剂作用下的复杂调控网络所决定[27]。发育调控基因如WUS、PLT、ARF、GRF、LEC1、LEC2、BBM、LBDs、CUC1、CUC2、CLV3、STM和ESR是一类决定植物细胞命运的关键因素,它们的表达与愈伤组织的形成和植株再生能力紧密相关[28-29]。目前发育调控因子被挖掘并应用到农杆菌介导的组织培养和植物地上部注射转化试验[30]。WUS和BBM基因已经应用到单子叶作物再生研究中,在难转化的玉米自交系中超表达BBM和WUS2基因能够显著提高组织培养的转化效率,但是WUS和BBM基因在双子叶植物中应用的成功案例较少[13,31]。Maher等将含有来源于玉米的WUS2、STM和IPT与CRISPR元件共表达的农杆菌混合后注射到烟草侧芽生长点获得遗传转化且基因编辑的植株[30]。GRF基因是植物特异的转录因子,常以GRF-GIF转录复合体的形式促进营养和生殖器官原基细胞的发育。其中超表达GRF5能够促进愈伤组织分化以及芽的形成[10]。PLT5是植物组织受伤后茎秆维管修复的重要调控基因,在拟南芥中超表达PLT5能够促进在无细胞分裂素培养基上愈伤组织再生得到苗[32],在高浓度细胞分裂素作用下,PLT5诱导表达量超过WUS,从而促进了芽的再生[33]。当PLT5和WUS共表达时,能够协同促进胚性愈伤组织的形成并重塑细胞发育途径获得再生芽。WIND1也是植物机械损伤后促进伤口处维管形成层细胞分裂并交织连接的关键基因,在无外源植物生长调节剂作用下超表达拟南芥的WIND1能够促进愈伤组织分化,表达调控网络相关基因分析得出WIND1能够直接上调ESR1基因的表达从而激活CUC1介导的芽再生发育途径[34]。由于上述部分DRs基因可以在没有细胞分裂素的培养基中诱导胚发生,为避免在高浓度植物激素作用下超表达DRs基因会导致再生芽畸形、植物形成困难的问题,本研究在低浓度细胞分裂素的培养基中,超表达AtGRF5、AtWUS、AtPLT5和AtWIND1能够促进甜瓜“U”形口不定芽的正常再生,其中AtGRF5和AtPLT5在个别甜瓜材料中促进再生芽比例与对照相比呈现极显著差异。AtPLT5的作用是细胞全能性的获得(pluripotency acquisition),促进愈伤组织的分化进而转向胚性芽再生发育途径,AtWIND1是促进芽原生分生组织(shoot promeritem)分化,AtWUS是芽祖细胞(shoot progenitor)形成的基因,决定着再生器官如芽组织的分化,在芽从头形成的信号途径中,PLT基因位于最上游。GRF基因与GIF形成复合体调控着植物器官原基细胞的分化,超表达GRF类基因能够促进植物器官的发生[10],此外GRF5与GIF1-SWI/SNF形成复合体继而解除PRC2复合体对其他发育调控因子的抑制,最终重塑细胞再生[29]。因此,面对甜瓜遗传转化效率偏低的现状,需要依据模式作物分生组织再生调控途径,结合甜瓜维管形成层的发育特征,充分利用DRs基因资源才是重要的解决途径。
