鞣花酸通过调控miR-1254表达抑制口腔鳞癌HSC3细胞增殖、迁移和侵袭的机制
2023-05-12邓莹莹吕永利夏天刘进刘淼
邓莹莹 吕永利 夏天 刘进 刘淼
口腔鳞状细胞癌,简称口腔鳞癌,是颌面部常见的恶性肿瘤,其发病率呈增长趋势[1]。由于口腔鳞癌侵袭性较高,易发生淋巴结转移和远处转移,患者术后易复发,其治疗面临较大挑战[2]。因此,急需寻找治疗口腔鳞癌的新途径。鞣花酸是一种在各种软果和坚果等植物中广泛存在的多酚二内酯,具有抗氧化、抗炎和抗纤维化等生物活性[3-5]。随着对鞣花酸研究的深入,发现其还具有抗肿瘤作用。研究显示,鞣花酸可抑制皮肤基底细胞癌细胞增殖和侵袭,并诱导其凋亡,有望成为治疗该肿瘤的新药物[6];鞣花酸可通过抑制ERK1/2降低雌激素诱导的乳腺癌细胞的增殖能力[7];鞣花酸可能通过阻滞胰腺癌细胞的细胞周期进程及下调细胞中COX-2和NF-κB的蛋白表达抑制其增殖,并诱导其凋亡,发挥一定抗胰腺癌作用[8]。然而,鞣花酸能否影响口腔鳞癌细胞的恶性行为还未知。miR-1254是一种微小RNA(miRNA),其在口腔鳞癌组织中表达下调,上调miR-1254可抑制口腔鳞癌的发展进程[9]。本研究以miR-1254为切入点,探究了鞣花酸影响HSC3细胞增殖、迁移及侵袭的分子机制,以期为其用于口腔鳞癌的治疗提供一定的实验依据。
1 资料与方法
1.1 一般资料 39例口腔鳞癌组织及癌旁组织来自2018年3月至2020年3月于本院行手术治疗的口腔鳞癌患者,其中男24例,女15例;平均年龄(49.35±7.58)岁。患者均首次确诊,且术前未进行治疗。研究符合《赫尔辛基宣言》原则。
1.2 细胞与试剂 HSC3细胞系,中国科学院上海细胞库;胎牛血清,浙江天杭;CCK-8试剂盒、RPMI 1640培养液和BCA蛋白检测试剂盒,北京索莱宝;miRNA提取试剂盒、逆转录试剂盒和PCR试剂盒,大连宝生物;E-cadherin、N-cadherin和GAPDH抗体,中国Abcam公司;引物序列、miR-1254 模拟物(mimcs)和抑制剂(anti-miR-1254)、模拟对照序列(miR-NC)和抑制剂阴性序列(anti-miR-NC),上海生工;LipofectamineTM2000试剂盒,美国Invitrogen公司。
1.3 方法
1.3.1 细胞培养:复苏HSC3细胞,用完全培养液(含10% 胎牛血清的RPMI 1640培养液)置于CO2培养箱中培养。
1.3.2 CCK-8法检测细胞增殖抑制率:于96孔板中接种200 μl HSC3细胞(5.0×104个/ml),培养4 h后,弃培养液,分为对照组和鞣花酸低、中、高剂量组。鞣花酸低、中、高剂量组细胞分别用含2、4、8 μg/ml[8]鞣花酸的培养液孵育细胞,对照组用不含鞣花酸的培养液孵育细胞。孵育24 h后,均加10 μl CCK-8,孵育2 h,用酶标仪(波长450 nm)检测各孔吸光度(A)值。细胞抑制率(%)=(A对照组-A实验组)/A对照组×100%。
1.3.3 克隆形成实验检测细胞克隆数:于6孔板中接种2.5 ml HSC3细胞(5.0×104个/ml),培养4 h后,弃培养液,按1.3.2分组处理。每2天更换1次,孵育14 d。弃培养液,将细胞用多聚甲醛固定及结晶紫染色后,显微镜观察,计数克隆形成数。
1.3.4 划痕实验检测细胞迁移:于6孔板中接种2.5 ml HSC3细胞(5.0×104个/ml),培养4 h后,弃培养液。于各孔底部划两条等间距的平行线,间距记为d0h,并去除划痕间细胞。然后按照1.3.2分组处理。孵育24 h后,再次测量细胞间距离,记为d24h。划痕愈合率(%)=(d0h-d24h)/d0h×100%。
1.3.5 Transwell实验检测细胞侵袭:于6孔板中接种2.5 ml HSC3细胞(5.0×104个/ml),培养4 h后,弃培养液,按照1.3.2分组处理。孵育24 h后,收集细胞,并调整各组细胞浓度为5.0×105个/ml。铺Matrigel基质胶至Transwell小室的上室,自然晾干后,加100 μl各组细胞悬液。另在下室加500 μl完全培养液。培养24 h后,弃培养液,将细胞用多聚甲醛固定及结晶紫染色后,显微镜观察,计数。
1.3.6 蛋白质印迹法检测E-cadherin和N-cadherin蛋白表达:于6孔板中接种2.5 ml HSC3细胞(5.0×104个/ml),培养4 h后,弃培养液,按照1.3.2分组处理。孵育24 h后,用RIPA试剂获取细胞中总蛋白,并用BCA试剂盒检测蛋白浓度。用 SDS-PAGE实验分离总蛋白,并转至PVDF膜,用5%脱脂奶粉封闭2 h。于4℃冰箱中分别用E-cadherin(1∶500)、N-cadherin(1∶500)、GAPDH(1∶1 000)一抗孵育过夜,洗膜后,再在室温下用山羊抗兔二抗(1∶2 000)中孵育1 h。加显影液显影,曝光拍照,ImageJ软件分析E-cadherin、N-cadherin相对GAPDH的表达量。
1.3.7 qRT-PCR检测miR-1254表达:①细胞接种和处理同1.3.6,孵育24 h后,收集细胞;②在液氮保护下,充分研磨组织样本。均用miRNA提取试剂盒提取细胞和组织中总RNA,逆转录为cDNA后,进行扩增。引物序列:miR-1254上游5’-CTG GAAGCTGGAGCCTGCAGT-3’,下游5’-GCGAGCACAGAATTAATACGAC-3’;U6上游5’-CTCGCTTCGGCAGCACA-3’,下游5’-AACGCTTCACGAATTTGCGT-3’。2-ΔΔCt法计算miR-1254相对U6的表达量。
1.3.8 细胞转染与处理:于6孔板中接种2.5 ml HSC3细胞(5.0×104个/ml),培养24 h后,弃培养液。将LipofectamineTM2000试剂分别与miR-1254 mimics、miR-NC、anti-miR-1254或anti-miR-NC混合均匀,加至各孔中,孵育细胞12 h。收集细胞,qRT-PCR检测细胞中miR-1254表达,验证转染效果后,将细胞接种至培养板中,转染miR-1254 mimics、miR-NC的细胞均按照对照组处理,记为miR-1254组、miR-NC组;转染anti-miR-1254、anti-miR-NC的细胞均用含8 μg/ml 鞣花酸的培养液进行孵育,分别记为鞣花酸+anti-miR-1254组、鞣花酸+anti-miR-NC组。按照上述1.3.2~1.3.6检测4组细胞增殖抑制率、克隆形成数、划痕愈合率和侵袭数及细胞中E-cadherin和N-cadherin蛋白表达。
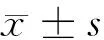
2 结果
2.1 鞣花酸对口腔鳞癌HSC3细胞增殖的影响 鞣花酸低、中、高剂量组HSC3细胞增殖抑制率均高于对照组(P<0.05),细胞克隆形成数均低于对照组(P<0.05),且呈剂量依赖性(P<0.05)。见表1。
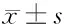
表1 鞣花酸对口腔鳞癌HSC3细胞增殖的影响 n=9,
2.2 鞣花酸对口腔鳞癌HSC3细胞迁移和侵袭的影响 鞣花酸低、中、高剂量组HSC3细胞划痕愈合率、侵袭数及细胞中N-cadherin蛋白表达均低于对照组(P<0.05),E-cadherin蛋白表达高于对照组(P<0.05),且呈剂量依赖性(P<0.05)。见图1、表2。

图1 鞣花酸对口腔鳞癌HSC3细胞迁移侵袭相关蛋白表达的影响
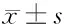
表2 鞣花酸对口腔鳞癌HSC3细胞迁移侵袭的影响 n=9,
2.3 miR-1254在口腔鳞癌组织中的表达 miR-1254在口腔鳞癌组织中的表达量为(0.27±0.05),低于癌旁组织(1.00±0.13),差异有统计学意义(t=32.731,P<0.05)。
2.4 鞣花酸对口腔鳞癌HSC3细胞miR-1254表达的影响 对照组、鞣花酸低、中、高剂量组HSC3细胞中miR-1254表达量分别为(1.00±0.00)、(1.69±0.14)、(2.76±0.23)和(3.72±0.27),4组间比较差异有统计学意义(F=354.047,P<0.05) 鞣花酸低、中、高剂量组HSC3细胞中miR-1254表达量均高于对照组(P<0.05),且呈剂量依赖性(P<0.05)。
2.5 miR-1254过表达对口腔鳞癌HSC3细胞增殖、迁移和侵袭的影响 miR-1254在miR-1254组HSC3细胞中的表达高于miR-NC组(3.32±0.26 vs 1.00±0.00,t=26.769,P<0.05),说明miR-1254组HSC3细胞中miR-1254表达较miR-NC组过表达。miR-1254组HSC3细胞增殖抑制率、E-cadherin蛋白表达均高于miR-NC(P<0.05),细胞克隆形成数、划痕愈合率、侵袭数及细胞中N-cadherin蛋白表达均低于miR-NC组(P<0.05)。见表3、图2。
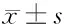
表3 miR-1254过表达对口腔鳞癌HSC3细胞增殖、迁移和侵袭的影响 n=9,
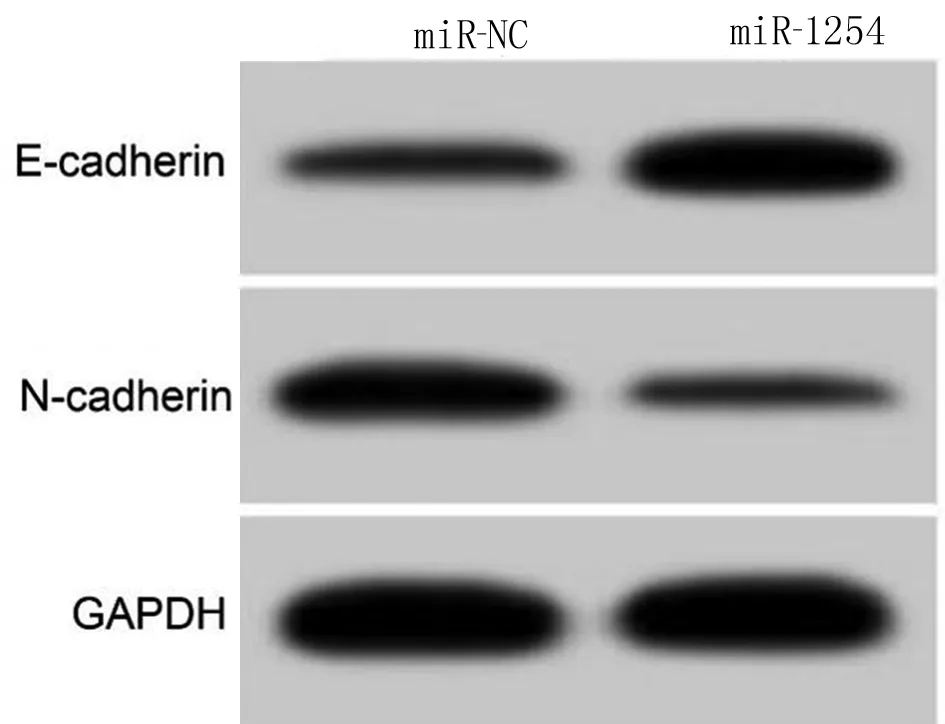
图2 miR-1254过表达对口腔鳞癌HSC3细胞迁移侵袭相关蛋白表达的影响
2.6 下调miR-1254逆转鞣花酸对口腔鳞癌HSC3细胞增殖、迁移和侵袭的作用 miR-1254在鞣花酸+anti-miR-1254组HSC3细胞中的表达低于鞣花酸+anti-miR-NC组(0.32±0.03 vs 1.00±0.00,t=68.000,P<0.05),说明鞣花酸+anti-miR-1254组HSC3细胞中miR-1254表达较鞣花酸+anti-miR-NC组被敲减。鞣花酸+anti-miR-1254组HSC3细胞增殖抑制率、E-cadherin蛋白表达均高于鞣花酸+anti-miR-NC(P<0.05),细胞克隆形成数、划痕愈合率、侵袭数及细胞中N-cadherin蛋白表达均低于鞣花酸+anti-miR-NC(P<0.05)。见表4、图3。
表4 下调miR-1254逆转鞣花酸对HSC3细胞增殖、迁移和侵袭的作用 n=9,
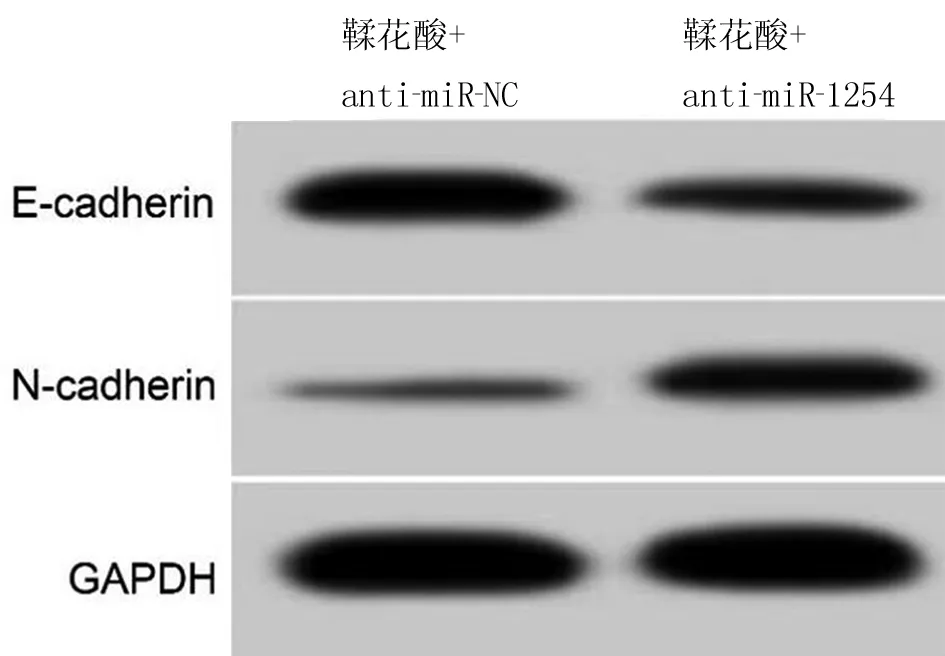
图3 下调miR-1254逆转鞣花酸对HSC3细胞迁移侵袭相关蛋白表达的作用
3 讨论
口腔鳞癌易复发和转移,其治疗面临巨大挑战。寻找低毒高效且副作用小的治疗药物来治疗口腔鳞癌十分必要。近年来,由于天然植物或其活性成分因具有作用靶点多、效果强且副作用低等优点成为肿瘤治疗药物研究的重要对象。鞣花酸是一种天然多酚类物质,在各种软果和坚果等植物中广泛存在。本实验结果显示,鞣花酸对口腔鳞癌HSC3细胞增殖、迁移及侵袭具有显著抑制作用,且呈剂量依赖性,这提示鞣花酸具有治疗口腔鳞癌的潜在价值。
细胞上皮间质转化是肿瘤细胞获得迁移和侵袭性的关键[10]。上皮细胞经过转化,获得间质细胞表型,迁移和侵袭性增强,已形成转移瘤[11]。E-cadherin是上皮细胞中维持细胞间结构的跨膜蛋白,N-cadherin是间质细胞的标志性蛋白。本实验数据显示,鞣花酸对HSC3细胞中E-cadherin蛋白表达起促进作用,而对N-cadherin蛋白表达起抑制作用,这说明鞣花酸抑制了HSC3细胞上皮间质转化过程,提示鞣花酸抑制HSC3细胞迁移和侵袭与其抑制了细胞上皮间质转化有关。
miRNA是一类小分子非编码RNA,其可靶向其靶基因的表达参与调控肿瘤细胞恶性表型。既往研究显示,多种miRNA参与口腔鳞癌的发展进程。例如,miR-19b-3p和miR-487a-3p室口腔鳞癌中表达下调的miRNA,过表达miR-19b-3p和miR-487a-3p可分别通过靶向下调RAB14、PPM1A抑制口腔鳞癌细胞的恶性行为,从而起到抑癌作用[12,13];miR-626在口腔鳞癌中表达增加,其通过靶向下调RASSF4促进口腔鳞癌的发展进程[14]。通过探究口腔鳞癌中异常表达的miRNA及其作用机制,可能口腔鳞癌发病机制的阐明及治疗靶点的选择提供新途径。
作为一种miRNA,miR-1254参与多种疾病的发展进程。miR-1254表达的上调可导致宫颈癌细胞恶性生物学行为受到抑制[15],过表达miR-1254可通过靶向抑制MEGF6的表达降低结直肠癌细胞对奥沙利铂的耐药性[16];miR-1254在肝癌中表达下调,过表达miR-1254可通过下调FAIm2的表达抑制体内肝癌肿瘤生长[17]。本实验数据显示,miR-1254在口腔鳞癌组织中呈高表达,过表达miR-1254对口腔鳞癌HSC3细胞的增殖、迁移及侵袭发挥显著抑制作用,与Lu等[9]报道结果一致,说明miR-1254起抑癌基因作用阻碍口腔鳞癌的发展进程,其可作为口腔鳞癌治疗的分子靶点。Chen等[18]报道显示,槲皮素可阻碍口腔鳞癌细胞增殖和侵袭,发挥抗口腔鳞癌作用,这与槲皮素上调细胞中miR-1254进而抑制CD36的表达有关。本研究结果显示,鞣花酸呈剂量依赖性促进口腔鳞癌HSC3细胞中miR-1254的表达,而敲减miR-1254逆转了鞣花酸对HSC3细胞增殖、迁移及侵袭的抑制作用,这提示鞣花酸可能通过上调miR-1254的表达来发挥抗口腔鳞癌作用,但其作用的miR-1254的靶基因还有待进一步探究。
综上,鞣花酸呈剂量依赖性抑制口腔鳞癌细胞增殖、迁移及侵袭,具有治疗口腔鳞癌的潜在价值,这可能与其上调细胞中miR-1254的表达有关,但其作用的miR-1254的靶基因还有待探究。同时,本研究仅在体外细胞层面进行了探究,尚需进一步在体内验证鞣花酸的抗口腔鳞癌作用。
