lncRNA H19、hBD-3、Survivin在OSF癌变组织中的表达及意义
2023-05-12李逦贾婉萍崔高笛李萌杨昭霞
李逦 贾婉萍 崔高笛 李萌 杨昭霞
口腔黏膜下纤维性变(oral submucosal fibrosis carcinogenesis,OSF)是一种慢性、隐匿性、进行性且具有癌变倾向的黏膜炎新疾病,其主要病理表现为口腔黏膜下固有胶原异常堆积,其病因主要为嚼槟榔,可能与细胞自噬水平异常、免疫失调、胶原代谢紊乱等有关[1]。报道显示,该病癌变率高达7%~13%,且OSF与口腔癌共存是因OSF癌变所致,目前临床上关于OSF癌变的发病机制不明确[2]。lncRNA H19是首个被发现与肿瘤相关的lncRNA,其表达于胚胎组织,未表达于成年组织,可在组织再生与肿瘤发生时被激活,在肿瘤的发生发展中扮演着重要角色[3]。人β-防御素-3(hBD-3)为先天性免疫系统的重要组成部分,在修复损伤,调节局部免疫与肿瘤的形成中发挥重要的作用[4]。Survivin为凋亡抑制因子,参与多种生物学功能调节,主要表达于胚胎与肿瘤组织,可能成为肿瘤早期诊断的靶点[5]。目前临床上对lncRNA H19、hBD-3、Survivin与OSF癌变的相关性研究较少,为此,在本文研究中分析lncRNA H19、hBD-3、Survivin在OSF癌变中的表达,并分析三者与OSF癌变的相关性。
1 资料与方法
1.1 一般资料 选取2019年2月至2021年10月在我院接受治疗的OSF患者80例作为OSF组,另外选取OSF癌变的患者90例作为OSF癌变组,同期选取在我院进行口腔健康检查的70例健康人作为对照组。OSF组中,男49例,女41例;年龄18~67岁,平均年龄(40.38±6.68)岁。OSF癌变组中,男42例,女48例;年龄19~68岁,平均年龄(41.33±6.51)岁;其中舌癌21例,颊癌19例,牙龈癌24例,口底癌26例。对照组中,男45例,女45例;年龄16~65岁,平均年龄(40.61±6.91)岁。3组患者性别和年龄比较,差异无统计学意义(P>0.05)。2组患者本次研究所有研究对象及家属均知情同意,且签署了知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准:①所有患者未接受放疗、化疗;②患者无其他系统性疾病;③患者全身无其他肿瘤,健康人无口腔黏膜疾病,无槟榔、烟、酒等嗜好。
1.2.2 排除标准:①患者患有合并扁平苔藓、白斑等其他合并性疾病;②患者精神异常;③患有其他肿瘤。
1.3 方法
1.3.1 免疫组化检测lncRNA H19、hBD-3、Survivin表达:切取所有研究对象颊黏膜上皮组织,放入液氮中冷冻,-80℃保存,采用免疫组化检测颊黏膜上皮组织中lncRNA H19、hBD-3、Survivin表达情况,使用PBS冲洗采集到的组织,放入4%多聚甲醛磷酸盐缓冲液内固定12 h,经脱水、透明、包埋处理后制作5~7 μm组织切片,于50℃水中展开,用干净的载玻片捞片,放入68℃恒温箱内烘烤2 h,在二甲苯中脱蜡浸泡25 min,之后浸在梯度乙醇各2 min,再用PBS冲洗2~3次/5 min。用80%甲醇孵育10 min,重复上方冲洗步骤。之后放入0.01 mol/L枸橼酸缓冲液中煮沸,自然冷却>20 min,并重复上方冲洗步骤。加入山羊血清封闭液,室温孵育20 min,甩去多余液体。滴加一抗50 μl,室温静置1 h,取出后37℃复温45 min,并重复上方冲洗步骤。滴加辣根过氧化物酶标记的二抗40~50 μl,室温静置1 h,并重复上方冲洗步骤后滴加SP,室温孵育30 min,之后重复上方冲洗步骤。加入DAB显色5~10 min,显微镜下掌握染色程度,用自来水冲洗10 min终止反应。加入苏木素给予复染,在经过盐酸酒精分化后,采用自来水冲洗10~15 min,通过梯度乙醇脱水后给予二甲苯冲洗片2~3次一直到透明,然后实施中性树脂封片处理,显微镜下观察免疫组化染色情况。根据染色程度和染色细胞百分比进行评估:阳性细胞数<10%为(-),10%~25%为(+),25%~75%为(++),>75%为(+++)。
1.3.2 实时荧光定量法检测lncRNA H19、hBD-3、Survivin表达:实时荧光定量RT-PCR检测颊黏膜上皮中lncRNA H19、hBD-3、Survivin表达水平,Trizol法提取样本RNA,使用Takara逆转录试剂盒逆转录处理后获得总cDNA,采用Primer 5.0软件设计引物序列,反应体系:0.4 μl上下游引物、1 μl cDNA模板、10 μl SYB Green,加蒸馏水至20 μl。反应条件:95℃10 min,1个循环,95℃ 5 s、60℃ 1 min,40个循环,使用2-ΔΔCt方法计算出lncRNA H19、hBD-3、Survivin表达量。重复测量3次,取平均值,lncRNA H19上游引物序列:5’-CCGTCTCCACAACTCCAACCAG-3’,下游引物序列:5’-TCAAAGCCTCCACGACTCTGTTT-3’;hBD-3上游引物序列:5’-TTCTGTTTGCTTT-GCTCTTCCTG-3’,下游引物序列:5’-ACTTGCCGATCTGTTCCTCCTT-3’;Survivin上游引物序列:5’-AGAACTGGCCCTTCTTGGA-3’,下游引物序列:5’-AAGGAAAGCGCAACCGGACG-3’;内参U6引物序列:上游:5’-TTCCAGCCTTCCTTCCTGGGG-3’,下游:5’-GCTCAGGAGGAGCAAT-3’。
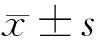
2 结果
2.1 lncRNA H19、hBD-3、Survivin在对照组、OSF组、OSF癌变组中的表达 与对照组比较,OSF组、OSF癌变组中lncRNA H19、hBD-3、Survivin表达量升高,差异有统计学意义(P<0.05)。与OSF组比较,OSF癌变组中lncRNA H19、hBD-3、Survivin表达量升高(P<0.05)。见表1,图1。

图1 lncRNA H19、hBD-3、Survivin在对照组、OSF组、OSF癌变组中的表达(免疫组化×400)

表1 lncRNA H19、hBD-3、Survivin在对照组、OSF组、OSF癌变组中的表达
2.2 lncRNA H19、hBD-3、Survivin表达与子OSF癌变患者疾病演进的关系 lncRNA H19、hBD-3、Survivin表达与OSF癌变患者肿块大小与癌变部位无关,与TNM分期、分化程度、淋巴结转移、浸润深度表达相关,Ⅲ期、Ⅳ期、中低分化、有淋巴结转移、≥1/2肌层浸润OSF癌变患者lncRNA H19、hBD-3、Survivin表达升高(P<0.05)。见表2。

表2 lncRNA H19、hBD-3、Survivin表达与子OSF癌变患者疾病演进的关系
2.3 ROC曲线分析lncRNA H19、hBD-3、Survivin对OSF癌变的诊断价值 ROC曲线显示,与lncRNA H19、hBD-3、Survivin单项诊断相比,三项联合对OSF癌变的预测价值较高(P<0.05)。见表3,图2。

图2 lncRNA H19、hBD-3、Survivin诊断OSF癌变的ROC曲线
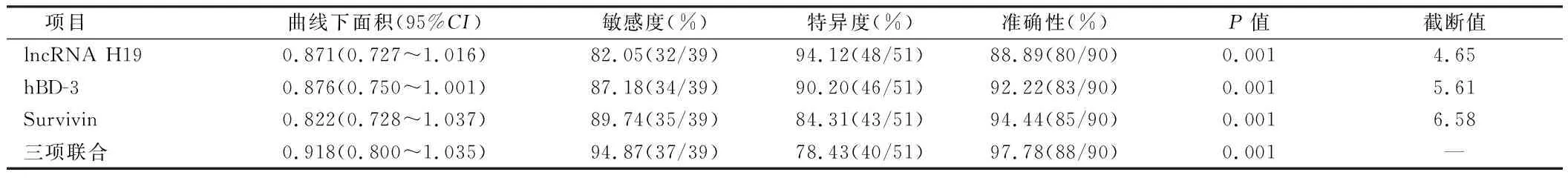
表3 ROC曲线分析lncRNA H19、hBD-3、Survivin对OSF癌变的诊断价值
2.4 lncRNA H19、hBD-3、Survivin之间相关性分析 lncRNA H19、hBD-3、Survivin之间Pearson相关性分析显示,lncRNA H19与hBD-3呈正相关(r=0.513,P=0.001);lncRNA H19与Survivin呈正相关(r=0.563,P=0.001);hBD-3与Survivin呈正相关(r=575,P=0.001)。见图3。
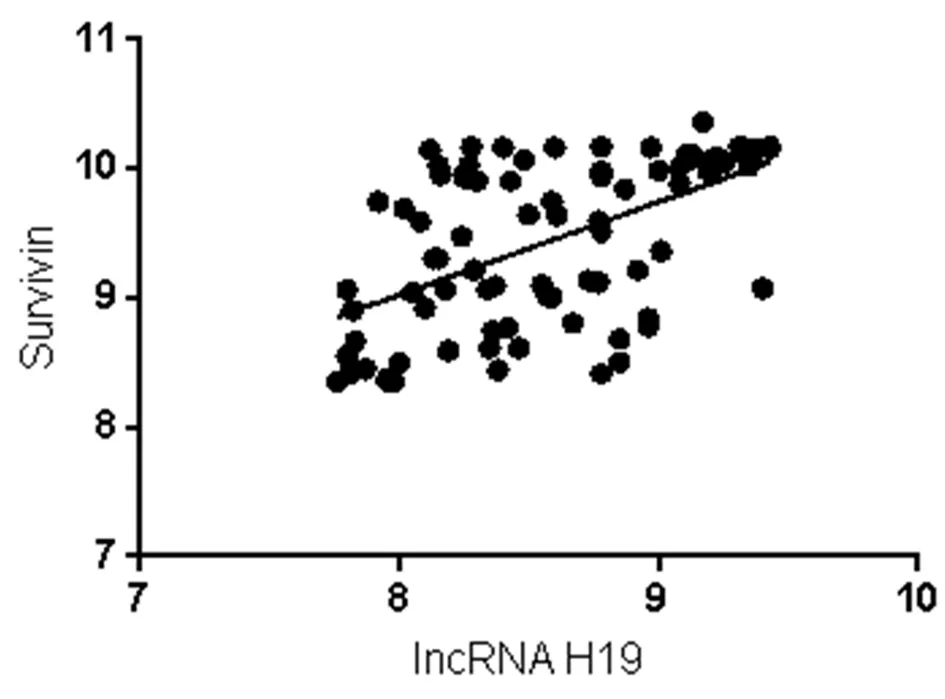

图3 lncRNA H19、hBD-3、Survivin与OSF癌变之间相关性分析
3 讨论
OSF是一种口腔黏膜发生进行性硬化的疾病,主要表现为口腔黏膜刺激性疼痛,张口受限,进食困难,严重可导致舌功能障碍与听力下降[6]。嚼槟榔为临床上OSF的主要致病因素,目前OSF癌变的机制可能与槟榔的致癌成分,细胞因子的改变与细胞免疫的密切相关[7,8]。
lncRNA H19是最早发现的长链非编码RNA,位于染色体UP15.5区。研究表明,H19在多种肿瘤中异常表达,可影响肿瘤的侵袭转移,细胞的增殖分化与血管的形成促进肿瘤的发展,lncRNA H19在癌症的发生发展中具有重要作用,在部分肿瘤中起致癌基因作用,而在部分肿瘤中起抑癌基因作用,其具体生物学功能取决于癌症的组织学类型与细胞微环境[9-11]。临床上关于lncRNA H19与OSF癌变的报道较少,仅有苏花等[12]研究显示,H19的表达在不同病理状态下逐渐升高。本文研究结果显示,lncRNA H19在口腔健康患者体内低表达,随着OSF及OSF癌变lncRNA H19的表达逐渐升高,表明lncRNA H19和OSF的发生与癌变具有一定的联系,其lncRNA H19可成为OSF发生发展的标记物,证实lncRNA H19参与OSF的发生与癌变,为临床上OSF潜在的标记物,以上述苏花等[12]研究保持一致。
hBD-3是人先天免疫屏障的重要组成部分,在正常状态下呈低表达,机体发生炎症或感染时,其表达水平明显升高[13]。临床研究显示,hBD-3在多种肿瘤组织中高表达,例如阴部恶性肿瘤,宫颈癌,hBD-3高表达可影响肿瘤细胞的增殖、凋亡与侵袭迁移等过程,可促进肿瘤的发生发展[14-16]。杨琴等[17]研究显示,OSF为癌前状态,可发展为空腔鳞状细胞癌,长期嚼槟榔可损伤口腔黏膜,使上皮屏障受损,使机体分泌炎性细胞导致hBD-3表达上调。在本文研究中,OSF组织与OSF癌变组织hBD-3表达水平逐渐升高,表明hBD-3的升高与OSF癌变有关,与上述研究结果保持一致,其原因可能为口腔黏膜受损导致黏膜下炎性渗出,机体hBD-3表达升高,hBD-3高表达可激活肿瘤相关通路,导致OSF癌变。
Survivin是IAP家族中成员,其表达具有依赖性,且具有多种生物学功能,可调节线粒体水平,抑制内源细胞通路,抗凋亡。研究显示,Survivin表达于恶性肿瘤,与恶性演进的病理特征显著相关,是肿瘤潜在的诊断指标与抗肿瘤分子干预靶,Survivin在不同组织中表达表达不同,在恶性肿瘤与胚胎组织中高表达,在良性肿瘤中不表达[18-20]。牛媛瑕等[21]研究显示,Survivin阳性表达率与淋巴结的产生,临床分期与浸润深度有关,且Survivin参与细胞的有丝分裂与增殖,促进肿瘤的浸润转移与血管内生成。本文研究表明,在健康人中Survivin不表达,在OSF患者体内低表达,在OSF癌变患者体内高表达,且随着淋巴结的转移逐渐升高,与上述牛媛瑕等[21]究保持一致,表明OSF癌变与Survivin具有一定关系,可能参与OSF癌变的演进。
另外本文采用分析lncRNA H19、hBD-3、Survivin是否与OSF癌变相关,Logistic回归分析显示,lncRNA H19、hBD-3、Survivin为OSF癌变的危险因素,且ROC曲线显示,三项联合预测OSF癌变的价值明显高于单项预测,提示着,临床上可根据上述指标表达情况早期评估此病。虽然本文发现三者与OSF癌变相关,参与疾病演进,但并未深入分析其作用机制,因此还需后续研究进一步明确其参与演进的具体作用机制,为临床上此病的研究提供新方向。
综上所述,本文研究发现,OSF癌变组织中lncRNA H19、hBD-3、Survivin表达升高,随着疾病的演进,lncRNA H19、hBD-3、Survivin表达升高加剧,参与疾病的演进,临床上可根据其表达预测此病。
