TRPA1通过PLC/PKC信号通路对偏头痛大鼠的行为学和疼痛敏感性的影响
2023-05-12焦燕李三峰李红燕
焦燕 李三峰 李红燕
偏头痛是一种常发的神经血管紊乱性疾病,患者出现搏动性头痛、单侧或双侧中重度头痛,并可反复发作,对身心健康、生活质量及工作能力造成很大危害[1,2]。目前普遍认为三叉神经血管系统的激活与偏头痛的发生发展密切有关,其中神经炎症是关键病理环节[3]。瞬时受体电位锚蛋白1(transient receptor potential ankyrin 1,TRPA1)参与了神经病理性伤害过程,被激活时可导致眶周机械性痛觉超敏[4],且TRPA1在偏头痛发病过程中起到关键调控作用,以抗TRPA1抗体预处理偏头痛大鼠,可抑制三叉神经血管系统激活致敏,减轻神经炎症,改善头痛症状[5],因此TRPA1可成为偏头痛的潜在治疗靶点。磷酯酶C(phospholipase C,PLC)/蛋白激酶C(protein kinase C,PKC)信号可介导促炎介质诱导慢性疼痛,PLC和PKC的抑制剂可减轻促炎因子前列腺素E2(prostaglandin E2,PGE2)引发的背根神经节炎症损伤,进而改善持续的外周疼痛过敏症状[6],抑制PKC信号可降低硝酸甘油诱导的小鼠炎性因子过表达,减轻头痛[7]。另有研究显示TRPA1可激活PKC信号,并促进瑞芬太尼诱导的术后痛觉过敏发生[8],因而推测TRPA1可能通过PLC/PKC信号通路影响偏头痛大鼠的行为学和疼痛敏感性。本研究以腺病毒包装的TRPA1 siRNA载体敲低偏头痛大鼠TRPA1基因,对以上假设进行验证。
1 材料与方法
1.1 实验动物 SD大鼠购自武汉大学动物实验中心,许可证号SCXK(鄂)2019-0004,SPF级,6周龄,雄性,体重(190±15)g。大鼠饲养在医院动物房内饲养笼中,每笼4~5只,动物房内保持屏障环境,严格遵照《中华人民共和国实验动物管理条例》进行饲养。
1.2 试剂与仪器 (1)硝酸甘油(货号100236)自上海联迈生物工程有限公司购买;PMA(货号YT346)自北京百奥莱博科技有限公司购买;以腺病毒包装的TRPA1 siRNA载体、空慢病毒载体、TRPA1及GAPDH引物、Trizol(货号B511311)、PGE2酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(货号D751014)、大鼠白介素(interleukin,IL)-6 ELISA试剂盒(货号D731010)、一步法反转录荧光定量试剂盒(货号B639277)、大鼠IL-10 ELISA试剂盒(货号D731011)自生工生物工程(上海)股份有限公司购买;兔源抗大鼠PLC抗体(货号ab107455)、兔源抗大鼠p-PLC抗体(货号ab4828)、兔源抗大鼠PKC抗体(货号ab181558)、兔源抗大鼠p-PKC抗体(货号ab109539)自美国Abcam公司购买;强RIPA裂解液(货号P0013B)、BCA蛋白测定试剂盒(货号P0011)、辣根过氧化物酶标记山羊抗兔IgG二抗(货号A0208)自上海碧云天生物技术有限公司购买等。(2)Von Frey触痛仪(型号BIO-EVF3)购自北京友诚嘉业生物科技有限公司;鼠尾光照测痛仪(型号YLS-12A)购自济南益延科技发展有限公司;全波长多功能自动酶标仪(型号Varioskan Flash)购自美国赛默飞世尔科技公司;小型垂直电泳槽(型号1658001)、电泳仪电源(型号1645050)、小型转印槽(型号1703930),购自美国伯乐公司;实时荧光定量PCR仪(FT-CW96)购自山东风途物联网科技有限公司等。
1.3 方法
1.3.1 制备大鼠偏头痛模型及分组给药:取SD大鼠60只,随机分为对照组、模型组、TRPA1敲低组(腺病毒包装的TRPA1 siRNA载体)、TRPA1空载组(空慢病毒载体)、TRPA1敲低+PMA(PKC激活剂)组,每组12只。TRPA1敲低+PMA组大鼠每只静脉注射0.5 ml腺病毒包装的TRPA1 siRNA载体1次(1×1011PFU),同时皮下注射0.1 ml PMA 1次(0.2 ng/μl)[9];TRPA1空载组大鼠每只静脉注射0.5 ml腺病毒包装的空载体1次(1×1011PFU),同时皮下注射0.1 ml 0.9%氯化钠溶液1次;TRPA1敲低组大鼠每只静脉注射0.5 ml腺病毒包装的TRPA1 siRNA载体1次(1×1011PFU),同时皮下注射0.1 ml 0.9%氯化钠溶液1次;模型组和对照组大鼠每只静脉注射0.5 ml 0.9%氯化钠溶液1次,同时皮下注射0.1 ml 0.9%氯化钠溶液1次,模型组和给药干预组大鼠于给药后24 h皮下注射10 mg/kg硝酸甘油[10]制备大鼠偏头痛模型,对照组大鼠于给药后24 h皮下注射10 mg/kg 0.9%氯化钠溶液,大鼠产生双耳发红及频繁搔头、爬笼等烦躁不安症状,可作为判断造模成功的标志。
1.3.2 大鼠行为学观察:大鼠给药造模后30 min,记录大鼠耳红消失时间及30 min内挠头和爬笼次数,挠头和爬笼次数记录观察3次,取平均值。
1.3.3 ①大鼠疼痛症状检测:行为学观察全部完成后,进行漆刷实验及针刺实验检测各组大鼠机械性疼痛症状,漆刷实验:使用一个光滑的画笔轻刷大鼠须垫部,当大鼠缩头时,计为1分,共轻刷5次,每次间隔5 min,重复3次后得动态痛觉超敏评分,最大分值为15,最小分值为0。针刺实验:使用Von Frey触痛仪的电子探针刺激大鼠须垫部,力度以不损伤皮肤且可使皮肤轻微凹陷为宜,探针从最小克数开始逐渐增大,大鼠缩头时的探针克数,即是缩头阈值,测量3次,每次间隔5 min,取3次测量的均值。②以热刺激实验检测大鼠温度痛阈[12]:待大鼠安静后进行固定,以强光刺激大鼠须垫部,记录大鼠出现缩头反应时所用时间即为热刺激潜伏期,重复测试3次,每次间隔5 min,取3次测量的均值。
1.3.4 大鼠脑组织及血液中TRPA1 mRNA的表达检测及标本采集:大鼠疼痛检测结束后,采集其颈动脉血后离心,将上清存于-80℃备用;再次采集颈动脉血后断头处死大鼠,取出大脑,使用手术剪自大脑上剪下脑组织约0.6 g存于液氮备用,再次使用手术剪自剩余大脑上剪下脑组织约0.4 g,向除TRPA1敲低+PMA组外其余各组大鼠脑组织及颈动脉血中加入适量Trizol(脑组织剪碎后研磨),遵照其试剂说明书指导提取脑组织及血液中总RNA,然后遵照一步法反转录荧光定量试剂盒说明书指导进行PCR扩增,GAPDH作为检测TRPA1 mRNA表达的内参基因,GAPDH上游引物:5’-ATGGGTGTGAACCACGAGA-3’,下游引物:5’-CAGGGATGATGTTCTGGGCA-3’;TRPA1上游引物:5’-ATCCAAATAGACCCAGGCACG-3’,下游引物:5’-CAAGCATGTGTCAATGTTTGGTACT-3’。
1.3.5 大鼠血清促炎因子PGE2、IL-6及抗炎因子IL-10水平测定:将1.3.4中血清自-80℃冰箱中取出冻融后,遵照试剂盒说明书指导以ELISA实验测定其中PGE2、IL-6、IL-10水平。
1.3.6 大鼠脑组织PLC/PKC通路相关蛋白表达检测:将1.3.4中脑组织自液氮中取出,加入强RIPA裂解液后研磨匀浆、离心,遵照蛋白测定试剂盒说明书以BCA法测量上清中总蛋白浓度,分组记录,根据结果每组均取20 靏蛋白变性后以SDS-PAGE凝胶跑电泳,通过电转将分离后的蛋白转移至PVDF膜,经5%的脱脂奶粉封闭、兔源抗大鼠PLC(1∶2 000)、p-PLC(1∶3 000)、PKC(1∶1 000)、p-PKC(1∶2 500)抗体孵育、洗涤、山羊抗兔二抗(1∶1 000)孵育、洗涤、显色、扫描后,以Image J软件分析扫描所得的蛋白条带图像,最终即可得各蛋白相对表达量。
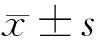
2 结果
2.1 4组大鼠脑组织及外周血中TRPA1的表达 与对照组比较,模型组、TRPA1空载组大鼠脑组织及外周血中TRPA1表达显著增高(P<0.05)。与模型组比较,TRPA1敲低组大鼠脑组织及外周血中TRPA1表达降低(P<0.05);TRPA1空载组大鼠脑组织及外周血中TRPA1表达无显著变化(P>0.05)。见表1。

表1 4组大鼠脑组织及外周血中TRPA1表达 n=12,
2.2 TRPA1对大鼠行为的影响 与对照组比较,模型组、TRPA1空载组大鼠耳红消失时间、挠头次数、爬笼次数显著增高(P<0.05)。与模型组比较,TRPA1敲低组大鼠耳红消失时间、挠头次数、爬笼次数降低(P<0.05);TRPA1空载组大鼠耳红消失时间、挠头次数、爬笼次数无显著变化(P>0.05)。与TRPA1敲低组比较,TRPA1敲低+PMA组大鼠耳红消失时间、挠头次数、爬笼次数升高(P<0.05)。见表2。

表2 4组大鼠行为学观察 n=12,
2.3 TRPA1对大鼠机械性疼痛的影响 与对照组比较,模型组、TRPA1空载组大鼠缩头阈值显著降低(P<0.05),动态痛觉超敏评分显著升高(P<0.05)。与模型组比较,TRPA1敲低组大鼠缩头阈值升高(P<0.05),动态痛觉超敏评分降低(P<0.05);TRPA1空载组大鼠缩头阈值、动态痛觉超敏评分无显著变化(P>0.05)。与TRPA1敲低组比较,TRPA1敲低+PMA组大鼠缩头阈值降低(P<0.05),动态痛觉超敏评分升高(P<0.05)。见表3。

表3 5组大鼠机械性疼痛 n=12,
2.4 TRPA1对大鼠温度痛阈的影响 与对照组比较,模型组、TRPA1空载组大鼠热刺激潜伏期显著降低(P<0.05)。与模型组比较,TRPA1敲低组大鼠热刺激潜伏期升高(P<0.05);TRPA1空载组大鼠热刺激潜伏期无显著变化(P>0.05)。与TRPA1敲低组比较,TRPA1敲低+PMA组大鼠热刺激潜伏期降低(P<0.05)。见表4。

表4 5组大鼠温度痛阈 n=12,
2.5 TRPA1对大鼠脑组织PLC/PKC通路蛋白表达的影响 与对照组比较,模型组、TRPA1空载组大鼠脑组织PLC/PKC通路蛋白p-PLC/PLC、p-PKC/PKC显著升高(P<0.05)。与模型组比较,TRPA1敲低组大鼠脑组织PLC/PKC通路蛋白p-PLC/PLC、p-PKC/PKC降低(P<0.05);TRPA1空载组大鼠脑组织PLC/PKC通路蛋白p-PLC/PLC、p-PKC/PKC无显著变化(P>0.05)。与TRPA1敲低组比较,TRPA1敲低+PMA组大鼠脑组织PLC/PKC通路蛋白p-PKC/PKC升高(P<0.05)。见表5,图1。

表5 5组大鼠脑组织PLC/PKC通路相关蛋白表达 n=12,

图1 免疫印迹检测5组大鼠脑组织PLC/PKC通路蛋白表达;A 对照组;B 模型组;C TRPA1敲低组;D TRPA1敲低组;E TRPA1敲低+PMA组
2.6 TRPA1对大鼠血清促炎因子及抗炎因子的影响 与对照组比较,模型组、TRPA1空载组大鼠血清促炎因子PGE2、IL-6水平显著升高(P<0.05),抗炎因子IL-10水平显著降低(P<0.05)。与模型组比较,TRPA1敲低组大鼠血清促炎因子PGE2、IL-6水平降低(P<0.05),抗炎因子IL-10水平升高(P<0.05);TRPA1空载组大鼠血清促炎因子PGE2、IL-6水平与抗炎因子IL-10水平无显著变化(P>0.05)。与TRPA1敲低组比较,TRPA1敲低+PMA组大鼠血清促炎因子PGE2、IL-6水平升高(P<0.05),抗炎因子IL-10水平降低(P<0.05)。见表6。

表6 5组大鼠促炎因子及抗炎因子水平 n=12,
3 讨论
偏头痛作为一种发病率较高的原发性慢性头疼疾病,目前还没有能够完全治愈的手段[11,12]。本研究通过皮下注射10 mg/kg硝酸甘油以制备偏头痛大鼠模型,结果显示,造模大鼠血清促炎因子PGE2、IL-6水平降低,抗炎因子IL-10水平升高,引发体内炎症,导致大鼠疼痛敏感性提高,具体表现为缩头阈值、热刺激潜伏期显著降低,动态痛觉超敏评分显著升高,造成大鼠出现持续耳红及频繁挠头、爬笼等头痛症状,揭示偏头痛大鼠模型构建成功。
促炎细胞因子过度表达导致三叉神经血管系统激活,引发神经源性炎症是偏头痛发生的重要病理现象,消炎止痛是有效治疗方法[3,13]。研究显示TRPA1在神经源性炎症相关的痛觉超敏产生过程中起关键作用,激活TRPA1可大量释放活性氧,导致神经炎症,引发并维持痛觉超敏[14],还可促进三叉神经传入纤维释放降钙素基因相关肽,偏头痛[15],且TRPA1表达功能性缺失的小鼠降钙素基因相关肽释放减少,改善芥子油和辣椒素诱发的头痛症状[16]。本研究结果显示,偏头痛模型大鼠脑组织及外周血中TRPA1表达明显升高,以腺病毒包装的TRPA1 siRNA载体对其进行干预处理可下调脑组织及外周血中TRPA1表达,并可降低促炎因子PGE2、IL-6水平,升高抗炎因子IL-10水平,进而抑制炎症,升高大鼠缩头阈值、热刺激潜伏期,降低其耳红消失时间、挠头次数、爬笼次数、动态痛觉超敏评分,最终降低大鼠疼痛敏感性,改善其持续耳红及频繁挠头、爬笼等头痛症状,进一步证实了TRPA1在偏头痛发病过程中的调控作用。
PLC/PKC信号参与炎症和疼痛的病理机制,抑制PLC及PKC信号可抑制蛋白酶激活受体2表达,减轻酸中毒和促炎介质诱导的痛觉过敏症状[17]。PKCδ的功能性抑制可显著减轻硝酸甘油诱导的持续自发性偏头痛[18],且抑制PKC信号可降低突触传递,减轻中枢致敏,改善慢性偏头痛[19]。另有研究表明PKC可参与TRPA1对痛觉过敏的调控过程,阻断PKC信号可逆转TRPA1上调诱导的超敏反应[8,20]。本研究结果显示,相比TRPA1敲低组,敲低TRPA1和PKC激活剂PMA同时干预的大鼠血清促炎因子PGE2、IL-6水平升高,抗炎因子IL-10水平降低,且耳红消失时间、挠头次数、爬笼次数、动态痛觉超敏评分、脑组织PLC/PKC通路蛋白p-PKC/PKC升高,缩头阈值、热刺激潜伏期降低,表明PMA可拮抗敲低TRPA1对偏头痛大鼠脑组织PLC/PKC信号的抑制作用,减弱其抗炎功效,最终逆转其对大鼠疼痛敏感性及头痛症状的改善作用,揭示敲低TRPA1是通过抑制PLC/PKC信号激活来减轻大鼠疼痛敏感性及头痛症状的。
综上所述,TRPA1可通过激活PLC/PKC信号参与偏头痛的致病过程,下调TRPA1可通过阻断PLC/PKC信号途径传导而抑制神经炎症,减轻偏头痛大鼠疼痛敏感性,最终缓解头疼。本研究证实TRPA1通过调控PLC/PKC信号在偏头痛发病中的关键调节作用,为偏头痛的临床治疗提供了新的见解及思路。
