Box-Behnken 响应面法优化阿托伐他汀钙类脂囊泡处方工艺
2023-05-11李东泽任书杉张向宇
李东泽,付 琳,任书杉,王 超,张向宇
(佳木斯大学药学院,黑龙江 佳木斯 154007)
阿托伐他汀钙(ATC)广泛用于治疗高脂血症,通过将β-羟[基]-β-甲戊二酸单酰辅酶A(HMG-CoA)转化为甲戊酸[1]以抑制胆固醇的生物合成,降低血液中胆固醇、低密度脂蛋白和三酰甘油的水平。但其水溶性差,生物利用度低,体内半衰期短,消除速率快,单次大剂量口服可能导致肝功能异常及肾功能衰竭[2],限制了临床应用。故需应用类脂囊泡药物递送系统[3]、自乳化药物递送系统[4]、口腔黏膜给药系统[5]、胃滞留缓释给药系统[6]、局部透皮给药系统[7]、聚合物纳米粒[8]等新型给药系统,以改善ATC的疏水性,提高生物利用度。类脂囊泡是由非离子表面活性剂和胆固醇或胆固醇衍生物构成的类脂质双分子层球囊结构,具备包封亲水性和亲脂性物质的能力[9-10]。类脂囊泡生物膜相容性良好[11],可避免药物在到达有效位点前被破坏,延长药物半衰期,并起到被动靶向的作用[12-13]。响应面法是以数理统计为基础,对设计点及因素进行数学建模集合,得到约束目标函数的响应面模型,进一步预测非试验点响应值的试验优化方法,包括中心组合设计、全因素设计、Box - Behnken 设计等。Box - Behnken 响应面法优化的拟合模型准确、可靠[14-15],在各参数离散水平影响下得到最佳的条件组合及对应的最优响应值,广泛用于医学、生物、化学等行业[16-18]。β- 谷甾醇是一种膳食植物甾醇[19],具备与胆固醇相似的化学结构和可生物降解的性能,在生物制药领域中常作为胆固醇的替代物用于药用辅料。本研究中采用薄膜-超声分散法[20]制备以β- 谷甾醇和Span60 为囊材、包载ATC 的类脂囊泡(ATC-NIS),采用Box-Behnken 响应面法优化处方工艺,分别从外观形态、粒径分布、包封率、载药量、体外释放性能等方面进行评价,以得到ATC-NIS 的最佳制备工艺及处方。现报道如下。
1 仪器与试药
1.1 仪器
FA2004N 型电子分析天平(上海恒平科学仪器有限公司,精度为万分之一);TGL - 16GB 型台式高速离心机(上海安亭科学仪器厂);UV765 型紫外可见分光光度计(上海精密科学仪器有限公司);Agilent 1200 型高效液相色谱仪(美国安捷伦公司);KQ - 400KB 型高功率数控超声波清洗器(昆山市超声仪器有限公司,功率为220 W);JY92 - 2D 型超声波细胞粉碎机(宁波新芝生物科技股份有限公司,功率为900 W);DF - 101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)。
1.2 试药
ATC 原料药(武汉远成共创科技有限公司,批号为J1203AS);Span60(大连美仑生物技术有限公司,批号为O1013A);β- 谷甾醇(上海阿拉丁生化科技股份有限公司,批号为S111182,含量>95%);乙腈、甲醇(色谱纯,天津科密欧化学试剂有限公司);醋酸铵、醋酸(天津凯通化学试剂有限公司);透析袋(美国Union Carbide公司)。
2 方法与结果
2.1 类脂囊泡制备
采用薄膜-超声分散法制备。称取处方量的ATC、Span60和β-谷甾醇,溶于3.0 mL氯仿-甲醇(4∶1,V/V)的混合溶剂中,超声(功率为88 W)使分散均匀,置旋转蒸发仪65 ℃、减压蒸发至有机溶剂挥发完全,在圆底烧瓶内形成均一的透明薄膜,加入同温适量蒸馏水,静置孵育30 min后,置恒温磁力加热搅拌器(转速为100 r/min)65 ℃加热条件下水化1.0 h,得ATC-NIS 混悬液,转移至超声波细胞破碎机超声处理(功率为200 W)5 min,即得ATC-NIS。
2.2 ATC 体外分析
2.2.1 色谱条件
色谱柱:Agilent C18柱(250 mm × 4.6 mm,5 μm);流动相:醋酸铵缓冲液(醋酸调pH至4.5)-乙腈(50∶50,V/V);流速:1.0 mL/ min;检测波长:246 nm;柱温:25 ℃;进样量:20 μL。
2.2.2 方法学考察
专属性试验:分别取类脂囊泡和ATC - NIS,加入10倍体积甲醇超声(功率为200 W)处理2 min,溶解,使类脂囊泡破碎,分别过0.22 μm有机相微孔滤膜,备用。加等量标准贮备液(质量浓度为5 μg/mL),按2.2.1项下色谱条件进样测定,并根据出峰情况考察药物与类脂囊泡的特性。空白类脂囊泡对ATC 测定无干扰,ATC保留时间为5.20 min,理论板数、拖尾因子等均符合要求,特征峰与其他成分峰间的分离度均大于1.5,表明方法专属性强。色谱图见图1。

图1 高效液相色谱图Fig.1 HPLC chromatogram
线性关系考察:取ATC 适量,用甲醇溶解,并分别稀释为质量浓度为5,10,15,20,30,40,50 μg/mL 的标准贮备液,按2.2.1 项下色谱条件进样测定,以质量浓度(C)为横坐标、峰面积(A)为纵坐标进行线性回归,得回归方程A=48.187C-74.23(R2=0.999 9,n=7)。结果ATC 质量浓度在5~50 μg/mL 范围内与峰面积线性关系良好。
检测限与定量限确定:精密量取ATC 供试品溶液,按2.2.1项下色谱条件进样测定,记录色谱图的信噪比(S/N),分别以S/N为10 和3 时的进样量确定最低定量限和最低检测限。结果ATC 最低定量限和检测限分别为0.617 ng和0.184 ng。
精密度试验:分别取等体积10,20,40 μg/mL 不同质量浓度的ATC供试品溶液,按2.2.1项下色谱条件进样测定,每日进样5次,计算日内精密度;另在每日同一时间内进样1 次,连续进样5 d,计算日间精密度。结果见表1,表明仪器精密度良好。
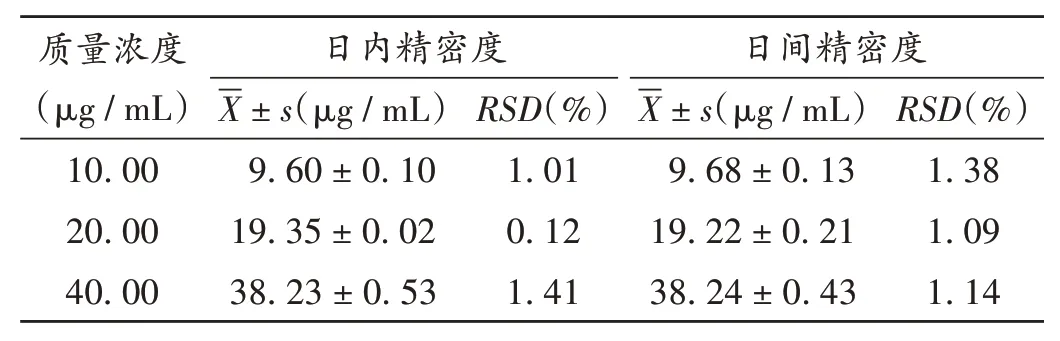
表1 日内和日间精密度试验结果(n=5)Tab.1 Results of intra-day and inter-day precision tests(n=5)
加样回收试验:取精密度试验项下不同质量浓度的ATC 供试品溶液,分别加入空白类脂囊泡液5.0 mL,经适量甲醇稀释得3 种质量浓度贮备液,按2.2.1 项下色谱条件连续进样测定3 次,记录峰面积,代入线性回归方程,经计算得3种质量浓度下的加样回收率分别为(100.65±0.84)%,(100.52±0.62)%,(100.38±0.67)%,RSD分别为0.84%,0.62%,0.67%(n=3),表明方法准确度好。
2.3 包封率与载药量测定
量取2.1 项下ATC-NIS 混悬液1.0 mL,置离心管中离心(转速为10 000 r/ min)10 min,弃上清液,加蒸馏水重新分散清洗沉淀2 次,加适量甲醇溶解沉淀,转移至25.0 mL 容量瓶中,定容,过0.22 μm 有机相滤膜,按2.2.1 项下色谱条件进样测定,记录峰面积,带入线性回归方程计算游离药物量,按公式计算ATC-NIS 的包封率及载药量。包封率(%)=(投药量- 游离药物量)/投药量×100%,载药量(%)=囊泡内包封药物量/囊泡质量×100%。
2.4 工艺与处方因素水平确定
超声时间:按2.1项下方法制备ATC-NIS,固定其他因素不变。只改变超声时间[21],设定超声功率为200 W,超声时间分别为5,8,10,12,15 min,考察超声时间对类脂囊泡包封率的影响。超声时间的长短会直接影响类脂囊泡的粒径及包封率的大小,超声时间过久可能会破环类脂囊泡的结构而使药物泄露。由图2 A可知,经单因素试验确定超声时间范围为10~15 min。
Span60 与ATC 质量比:按2.1 项下方法制备ATCNIS,固定其他因素不变。只改变Span60 与ATC 质量比[22],设定处方内Span60 添加量为0.086 g,比例分别为4∶1,6∶1,8∶1,10∶1,12∶1,考察Span60与ATC的比例对类脂囊泡包封率的影响。药脂比是类脂囊泡构成的关键因素,非离子表面活性剂起支撑作用,影响类脂囊泡的构型,从而影响药物的包封率。由图2 B 可知,经单因素试验确定Span60 与ATC 质量比在6∶1~8∶1 范围内存在最优比例。
β- 谷甾醇添加量:按2.1 项下方法制备ATC -NIS,固定其他因素不变。考察当β-谷甾醇添加量分别为6,8,10,12,14 mg 时对类脂囊泡包封率的影响。β-谷甾醇在类脂囊泡中起膜稳定剂的作用[23],使双层膜结构更加紧密,防止药物泄露,提高包封率。由图2 C 可知,经单因素试验确定β-谷甾醇添加量为10~14 mg。

图2 不同处方单因素对ATC-NIS包封率的影响(n=3)A.Ultrasound time B.Span60∶ATC(m∶m) C.Addition amount of β-sitosterolFig.2 Effect of different prescription factors on the encapsulation efficiency of ATC-NIS(n=3)
2.5 Box-Behnken 响应面法优化处方
优化编码及水平:经单因素试验确定影响ATC -NIS 制备过程中较显著的3 个因素的3 个水平,采用Box - Behnken 响应面法优化处方,以包封率为评价指标,考察Span60∶ATC(因素A)、β- 谷甾醇加水量(因素B)、超声时间(因素C)对类脂囊泡包封率的影响。试验因素与水平见表2,结果见表3。
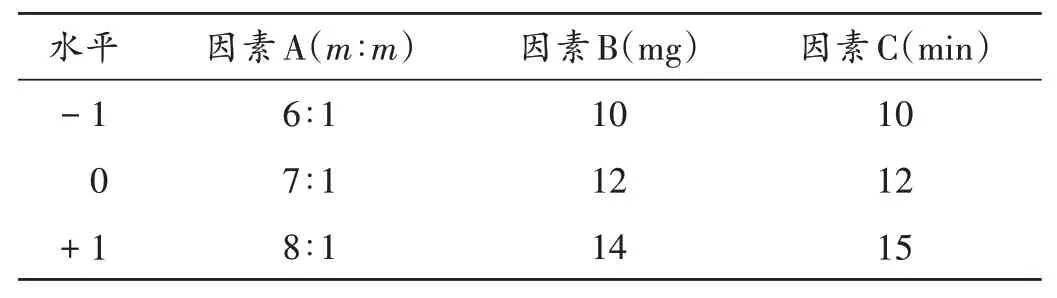
表2 Box-Behnken响应面法因素与水平Tab.2 Factors and levels of the Box-Behnken response surface methodology

表3 Box-Behnken响应面法试验设计与结果Tab.3 Experimental design and results of the Box-Behnken response surface methodology
多元二次回归方程建立:经Design - Expert 8.0.6软件对表3中的数据进行回归分析,得二次多元回归方程Y= 74.41 - 0.067 5X1+ 1.13X2-1.39X3+0.432 5X1X2+1.64X1X3+2.31X2X3-9.20X12-8.96X228.12X32(R2=0.993 6,P<0.01)。由表4 可知,数学模型拟合良好,预测数据可靠,可信度高,失拟项P值大于0.05,表明模型预测值与实测值差异较小。

表4 ATC-NIS包封率回归模型系数的方差分析结果Tab.4 ANOVA results of encapsulation efficiency regression model coefficient of ATC-NIS
优化预测:由试验结果可知,影响因素中显著性大小为C >B >A,根据优化目的,将包封率设为最大,通过Design-Expert 8.0.6 软件绘制不同影响因素对于各指标的三维响应面图,结果见图3。得到优化后的处方为Span60∶ATC为7∶1(m/m),β-谷甾醇添加量为12 mg,超声时间为12 min。按优化的最优处方工艺,平行制备3批ATC-NIS,所得包封率为(75.36±1.17)%(n=3),载药量为(7.95 ± 0.42)%(n= 3)。与包封率预测值74.6%接近,说明所建立的方法预测性良好。

图3 各影响因素对ATC包封率影响的三维响应面图Fig.3 3D response surface of various influencing factors on encapsulation efficiency of ATC
2.6 ATC-NIS 的体外质量评价
粒径分布及Zeta 电位测定:取ATC - NIS 适量,精密称定,加蒸馏水按1∶1比例稀释,使其分散均匀,使用激光粒度分析仪测量平均粒径、多分散系数(PDI)和Zeta电位,重复3次。ATC-NIS粒径为(211.81±1.05)nm,PDI为0.199±0.013,Zeta电位为(-38.24±0.105)mV。详见图4和图5。

图4 ATC-NIS粒径分布Fig.4 Distribution of particle size of ATC-NIS

图5 ATC-NIS Zeta电位图Fig.5 Zeta-potential of ATC-NIS
外观形态:采用磷钼酸负染色法制备透射电镜样品,取少量ATC-NIS,加双蒸水稀释后滴在铜网上,室温干燥,滴加2.0%磷钨酸染液负染色,室温下孵育过夜,晾干,在透射电子显微镜下观察ATC - NIS 的微观形态。结果ATC-NIS 相对分散无聚集,呈大小均一、表面光滑的类球形。详见图6。

图6 ATC-NIS透射电子显微镜整体形态(×10 000)Fig.6 Overall morphology of the transmission electron microscope of ATC-NIS(×10 000)
体外释放行为考察:考察ATC-NIS 在磷酸盐缓冲液(pH 6.8)中的释放行为[24],首先取等体积ATC-NIS和ATC 溶液适量,置透析袋中,两端扎紧,将透析袋浸入900.0 mL 含有0.5% SDS 的磷酸盐缓冲液(pH 6.8)释放介质中,置恒温水浴摇床振荡,温度保持在(37 ±0.5)℃,搅拌速率为90 r/min,于0,0.5,1.0,1.5,2.0,2.5,3.0,4.0,5.0,6.0,7.0,8.0,12.0,24.0,36.0,48.0 h 时收集样品3.0 mL,同时添加等体积新鲜释放介质,采集的样品经0.22 μm滤膜滤过,适当稀释,并按2.2.1 项下色谱条件进样测定,分析每个时间点的药物含量,并以ATC原料药为参比制剂进行试验,重复5次。计算各时间点的累积释放率,绘制ATC 和ATC-NIS 的释放曲线。由图7 可知,ATC 在5.0 h 内释放96.77%以上,而ATC-NIS在48.0 h内可稳定、长效地持续释放。

图7 ATC-NIS在pH 6.8磷酸盐缓冲液中的体外释放情况(n=5)Fig.7 Release profiles in vitro of ATC-NIS in pH 6.8 PBS(n=5)
3 讨论
类脂囊泡是具备优良生物相容性的药物载体,其特殊的双层类脂质膜结构可将疏水性成分ATC 包载于壁层。本研究中制备ATC - NIS,经单因素筛选Span60与ATC 质量比可知,随着投药量的增加,包封率呈现先增大后减小的趋势,推测是由于投药量增加使囊材所包覆药物量增大,囊泡体系黏度增加,但当投药量持续增大时,囊材的包载能力达到临界值后会引起漏药,包封率减小。
因3个影响因素间存在交互作用,采用Box-Behnken响应面法优化ATC-NIS的制备工艺,经Design-Expert构建数学模型响应面图,因素影响大小为超声时间>β-谷甾醇添加量>Span60∶ATC(m∶m)。超声时间对包封率的影响最显著,随着超声时间的增大,包封率先增大后减小,可能是超声使囊泡粒子均匀分散在外水相溶液中,但超声时间过长会使囊泡粒子破裂,导致包封药物渗出,从而降低包封率。
β-谷甾醇作为类脂囊泡中的膜稳定剂,与类脂囊泡的包封率关系密切,随着添加量的增加,膜材由坚实变得柔软且富有弹性,为类脂囊泡提供了较强的流动性,药物更稳定地包载于囊材中,不易破裂,但添加过量时会导致囊材流动性过大,使ATC - NIS 不易成型,从而降低包封率。
对所优化的最优处方进行模拟体外释放显示,ATC-NIS 可显著减缓ATC 的释放。激光粒度仪分析显示,ATC - NIS 粒径分布均匀,通过透射电子显微镜观察ATC-NIS 的形态特征为球形或类球形。综合分析表明,薄膜分散法结合超声的应用可有效减小NIS的粒径大小,降低粒子间的聚集,Box-Behnken 响应面法优化ATC - NIS 准确可靠、高效可行,得到具备缓释效果的ATC-NIS,为后期试验奠定了制剂学基础。
