新型冠状病毒血清特异性抗体不同方法学检测分析
2023-05-11王倩张华袁玉华
王倩,张华,袁玉华
(1.天津医科大学总医院检验科,天津 300052;2.天津医科大学总医院空港医院检验科,天津 300300)
随着新型冠状病毒肺炎疫情的发生和发展,人们对新型冠状病毒(SARS-CoV-2)的认识不断深入,检测和诊疗经验在不断积累,血清学检测方法在公共卫生和临床应用领域发挥着越来越重要的作用。核酸检测作为当前新型冠状病毒感染诊断的金标准,其特异性较高,但其检测结果的准确性受采样部位、样本质量、保存条件以及试剂盒性能等的影响,容易出现假阴性而漏诊的情况。血清学抗体检测通过检测宿主对该病毒的体液免疫反应而能够间接检测出当前或既往感染[1]。血清新型冠状病毒特异性IgM 抗体和IgG 抗体阳性;血清新型冠状病毒特异性IgG 抗体由阴性转为阳性或恢复期较急性期有4 倍及以上升高已成为新型冠状病毒肺炎确诊依据[2]。血清学抗体检测样本易于获得、保存和运输,其可与核酸检测协同进行,并可通过连续监测来判断病情。目前SARS-CoV-2 抗体IgM 和IgG 检测已被纳入到《新型冠状病毒肺炎防控方案(第五版)》和《新型冠状病毒肺炎诊疗方案(试行第七版)》中[2-3]。有研究表明联合血清学抗体检测可以降低核酸检测的假阴性和假阳性[4]。作为一种辅助方法,血清学抗体检测可以用来诊断出现症状9~14 d后检测的患者,这个时候鼻咽拭子样本的核酸检测敏感度下降,而抗体检测的敏感度提高,结合使用两种检测手段可以大大增加确诊测试的敏感度[5]。现阶段我国已批准上市的SARS-CoV-2 特异性抗体检测试剂在方法学上主要包括胶体金免疫层析法和化学发光法,两者有其各自的优势和局限性,本实验旨在对这两种方法学在SARS-CoV-2 特异性抗体检测中的阳性检出率进行比较,并简单比较新型冠状病毒肺炎确诊患者和无症状感染者血清学抗体检测阳性率是否存在差异。
1 材料与方法
1.1 材料
1.1.1 试剂 A、B、C、D、E 胶体金免疫层析法新型冠状病毒抗体检测试剂、F 磁微粒化学发光法抗体检测试剂。
1.1.2 仪器 Bioscience Axceed 260 全自动化学发光免疫分析仪,Biobase 二级A2 型生物安全柜。
1.1.3 样本 2020 年3 月25 日—2020 年5 月7 日天津医科大学总医院空港医院外来入境和隔离点确诊患者及无症状感染者静脉血标本,其中10 例为新型冠状病毒肺炎确诊患者,11 例为无症状感染者,确诊组患者年龄(29.7±12.5)岁,男/女=5/5,发病时间(42.4±33.9)d;无症状感染组年龄(36.7±17.6)岁,男/女=1/10,两组间年龄差异不存在统计学意义(P>0.05),本研究中确诊病例使用转院前最近一次抗体检测结果,无症状感染者则使用入院1 周后的第二次抗体检测结果(与入院时第一次检测结果均存在一致性),所选择的无症状感染者均已排除自身免疫功能异常影响并在后期随访中未发现转为确诊。空白对照组为20 例排除新型冠状病毒感染者。以《新型冠状病毒肺炎诊疗方案(试行第九版)》[11]中相关规定为确诊依据。空白对照组为20 例排除新型冠状病毒感染者。以《新型冠状病毒肺炎诊疗方案(试行第九版)》[11]中相关规定为确诊依据。
1.2 实验方法 样本处理在二级生物安全柜内进行,紫外灯照射下,3 500 r/min,离心5 min,静置15 min,不同方法样本操作严格按照各试剂厂商说明书进行,相关生物安全处理及防护均参照《2019新型冠状病毒肺炎临床实验室检测的生物安全防护指南(试行第一版)》[6]。
1.3 统计学处理 通过公式:阳性率=阳性例数/总样本量×100%,计算阳性率,统计分析使用SPSS 21.0 软件,使用t 检验对两组别年龄进行差异分析,使用Fisher 确切概率法对抗体IgM、IgG 用不同方法检测的阳性检出率做差异分析,P<0.05 为具有统计学意义。
2 结果
2.1 抗体IgM 抗体IgM 使用不同方法学检测的阳性率见表1、病例检测结果见表2、3。确诊病例组使用B、C、D、E、F 检测IgM 抗体的阳性率时差异存在统计学意义(P<0.05),使用Fisher 确切概率法对抗体IgM 用不同方法检测的阳性检出率做差异分析发现,B 与C,B 与D,B 与E,C 与F,D 与F,E 与F 的阳性率差异存在统计学意义(均P<0.05),见表4,图1。同时比较磁微粒化学发光法与胶体金免疫层析法阳性率发现,C、D、E 3 种方法与磁微粒化学发光法F 间的阳性率差异存在统计学意义(P<0.05),通过磁微粒化学发光法检测,可以将确诊病例检测IgM 抗体的阳性率提高80%~90%。无症状感染组使用B、C、D、E、F 检测IgM 抗体的阳性率时差异存在统计学意义(P<0.05),通过两两比较发现,B 与C,B与D,B 与E,C 与F,D 与F,E 与F 的差异存在统计学意义(P<0.05),见表5、图1。通过磁微粒化学发光法检测,可以将无症状感染组检测IgM 抗体的阳性率提高90.9%。
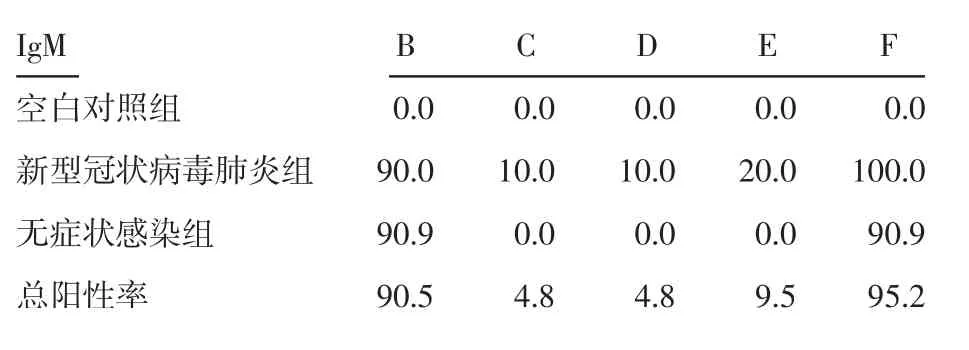
表1 不同方法测定抗体IgM 的阳性率(%)Tab 1 IgM positive rate determined by different method(%)

表3 无症状感染组IgM 检测结果Tab 3 IgM test results in asymptomatic infection group
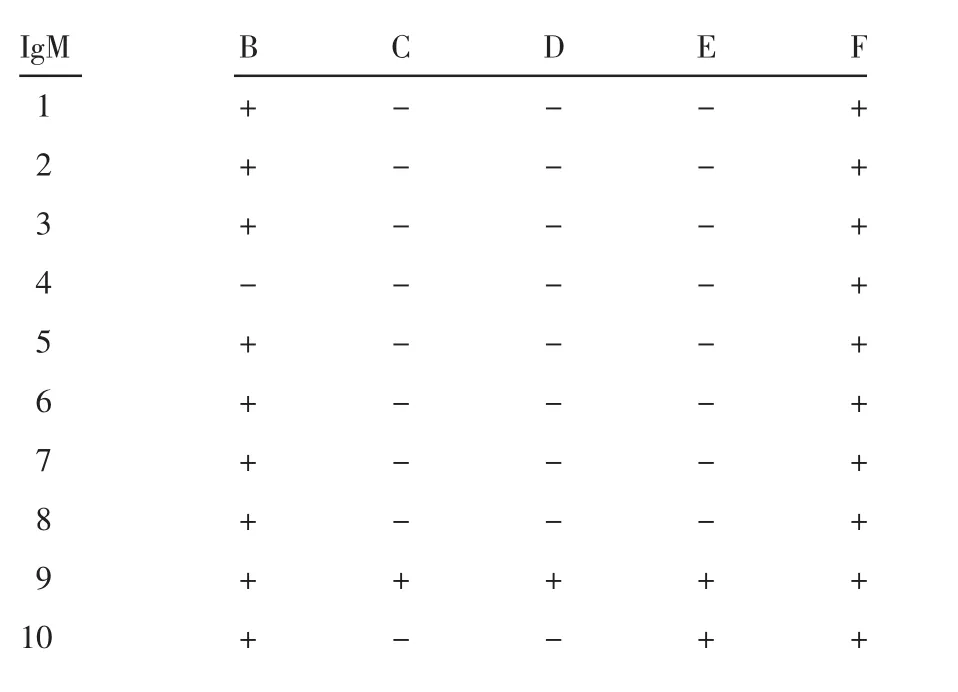
表2 新型冠状病毒肺炎组IgM 检测结果Tab 2 IgM test results in the COVID-19 group
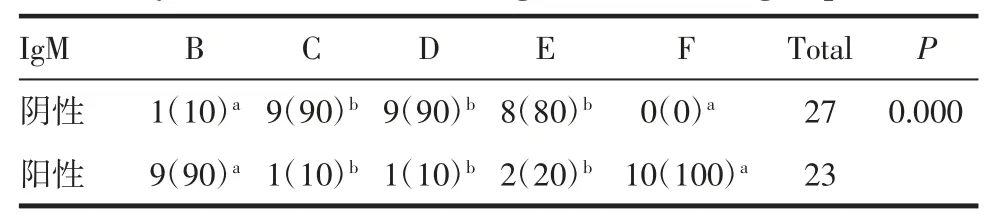
表4 确诊病例组不同方法测定抗体IgM 的阳性率多组间比较[n(%)]Tab 4 Comparison of the positive rate of IgM antibody measured by different methods among confirmed case groups[n(%)]
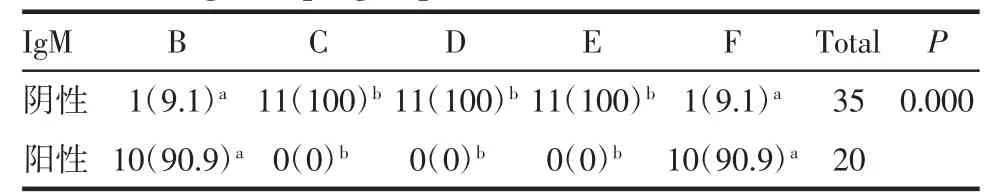
表5 无症状感染组不同方法测定抗体IgM 的阳性率多组间比较[n(%)]Tab 5 Comparison of the positive rate of antibody IgM measured by different methods in asymptomatic infection group among multiple groups[n(%)]
2.2 抗体IgG 抗体IgG 使用不同方法学检测的阳性率见表6。病例检测结果见表7、8。在抗体IgG 检测中,通过统计学比较发现确诊病例组用C、D、E、F检测IgG 抗体的阳性率时差异不存在统计学意义(P>0.05)见表9、图1;无症状感染组用C、D、E、F 检测IgG 抗体的阳性率时差异存在统计学意义(P<0.05),使用Fisher 确切概率法对抗体IgG 用不同方法检测的阳性检出率做差异分析发现,C 与D,C 与E,F 与D,F 与E 的差异存在统计学意义(P<0.05),见表10、图1。通过磁微粒化学发光法检测,可以将无症状感染组检测IgG 抗体的阳性率提高36.4%~45.5%。另外,A 试剂阳性率为100%,其测定总抗体,不区分免疫球蛋白类型。
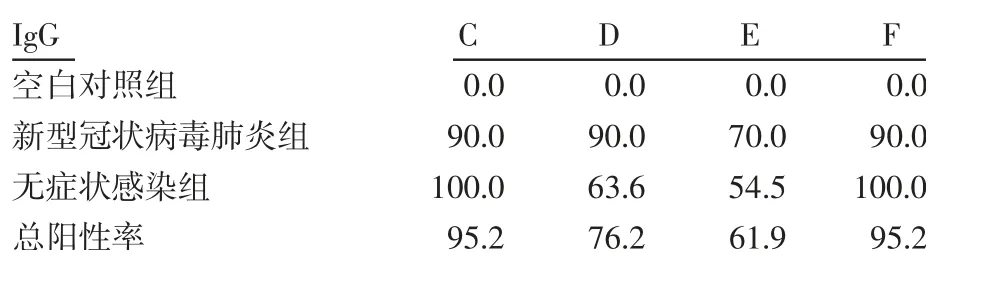
表6 不同方法测定抗体IgG 的阳性率(%)Tab 6 Determination of IgG positive rate by different methods(%)

表7 新型冠状病毒肺炎组IgG 检测结果Tab 7 Results of IgG detection in the COVID-19 group
表8 无症状感染组IgG 检测结果Tab 8 Results of IgG assay in asymptomatic infection group

表9 确诊病例组不同方法测定抗体IgG 的阳性率多组间比较[n(%)]Tab 9 Comparison of the positive rate of antibody IgG measured by different methods among confirmed case groups[n(%)]

表10 无症状感染组不同方法测定抗体IgG 的阳性率多组间比较[n(%)]Tab 10 Comparison of the positive rate of antibody IgG measured by different methods in asymptomatic infection group[n(%)]

图1 多种方法检测IgM、IgG 及总抗体阳性率分别在确诊组和无症状感染组中的多组间比较Fig 1 Multigroup comparison of IgM,IgG and total antibody positive rates in the confirmed and asymptomatic infection groups,respectively
3 讨论
本文涉及到的阳性患者例数相对较少,处于疾病的不同阶段,抗体IgM、IgG 可能产生滴度较低或产生滴度下降,可能低于试剂的检测限未被检出,更有说服力的试剂性能评价有待于积累更多不同阶段感染病例标本进一步测定。随着对新型冠状病毒认识的不断加深,标本的复检流程也需要不断更新。本研究发现磁微粒化学发光法相较于胶体金免疫层析法检测新型冠状病毒肺炎患者抗体IgM 以及无症状感染者抗体IgM 和IgG 具有更的高阳性检出率,更有利于区分既往感染和当前感染,但其对检测条件有较高要求,检测时间相对较长;胶体金免疫层析法检测速度快,灵敏度相对磁微粒化学发光法较低,不同医疗机构实验室应根据收治患者的具体情况制定符合自身的复检流程。作为补充筛查手段,新型冠状病毒抗体检测需要动态观察,必须结合患者流行病学史、临床症状以及病毒核酸检测或抗原等病原学检测进一步确定。
本研究通过比较不同方法学在新型冠状病毒肺炎确诊患者和无症状感染者中SARS-CoV-2 特异性抗体的阳性检出率发现,在确诊组和无症状感染组,胶体金免疫层析法对抗体IgM 的阳性检出率均低于磁微粒化学发光法,在无症状感染组,胶体金免疫层析法对抗体IgG 的阳性检出率低于磁微粒化学发光法。原因可能包括两方面:一方面,检测试剂所包被抗原片段的选择至关重要,在COVID-19 感染的早期阶段,机体产生靶向刺突糖蛋白(S)的IgM 抗体,感染后期产生结合S、核衣壳磷酸化蛋白(N)和Orf1Ab 蛋白的IgG 抗体[7]。S 蛋白存在于病毒表面对于病毒进入人体必不可少[5],而N 和Orf1Ab 蛋白通常被隔离在病毒颗粒内,随着病毒在宿主细胞内复制,N 和Orf1Ab 蛋白可能会从细胞中释放出来,并随后被体液免疫系统识别[8]。被用作抗原靶标的S 蛋白包括多种形式:全长S 蛋白(S1+S2)、S 蛋白胞外域(S1+S2ECD)、S 蛋白亚基1受体结合域(S1-RBD)等。由于来自不同制造商的胶体金免疫层析法试剂多选用N 蛋白、S 蛋白和(或)S蛋白片段作为靶标[7],本研究中磁微粒化学发光法F测定IgM 抗体,使用刺突糖蛋白亚基1 受体结合域(S1-RBD)蛋白为靶标。由于包被抗原片段不同,有研究结果表明,N 蛋白IgM 抗体不能区分COVID-19 和其他流感和非流感患者,IgG 抗体对N 蛋白的敏感性也很低,靶向S1-RBD 和S1+S2ECD 的IgM抗体可以最好地鉴别COVID-19 患者和其他流感和非流感患者,而S2ECD 和S1+S2ECD 蛋白可能是IgG 抗体检测的最佳抗原靶标[9]。在确诊患者组,胶体金免疫层析法和磁微粒化学发光法检测抗体IgG,其阳性率没有表现出统计学差异,由于本研究样本数量较少,结果有待于更大批量样本的验证。另一方面,胶体金免疫层析法本身在方法学上有其自身的局限性,灵敏度低,相比之下,化学发光法检测限低、线性范围宽,提高了其检测的灵敏度。美国CDC 指出蛋白靶标决定了血清学检测的交叉反应性和特异性[5]。在早期SARS-CoV 的研究中[10]已观察到SARS-CoV 的N 蛋白与已知动物冠状病毒的多克隆抗血清发生交叉反应,因此交叉反应的可能性也是一个值得关注的问题。
同时,随着人群患病率的不同,抗体检测需要达到不同阳性预测值。在高患病率的情况下,阳性预测值会增加,而在低患病率环境中,阴性预测值上升。本研究所涉及的人群均为外来入境申报人员,该人群患病率明显高于本地区一般人群,而当前批准上市的抗体检测试剂,预期用途也被严格限定为新型冠状病毒肺炎患者及高危人群[3],该试剂适用于该人群,具有一定的可信性。如应用于一般人群筛查,笔者认为应注意选择高特异性和高阳性预测值的方法以提高检测结果的可信性。有指南[5]提出了提高抗体检测阳性预测值的几种策略,包括选择具有足够高特异性(如95%)的检测,并检测高危个体或人群(例如,有与COVID-19 相关症状史的人或接触过暴发地区的人)以及当单次试验不能保证高阳性预测值时,使用正交试验算法(Orthogonal testing algorithm),即使用两种高特异性的不同方法学实验进行独立检测,通过群体概率和贝叶斯定理进行统计学计算以提高阳性预测值。尽管正交测试算法的性能还有待系统的评估,但当前这种方法不失为提高阳性预测值的策略之一。
