短链脂肪酸对肝细胞糖脂代谢调节的作用机制研究
2023-05-11孙亚朝邓邦利牛文彦
孙亚朝,邓邦利,牛文彦
(天津医科大学基础医学院免疫学系,天津 300070)
近年来,随着人们生活方式和饮食习惯的改变,糖尿病在全球的流行趋势越来越严峻。据相关组织预测,全球约有5.37 亿成年人患有糖尿病,预计到2030 年,这一数字将增至6.43 亿,到2045 年将达到7.83 亿[1]。其中2 型糖尿病患者约占所有糖尿病病例的90%,胰岛素抵抗是其重要诱因。胰岛素抵抗时,主要的胰岛素靶组织对胰岛素的敏感性降低,胰岛素信号转导减弱和生物作用受损[2]。肝脏是胰岛素的重要靶组织,其代谢异常与胰岛素抵抗和2 型糖尿病的发生、发展密切相关。餐后血糖升高促进胰岛素分泌,胰岛素通过血液循环到达肝脏,与肝细胞表面受体结合激活胰岛素信号通路,促进肝细胞摄取葡萄糖并转换为肝糖原储存,达到降低血糖的作用。肥胖时脂质在肝脏积聚诱发胰岛素抵抗,胰岛素调节肝脏糖脂代谢能力减弱[3]。因此,靶向调节肝脏糖脂代谢,改善胰岛素抵抗,是预防和控制2 型糖尿病发生、发展的关键治疗策略。
肠道菌群由多种微生物组成,并且是一个较复杂的生态系统,包含250 多种细菌、真菌、病毒等,他们可与宿主共生[4-5]。这些微生物在肠道中产生的大量小分子可调节机体代谢,维持机体代谢平衡[6]。生理状态下,潜在致病和非致病微生物之间存在平衡,这有助于维持肠道功能和宿主健康。然而,不利的外部刺激可改变参与疾病发病机制的肠道菌群的组成[7-8],引起肠道菌群代谢物产生的异常,导致代谢异常,涉及胰岛素抵抗。肠道菌群代谢产物,包括短链脂肪酸(short chain fatty acids,SCFAs)和氨基酸衍生物等,其中SCFAs,主要包括乙酸、丙酸和丁酸[9]。SCFAs 如何影响肝脏糖脂代谢的机制还未完全阐明。本研究用不同的SCFA 孵育小鼠肝细胞,检测对糖脂代谢的影响及其机制。
1 材料与方法
1.1 实验材料 AML12 小鼠肝细胞株(厦门大学林圣彩院士惠赠)、胎牛血清、DMEM/F12 培养基、Hank's 平衡盐溶液(Hank's Balanced Salt Solution,HBSS)(美国GIBCO 公司),蛋白酶抑制剂、乙酸钠、丙酸钠、丁酸钠(美国Sigma 公司),抗Actinin-1 抗体(中国Absin 公司),牛血清白蛋白(中国鼎国生物技术公司),抗β-actin 抗体、抗磷酸化Akt、AMPK、GSK-3β 和ACC 抗体以及AMPK 总蛋白抗体(美国CST 公司),Tannon-5200 化学发光成像系统(北京原平皓生物技术有限公司),增强化学发光底物检测试剂盒、0.45 μm 孔径的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、二辛可宁酸(bicinchonininc acid,BCA) 蛋白浓度测定试剂盒和RIPA 细胞裂解液(美国Millipore 公司)。山羊抗小鼠抗体、耦联辣根过氧化物酶的山羊抗兔抗体(美国Jackson Immuno Research 公司)。
1.2 实验方法
1.2.1 细胞培养 在37°C、5%CO2条件下用含10% 胎牛血清的DMED/F12 培养基培养AML12小鼠肝细胞,接种于75 cm 的细胞培养瓶中,隔天传代后,将细胞接种于12 孔培养板中。待细胞培养板中的细胞密度达到70%时将1、2、4、8 和16 mmol/L 浓度的乙酸、丙酸和丁酸的钠盐分别作用于细胞24 h。
1.2.2 Western 印迹检测 将配置好的含1 mmol/L Na3VO4、0.5 mmol/L NaF、1 μmol/L PIC 和200 mmol/L PMSF 的RIPA 细胞裂解液4℃预冷。弃去已处理好的12 孔板中细胞的上清液,4℃预冷的HBSS 缓冲液快速洗清细胞两次,弃去上清液,细头吸管吸去残留液,接着将培养板置于冰上。将预冷的RIPA 细胞裂解液按每孔200 μL 的量加入培养板中,冰上静止20 min,并收集。将收集的裂解液在4℃环境下以13 000 r/min 的转速离心20 min,取上清,BCA法检测蛋白浓度。加入LSB,100℃金属浴温度下5 min 备用。配置10%的聚丙烯酰胺凝胶,待凝胶凝固后装置在电泳槽中,加入蛋白样品,先80 V 电压电泳0.5 h,再以110 V 的电压电泳1 h 后,将载有蛋白的聚丙烯酰胺凝胶等组成“三明治”,并放置于转膜夹中,在恒电压下转膜2 h,小刀切取已转移到PVDF 膜上的目的蛋白的相应条带,接着用3%牛血清白蛋白室温封闭目的条带2 h 后,分别用不同的一抗4℃在摇床上孵育目的条带过夜后,洗膜液洗膜4 次,每次15 min。接下来将目的条带置于相应二抗中室温下摇床上孵育2 h,洗去膜上未结合的二抗。曝光机下检测各条带信号,Image J 软件定量分析。
1.3 统计学处理 采用GraphPad Prism6 统计软件。用Shapiro-Wilk 检验对计量资料进行正态性检验,符合正态性分布的资料采用,用独立样本t检验比较组间差异;非正态性分布资料采用非参数Wilcoxon 秩和检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 SCFAs 对Akt 磷酸化的影响 本部分分别用1、2、4、8 和16 mmol/L 的乙酸、丙酸和丁酸的钠盐作用于AML12 细胞24 h,Western 印迹检测Akt 的磷酸化水平。结果如图1,乙酸钠不影响Akt 的磷酸化(图1A),而16 mmol/L 丙酸钠显著升高Akt 磷酸化水平,为对照组的(1.56±0.09)倍(F=3.251,P<0.05)(图1B),8 mmol/L 和16 mmol/L 的丁酸钠显著增加Akt 的磷酸化,分别为对照组的(1.66± 0.18)倍(F=8.249,P<0.05)和(2.00±0.16)倍(P<0.01,图1C)。

图1 AML12 细胞中Akt pS473 磷酸化水平Fig 1 The levels of Akt pS473 in AML12 cells
2.2 SCFAs 对GSK-3β 磷酸化的影响 本部分同2.1 处理细胞,检测磷酸化的GSK-3β。结果显示,GSK-3β 的磷酸化水平不受乙酸钠的影响(图2A),丙酸钠作用下,GSK-3β 磷酸化水平呈无显著性升高(图2B),而8 mmol/L 的丁酸钠显著升高GSK-3β磷酸化水平,为对照组的(1.61±0.14)倍(F=4.690,P<0.05,图2C)。

图2 AML12 细胞中GSK-3β pS9 磷酸化水平Fig 2 The levels of GSK-3β pS9 in AML12 cells
2.3 SCFAs 对AMPK 磷酸化的影响 同2.1 处理细胞,Western 印迹检测AMPK 的磷酸化水平和总蛋白表达。结果显示,乙酸钠、丙酸钠、丁酸钠在不影响AMPK 总蛋白表达的情况下,不同程度的上调AMPK 的磷酸化水平。当乙酸钠浓度在2 mmol/L 时即可显著升高AMPK 磷酸化水平,为对照组的(1.40±0.13)倍(F=4.720,P<0.05),4 mmol/L 时达最高水平(1.71±0.14)倍(P<0.01,图3A)。丙酸钠在浓度为1 mmol/L 时即显著增加AMPK 的磷酸化水平,为对照组的(1.66±0.18)倍(F=16.54,P<0.05),8 mmol/L 时达最高水平(2.45±0.09)倍(P<0.001,图3B)。浓度为2 mmol/L 的丁酸钠即可显著磷酸化AMPK,为对照组的(1.70±0.13)倍(F=23.50,P<0.05),8 mmol/L 时达最高水平(2.40±0.16)倍(P<0.001,图3C)。
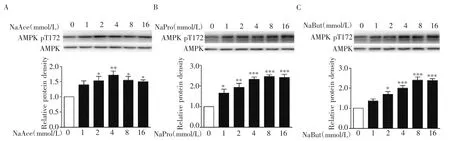
图3 AML12 细胞中AMPK pT172 磷酸化水平Fig 3 The levels of AMPK pT172 in AML12 cells
2.4 SCFAs 对ACC 磷酸化的影响 同2.1 处理细胞,Western 印迹检测ACC 的磷酸化水平。结果发现乙酸钠在浓度为16 mmol/L 时可显著磷酸化ACC,此时其磷酸化水平为对照组的(2.01±0.30)倍(F=4.807,P<0.01,图4A)。4 mmol/L 丙酸钠显著升高ACC 的磷酸化,为对照组的(1.66±0.18)倍(F=7.507,P<0.05),16 mmol/L 时达最高水平(1.93±0.05)倍(P<0.01,图4B)。丁酸钠在浓度1 mmol/L时即可显著升高ACC 磷酸化水平,为对照组的(1.79±0.06)倍(F=7.028,P<0.01),8 mmol/L 时达最高水平(1.94±0.14)倍(P<0.01,图4C)。

图4 AML12 细胞中ACC pS79 磷酸化水平Fig 4 The levels of ACC pS79 in AML12 cells
3 讨论
机体胰岛素抵抗时通常伴随着2 型糖尿病的发生、发展,此时机体糖脂代谢紊乱,胰岛素调节靶组织信号分子的效应减弱。肠道菌群失调与胰岛素抵抗和2 型糖尿病相关,与肠道菌群中的产丁酸菌产生的SCFA 有关,SCFA 由丁酸菌在肠道中通过发酵膳食纤维产生[7,10-12]。2 型糖尿病患者体内产SCFA的丁酸梭菌菌群数量有所下降,在接受正常个体移植的粪便后,肠道内产生SCFA 的细菌成分增加,外周胰岛素抵抗显著改善[13],提示SCFA 可能参与了机体糖脂代谢调节。
肝脏是机体葡萄糖和脂质代谢的主要场所,对维持全身血糖和血脂稳态起重要作用。肝细胞既能消耗葡萄糖,又能产生葡萄糖,血糖浓度决定了肝脏代谢葡萄糖的方式。餐后血糖升高,胰腺分泌胰岛素,肝细胞在胰岛素刺激下通过葡萄糖转运蛋白2(glucose transporter 2,GLUT2)摄取葡萄糖。肝细胞中葡萄糖的摄取主要依赖肝细胞膜表面的GLUT2,其介导的肝脏葡萄糖摄取效率较高,当肝脏细胞内葡萄糖浓度高于30 mmol/L 时达到饱和状态从而开始限制葡萄糖的摄取[14]。随后在糖原合酶激酶-3(glycogen synthase kinase-3,GSK-3)作用下,进入肝细胞的葡萄糖通过一系列生化反应生成肝糖原,这有助于肝脏继续摄取葡萄糖,从而降低血糖。在哺乳动物中,GSK-3 有GSK-3α 和GSK-3β两种亚型,其中GSK-3β 在肝细胞中作用于糖原合酶(glycogen synthetase,GS),使其被激活,进而促进葡萄糖转化为糖原[15]。GSK-3 在未磷酸化时处于激活状态,磷酸化后失活[16]。基础状态下,GS 的S657 磷酸化位点被酪蛋白激酶Ⅱ磷酸化,接着在GSK-3 调节下磷酸化GS 的S653、S649、S645 和S641 位点,从而使GS 失活[17-18]。GSK-3 参与胰岛素作用下的肝糖原合成,此条件下其受上游分子Akt的调节。Akt 是重要的胰岛素信号分子,介导胰岛素调节肝脏糖代谢的作用,胰岛素抵抗时其磷酸化水平降低[19]。胰岛素通过胰岛素信号通路IRS-1/PI3K的信号转导磷酸化Akt,接着GSK-3β S9 和GSK-3α S21 在Akt 的调节下被磷酸化进而使GSK-3 瞬时失活,失活的GSK-3 促进糖原合成酶累积,导致肝细胞内过量的葡萄糖转化为肝糖原,这就完成了胰岛素调节下肝细胞内葡萄糖转化为糖原的过程[17,20-21]。本研究发现丁酸显著上调Akt 和GSK-3β的磷酸化水平,提示丁酸具有缓解胰岛素抵抗的作用,同时丁酸还可能通过Akt/GSK-3β 途径促进肝细胞糖原合成,具有降血糖作用。有文献报道,SCFA通过作用于内分泌细胞增加肠激素PYY 和胰岛素分泌而抑制胰高血糖素的分泌,进而增强肌肉和脂肪组织对葡萄糖的摄取[22]。此外SCFA 促进脂肪组织分泌瘦素,而瘦素可增加棕色脂肪组织和肌肉葡萄糖摄取,以及肝糖原合成,进而达到降血糖的作用[22-23]。以上研究表明SCFA 可通过促进或者抑制激素的分泌间接调节血糖,本研究结果提示,在肝脏中,SCFA 具有直接作用于肝细胞而调节血糖的潜能。
肝脏同时也是脂代谢的场所。肝脏可通过三羧酸循环将过量的碳水化合物转化为脂质,ACC 是AMPK 的下游靶分子,调节脂代谢[16]。其为脂质合成的限速酶,在AMPK 的调节下通过磷酸化和去磷酸化的作用影响脂代谢[24-25]。哺乳动物中ACC 分为ACC1 和ACC2 两种亚型,而受两种亚型调节所产生的丙二酰辅酶A 具有不同的生理作用,两者产生的丙二酰辅酶A 分别调节脂肪酸合成和脂肪酸氧化[26]。ACC 在未磷酸化时处于激活状态,激活AMPK可使两种ACC 同时磷酸化而失活,进而导致脂肪酸的合成受抑制,而脂肪酸的氧化水平增加,达到降低脂质水平的作用[25]。本研究发现乙酸、丙酸和丁酸磷酸化AMPK 和ACC1,提示SCFA 可能通过AMPK/ACC 途径抑制肝细胞脂肪酸合成,进而减少肝脏脂质积聚,缓解胰岛素抵抗。
综 上,SCFA 可 能 分 别 通 过Akt/GSK-3β 和AMPK/ACC 途径调节糖脂代谢,减少肝脏脂质积聚、降低血糖,进而预防和改善胰岛素抵抗。
