STAT4 rs3024877 单核苷酸多态性与ANCA 相关性血管炎的关系
2023-05-11曹越琦薛超
曹越琦,薛超
(1.天津医科大学第二医院肾脏病血液净化科,天津 300211;2.广西医科大学第二附属医院肾内科,南宁 530007)
原发性抗中性粒细胞胞浆抗体(anti-neutrophi cytoplasmic antibodies,ANCA)相关性血管炎(ANCA associated vasculitis,AAV)是一类可引起多脏器病变的自身免疫性疾病,突出特点为血管壁内皮受损及纤维素样坏死[1],临床表现复杂。随着医疗水平的提高,AAV 的确诊率呈逐年上升趋势,但其发病机制至今尚未明确,全基因组关联(GWAS)研究使AAV 的发病机制有迹可循,提示遗传多态性在AAV的发生发展中起到不可或缺的作用,且与ANCA 抗原特异性相关[2]。
信号转导和转录激活因子4(signal transducer and activator of transcription 4,STAT4)基因编码的蛋白可参与多种免疫细胞的分化,调节多种细胞因子的信号转导,如病原体反应及细胞因子分泌[3-4]。目前国内外有文献报道,STAT4 基因多态性与哮喘、类风湿关节炎等多种自身免疫性疾病易感性相关[5],但在AAV 中的研究较少。本课题组既往研究发现,STAT4 rs10181656 基因多态性与AAV 易感性相关[6],故推测STAT4 基因可能在AAV 发生、发展过程中起到重要作用,为发掘更多与AAV 遗传易感性相关的STAT4 基因点位,故本研究选取STAT4 rs3024877 位点进行研究。
1 对象与方法
1.1 研究对象 选择2005 年1 月—2018 年12 月于广西医科大学第二附属医院就诊的AAV 患者共145 例为AAV 组,入选标准:诊断符合2018 年第二届Chapel Hill 国际血管炎命名会议[7];ANCA 阳性;原发性AAV。对照组为216 名本院同期体检中心的健康志愿者。排除标准:肿瘤、感染、其他原因所致的继发性血管炎、多脏器衰竭及妊娠状态。本研究经广西医科大学第二附属医院医学伦理委员会批准(2013-KY-国基-040),全体纳入对象均知情同意。
1.2 资料收集 收集患者一般资料:年龄、性别、收缩压/舒张压。实验室数据:血常规、肝肾功能、补体、免疫球蛋白。肾脏穿刺病理结果:按2010 年AAV肾脏病理分类法,分为局灶型、新月体型、混合型和硬化型[8]。
1.3 基因组DNA 提取 使用DNA 提取试剂盒[北京天根生化公司],保存符合吸光度值(A260/A280)为1.7~1.9,质量浓度>25 mg/L 的DNA[Nanodrop 2000]。
1.4 基因分型 基因分型采用MPCR-HTS 法,生工生物工程(上海)有限公司完成[9]。步骤:设计引物序列,上游引物:5'-GAGGTTTAGGGAAAGGAGGTG AG-3',下游引物:5'-ATCCTCATAAAACAATCACCACTAAACTCA-3'。合成引物池,采用两步PCR 法完成STAT4 rs3024877 序列扩增和兼容Illumina测序文库的制备。(1)PCR 体系:DNA 模板2 μL;上游引物池1 μL;下游引物池1 μL;2×PCRReady Mix 15 μL;RNase-free H2O 6 μL。扩增:PCR 仪(BIORAD,T100TM):98℃预变性5 min;98℃变性30 s,50℃退火30 s,72℃延伸30 s,共8 个循环;98℃变性30 s,66℃退火30 s,72℃延伸30 s,共25 个循环;72℃延伸5 min,4℃保存,电泳,磁珠[AMPure XP]纯化回收PCR 产物。(2)反应体系:第一轮PCR 产物2 μL,通用P7 引物1 μL;通用P5 引物1 μL;2×PCR Ready Mix 15 μL;RNase-free H2O 11 μL。扩增程序:98℃预变性5 min;94℃变性30 s,55℃退火20 s,72℃延伸30 s,共5 个循环;72℃延伸5 min,4℃保存,磁珠[AMPure XP]纯化回收PCR 产物,HiSeq XTen 测序仪(Illumina,SanDiego,CA)测序[10]。
1.5 统计学处理 SPSS 22.0 用于数据分析,Hardy-Weinberg 平衡以P>0.05 为群体有代表性。计量资料数据进行正态性检验,符合正态分布的以x±s 表示,两样本数据比较采用t 检验,多样本的组间比较采用方差分析;偏态分布数据以M(P25,P75)表示,比较采用K-W 秩和检验。计数资料以n(%)表示,组间比较采用χ2检验或Fisher确切概率法。Logistic 回归分析用于评估基因多态性与肾脏病理的关系,P<0.05 为差异有统计学意义。
2 结果
2.1 患者资料 AAV 组中男性59 例,女性86 例。男性患者具有更高的白细胞和红细胞水平,女性患者具有更高的免疫球蛋白M 水平(P<0.05),见表1。
表1 AAV 患者的资料[±s,M(P25,P75)]Tab 1 The data of AAV patients[±s,M(P25,P75)]
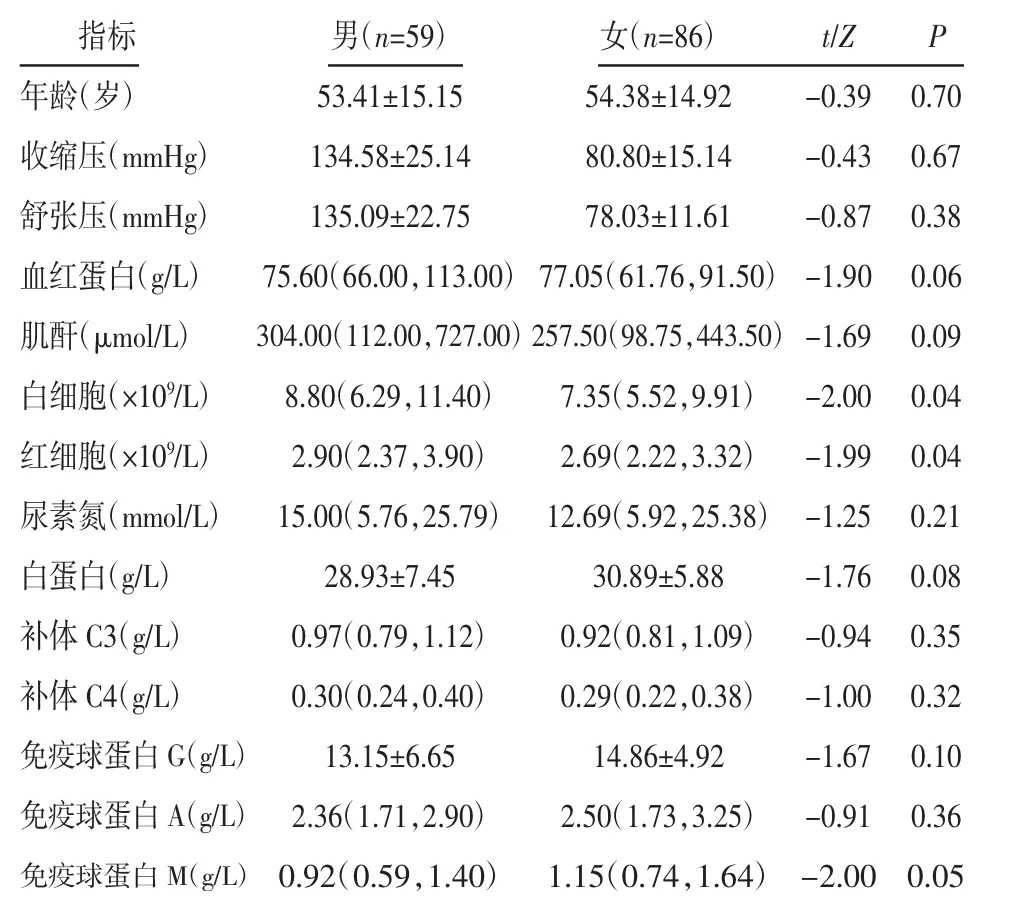
表1 AAV 患者的资料[±s,M(P25,P75)]Tab 1 The data of AAV patients[±s,M(P25,P75)]
注:1 mmHg=0.133 kPa
指标 男(n=59) 女(n=86) t/Z P年龄(岁) 53.41±15.15 54.38±14.92 -0.39 0.70收缩压(mmHg) 134.58±25.14 80.80±15.14 -0.43 0.67舒张压(mmHg) 135.09±22.75 78.03±11.61 -0.87 0.38血红蛋白(g/L) 75.60(66.00,113.00) 77.05(61.76,91.50) -1.90 0.06肌酐(μmol/L) 304.00(112.00,727.00)257.50(98.75,443.50) -1.69 0.09白细胞(×109/L) 8.80(6.29,11.40) 7.35(5.52,9.91) -2.00 0.04红细胞(×109/L) 2.90(2.37,3.90) 2.69(2.22,3.32) -1.99 0.04尿素氮(mmol/L) 15.00(5.76,25.79) 12.69(5.92,25.38) -1.25 0.21白蛋白(g/L) 28.93±7.45 30.89±5.88 -1.76 0.08补体C3(g/L) 0.97(0.79,1.12) 0.92(0.81,1.09) -0.94 0.35补体C4(g/L) 0.30(0.24,0.40) 0.29(0.22,0.38) -1.00 0.32免疫球蛋白G(g/L) 13.15±6.65 14.86±4.92 -1.67 0.10免疫球蛋白A(g/L) 2.36(1.71,2.90) 2.50(1.73,3.25) -0.91 0.36免疫球蛋白M(g/L) 0.92(0.59,1.40) 1.15(0.74,1.64) -2.00 0.05
2.2 AAV 组基因型间实验室指标比较 该位点不同基因型间实验室指标差异均无统计学意义(均P>0.05),表2。
表2 AAV 组基因型间实验室指标比较[±s,M(P25,P75)]Tab 2 Comparison of laboratory indicators between genotypes in patients[±s,M(P25,P75)]

表2 AAV 组基因型间实验室指标比较[±s,M(P25,P75)]Tab 2 Comparison of laboratory indicators between genotypes in patients[±s,M(P25,P75)]
指标 TT F 或χ2 P血红蛋白(g/L) 70.45(59.00,94.40) 4.28 0.12肌酐(μmol/L) 340.00(120.00,586.00) 4.15 0.13白细胞(×109/L) 7.51(5.55,11.09) 0.30 0.86红细胞(×109/L) 2.77(2.16,3.59) 1.76 0.42尿素氮(mmol/L) 17.28(8.24,28.63) 5.72 0.06白蛋白(g/L) 31.14±6.97 0.52 0.60补体C3(g/L) 0.91(0.75,0.98) 5.35 0.06补体C4(g/L) 0.25(0.19,0.31) 4.67 0.10免疫球蛋白G(g/L) 13.28(11.19,16.45) 0.28 0.87免疫球蛋白A(g/L) 2.45(1.46,3.32) 0.02 0.99免疫球蛋白M(g/L) 1.07(0.69,1.38) 0.08 0.96 CT 82.00(66.75,99.70)225.00(92.50,436.00)8.11(5.87,11.03)2.82(2.37,3.65)12.26(5.02,20.53)29.78±7.06 0.99(0.84,1.16)0.31(0.24,0.38)14.57(10.29,16.74)2.46(1.70,3.08)1.13(0.70,1.48)CC 72.00(60.60,101.03)333.00(125.00,625.50)8.00(5.79,10.50)2.63(2.27,3.40)15.06(7.82,24.98)29.83±5.60 0.87(0.75,1.09)0.29(0.23,0.42)13.60(9.47,19.92)2.36(1.92,3.15)1.04(0.64,1.62)
2.3 两组间基因型及等位基因频率分布 对照组(χ2=0.496,P=0.481)、AAV 组(χ2=0.252,P=0.615)均符合Hardy-Weinberg 平衡,两组间基因型、等位基因频率分布无明显差异(P>0.05),见表3。
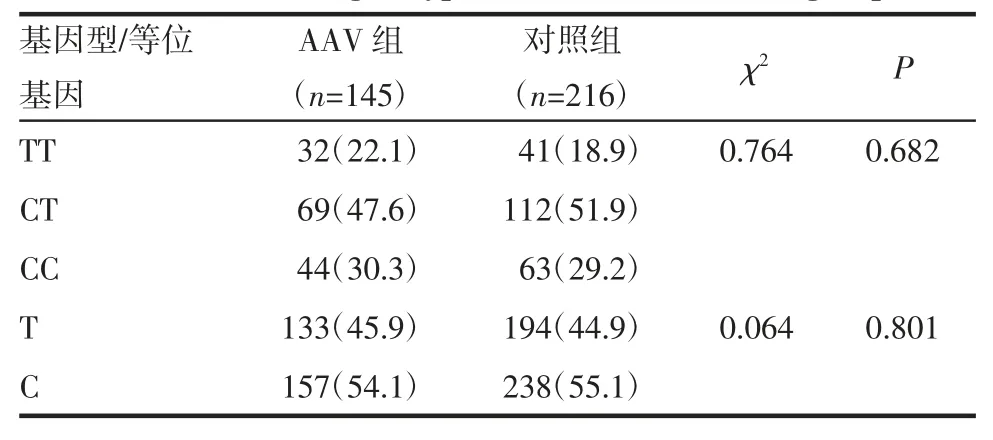
表3 两组间基因型、等位基因分布[n(%)]Tab 3 Distribution of genotype and allele between two groups[n(%)]
2.4 基因多态性与AAV 易感性 经Logistic 回归分析发现,与CC(野生纯和型)对比,TT、CT 基因型与AAV 易感性无关;以等位基因C 为参照,T 与AAV 易感性无关(均P>0.05),见表4。
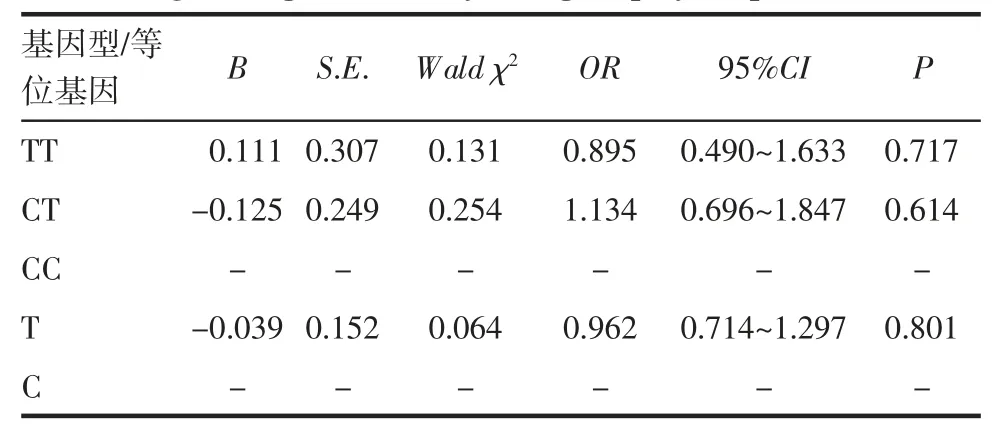
表4 基因多态性与AAV 的Logistic 回归分析Tab 4 Logistic regression analysis of gene polymorphism of AAV
2.5 各病理类型间基因型、等位基因频率分布 基因型在各病理类型间的分布有统计学意义(P=0.001),等位基因在各病理类型间的差异有统计学意义(P=0.003),见表5。
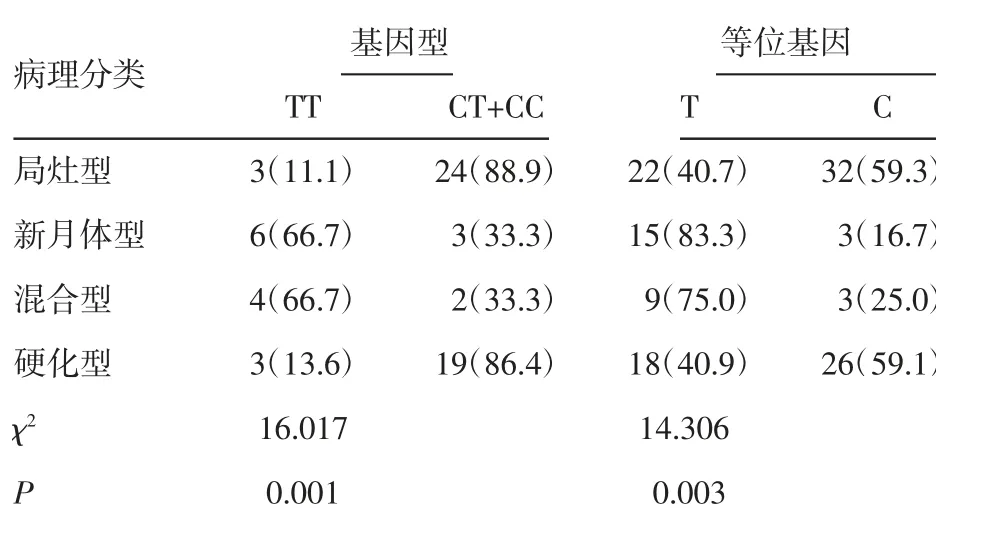
表5 各病理类型间基因型、等位基因频率分布[n(%)]Tab 5 Distribution of genotype and allele frequencies between pathological types[n(%)]
2.6 等位基因与病理类型相关性 以等位基因为自变量,病理类型为因变量做Logistic 回归分析,以C 等位基因为参照,T 为新月体型的危险因素(P=0.004),T 为混合型的危险因素(P=0.041),见表6。
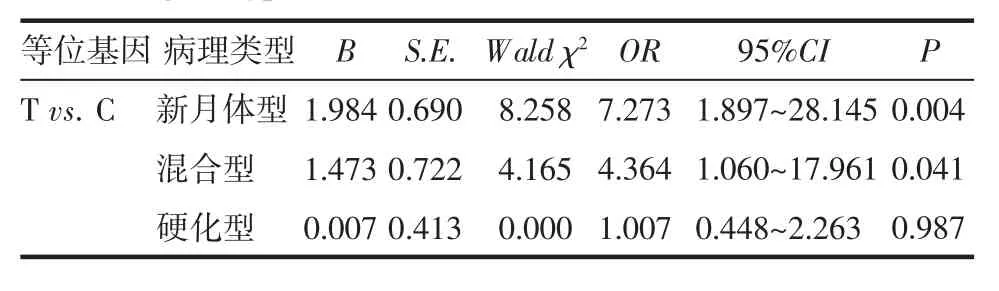
表6 等位基因与病理类型的Logistic 回归分析Tab 6 Logistic regression analysis of allele frequencies and pathological types
2.7 基因型与病理类型相关性 以基因型为自变量,病理类型为因变量做Logistic 回归分析,以CT+CC 基因型为参照,TT 为新月体型的危险因素(P=0.003),TT 为混合型的危险因素(P=0.009),见表7。
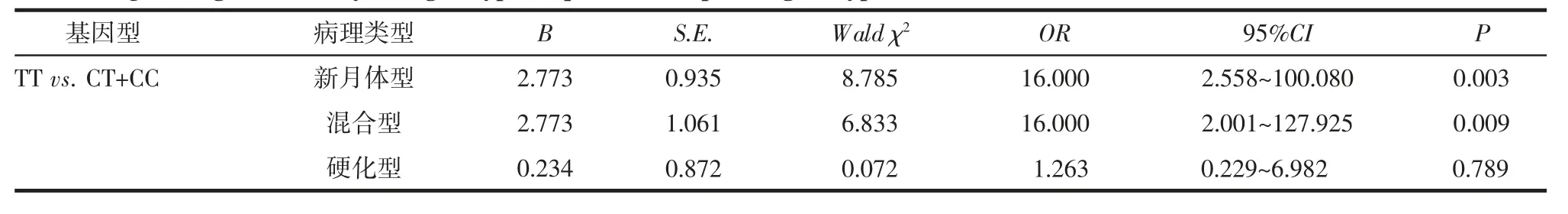
表7 基因型与病理类型的Logistic 回归分析Tab 7 Logistic regression analysis of genotype frequencies and pathological types
3 讨论
STAT4 是STAT 家族中重要一员,在各类炎性过程中均可见其身影,例如病原体反应、细胞因子分泌等[11]。STAT4 定位于细胞质,作为唯一组织限制性表达的STAT,该基因所编码的蛋白被确定为DNA 结合蛋白的主要成分,其mRNA 在单核、淋巴、巨噬细胞中表达[12],参与细胞增殖、分化、凋亡。多种细胞因子与细胞膜结合后使得STAT4 被磷酸化,而后二聚化的STAT4 易位至细胞核,被激活的STAT4 具有炎症作用,参与所有已知的IL-12 的生物学功能,参与自然杀伤细胞、肥大细胞、树突状细胞和T 辅助细胞(Th)的功能调节和分化,导致Th1/Th2 分化率向Th1 侧转移,激活特定的Th1 分化并抑制Th2 反应[13],而Th1 细胞功能失调可诱导多种自身免疫性疾病,其主要表达于炎症部位的免疫调节细胞中[14],由此推测,STAT4 在AAV 发生、发展中扮演重要的角色。
本研究虽然未发现STAT4 rs3024877 基因多态性与AAV 易感性相关,但与其他自身免疫性疾病发病的相关研究已开展。有学者研究发现,STAT4 rs3024877 基因多态性与中国女性患者系统性红斑狼疮(SLE)易感性显著相关[15]。随着深入研究发现,STAT4 基因第14 内含子至第17 外显子区域(包含rs3024866、rs3024877、rs3024886)具有与SLE 发病风险较高的关联性[16]。在东西方人群中,对比研究人类基因组单倍型图(haplotype map,Hapmap),提示STAT4 基因位点单核苷酸多态性分布频率及不同基因间的连锁呈现出明显地域差异,我国北京汉族人群(CHB)的SLE 风险SNPs 频率相较于欧裔(CEU)呈明显增多的趋势,如rs3024877 中,CEU 为33.1%,CHB 为44.4%[17]。截然不同的是,我国台湾人群特发性膜性肾病(IMN)中,STAT4 rs3024877 并未发现与疾病易感性相关,而STAT4 rs3024908 的基因型分布在AAV 组及对照组间有差异,且AA 基因型是疾病的风险因素[18]。
AAV 肾损害较为常见,据既往病理学研究发现,中性粒细胞胞外陷阱大量附着于AAV 患者的肾小球及间质中,可反向参与ANCA 的产生,与组蛋白DNA、中性粒细胞颗粒蛋白等结合,介导靶器官的血管损伤,相较于其他脏器,肾脏自身可分泌炎症因子、肿瘤坏死因子等,这些物质或为肾脏受损易感性的病理基础,导致肾脏损害具有特殊性[19]。免疫荧光显微镜下以少免疫复合物沉积为特征,光镜下多见坏死及新月体肾小球肾炎[20],患者常常表现为血尿(包括肉眼血尿)、蛋白尿甚至导致不可逆的肾功能衰竭。局灶型预后相对较好,新月体型常常呈现为肾功能急进性下降,但积极治疗后肾功能可恢复,混合型病情进展一般介于上述两者之间,而硬化型预后最差,进展为终末期几率较前述3 种类型大,确诊后第一年内死亡的风险也更高。本研究发现,位点基因型及等位基因在4 种不同病理类型间分布差异有统计学意义,相关性分析发现,相较于等位基因C,突变等位基因T 为新月体型、混合型的危险因素,并未发现与硬化型存在明显关联。隐性模型下,突变纯合基因型TT 为新月体型、混合型的危险因素。上述结果提示,或许基因多态性会影响血管炎发生发展过程,进而在肾活检中表现为不同的病理类型,患者临床表现复杂多样,针对个体化治疗有较大获益,这也为临床治疗提供了新的思路。
基于上述,中国人群中STAT4 rs3024877 基因多态性与AAV 易感性无关,与肾损害相关病理类型存在关联,对于临床治疗有一定的指导意义,但由于本实验样本量较小,后续需扩大样本量以进行更深入的研究。鉴于STAT4 在炎症和自身免疫中的不可或缺性,该基因其他位点或许有望成为AAV的有效治疗靶点,期待更多学者扩大研究人群及样本量,来阐明发病关键因子,提高AAV 诊治水平。
