铜(II)-多酚纳米复合物对水培营养液中藻类生长的抑制
2023-05-11王明耀王晓玲杨其长郭俊凌
王明耀 杨 晓 黄 涛 王晓玲,3,4* 杨其长 郭俊凌,3,4*
(1.四川大学 生物质与皮革工程系,成都 610065;2.中国农业科学院 都市农业研究所/成都国家农业科技中心,成都 610213;3.四川大学 制革清洁技术国家工程实验室,成都 610065;4.四川大学 皮革化学与工程教育部重点实验室,成都 610065)
水培技术目前广泛应用于园艺或粮食作物生产的植物工厂中。该技术能够减少病虫害,实现连续种植,一年多产,而且能够适用于水资源有限和土壤退化的地区,所以水培技术已经发展成为能够促进可持续农业发展的重要技术之一[1]。然而,水培生产是在一种开放式环境中培养农作物,而且培养所用营养液含有丰富的营养元素,从而便于藻类滋生,并在营养液中爆发式生长。藻类爆发式的生长会消耗水培营养液中的营养成分,减少营养液中的溶解氧,释放有毒代谢物,降低水质,并增加了植物病虫害入侵的风险[2]。迄今,已有许多方法被证明能抑制藻类生长,如人工打捞、使用铝絮凝、使用铜基除藻剂等[2-3]。其中,铜基除藻剂(如硫酸铜),能够破坏藻细胞的光合系统,造成氧化还原失衡,严重影响藻细胞内酶的活性以及藻细胞的呼吸作用,最终导致藻细胞死亡[4]。但是,直接使用这类铜基除藻剂会造成严重的二次环境污染,使得这种方法难以在粮食作物生产中广泛应用[2-3,5]。所以迫切需要就新一代的抑藻剂展开研究,探讨既能够保留铜的高效抑藻能力,又能兼顾环境安全性和生物安全性的策略。
纳米定向缓释技术是一种以纳米材料为载体的物质精确递送策略,可以实现农药和营养物质的精确递送和在较长时间内的缓慢释放,可极大地提高营养物质的递送和农药的利用效率,同时减少环境损害,减少投入成本,提高产量[6-9]。然而,这种纳米定向缓释技术通常需要合成纳米材料作为农药的载体[10],例如二氧化硅纳米颗粒[11]、有机聚合物[12]、碳纳米管[13]、粘土纳米片[14]和病毒颗粒[8]。而且,这些纳米材料的合成工艺复杂且耗时、运载的药剂被无限制的释放以及纳米载体的合成过程均会造成二次环境污染[10]。
已有研究表明天然植物多酚是一种绿色生物质材料,其酚羟基能够与金属离子配位(如Fe3+或Cu2+等),可被进一步自组装形成功能性金属-多酚纳米膜和纳米复合物[15-16]。而且,由于生物相容性和模块化自组装特性[17-20],金属-多酚自组装纳米膜和纳米复合物已经在生物技术[21-24]和生物医学[25-26]的应用中已得到了极大的探索。Li等[27-28]将功能性稀土钐离子(Sm3+)分别与表没食子儿茶素没食子酸酯和表儿茶素配位形成纳米复合物,并成功用于治疗转移性黑色素瘤和结肠癌。此外,水培生菜是一种世界范围内食用的沙拉蔬菜,也是一种在植物工厂中广泛种植的绿叶蔬菜。因此,本研究拟以水培生菜为研究对象,将功能性铜离子(Cu2+离子)与不同的植物多酚,包括杨梅单宁(Bayberry tannin,BT)、橡椀单宁(Valonia tannin,VT)、塔拉单宁(Tara tannin,Tr)、单宁酸(Tannin acid,TA),自组装成为铜(II)-多酚纳米抑藻材料,评估本研究自组装铜(II)-多酚纳米抑藻材料对生菜水培过程中各种藻类的抑制作用,以期为一种绿色和可持续的水培作物生产中的藻类生长抑制提供依据。
1 材料与方法
1.1 试验材料
普通小球藻(Chlorellavulgaris)购自四川杜瑞特科技有限公司;杨梅单宁(Bayberry tannin,BT),橡椀单宁(Valonia tannin,VT),塔拉单宁(Tara tannin,Tr)购自广西百色天星植物科技有限公司。单宁酸(Tannin acid,TA)购自Sigma-Aldrich。丙酮、戊二醛、碳酸盐缓冲液、磷酸盐缓冲液、柠檬酸铁铵、CuSO4、EDTA·2Na、NaNO3、K2HPO4、MgSO4·7H2O、CaCl2·2H2O、Na2CO3、Na2EDTA·2H2O、H3BO3、FeCl3·6H2O、MnCl2·4H2O、ZnSO4·7H2O、Na2MnO4·2H2O、CuSO4·5H2O、Co(NO3)2·6H2O、异硫氰酸荧光素(Fluorescein isothiocyanate isomer,FITC)购自上海泰坦科技股份有限公司。超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒、BCA蛋白浓度测定试剂盒和牛血清白蛋白(Bovine serum albumin,BSA)均购自碧云天生物技术有限公司。
1.2 铜(II)-多酚纳米复合物的制备及表征
在室温下,取4 mL不同植物多酚(BT、VT、Tr、TA)溶液(8、16、32、64 mg/mL)分别和4 mL金属盐(CuSO4)溶液(2、4、8、16 mg/mL)混合于去离子水中(16 mL),再加入16 mL柠檬酸盐缓冲液(0.1 mol/L,pH 7.4),静置过夜。然后,离心(10 000 r/min,10 min),分离沉淀物,并重悬于去离子水(40 mL)中,得到铜(II)-多酚纳米复合物悬浮液,即CuII-BT、CuII-VT、CuII-Tr和CuII-TA纳米复合物悬浮液,每一种纳米复合物悬浮液的质量浓度均为1、2、4、8 mg/mL。随后,采用场发射扫描电子显微镜(FESEM,Helios G4 UC,Thermo Fisher Scientific,USA)、傅立叶变化近红外光谱(FT-IR,IS10,Thermo Nicolet,USA)、动态光散射光谱仪(DLS,Zetasizer nano zsp,Malvern,UK)、电感耦合等离子体原子发射光谱仪(ICP-AES,Optima 8000,PerkinElmer,USA)等手段表征铜(II)-多酚纳米复合物的形貌、结构、粒径和铜含量等。
1.3 铜(II)-多酚纳米复合物的抑藻性能分析
以普通小球藻(C.vulgaris)为试验模型。将不同浓度的铜(II)-多酚纳米复合物(CuII-BT、CuII-VT、CuII-Tr、CuII-TA)悬浮液(1 mL)加入BG11营养液(24 mL)中,再加入C.vulgaris(初始数量约为1×106个/mL)作为试验组。在不含有铜(II)-多酚纳米复合物的BG11营养液(25 mL)中加入C.vulgaris(初始数量约为1×106个/mL)作为对照组(表1)。然后分别放置于植物培养箱中培养7 d,设置植物培养箱温度为25 ℃,光照强度为4 000 LUX,光暗比为12 h/12 h。在培养过程中,连续监测试验组和对照组中C.vulgaris细胞生长数量的变化,绘制C.vulgaris的生长曲线。每组设置3个平行试验组。
藻细胞数量和藻细胞总体荧光强度呈线性关系,可通过测量营养液中藻细胞的荧光强度来计算。即,先将不同浓度梯度的C.vulgaris细胞在显微镜下用血球计数板计数,然后再将不同浓度梯度的C.vulgaris细胞用酶标仪(Tecan infinite 200,Tecan,Switzerland)测量荧光强度,激发波长:410 nm,发射波长:650~700 nm。最后根据藻细胞数量和藻细胞荧光强度建立线性的标准曲线。根据标准曲线计算C.vulgaris细胞在培养期的生长数量。
1.4 C.vulgaris形态观察
将试验组和对照组培养3 d后,通过FESEM和透射电子显微镜(TEM,HT7700,Hitachi,Japan)观察C.vulgaris的形态结构。即,在培养C.vulgaris3 d后,分别取试验组和对照组的培养液(20 mL),离心(10 000 r/min,3 min)后收集沉淀,用2.5%的戊二醛在4 ℃下固定过夜。然后用磷酸盐缓冲液(0.1 mol/L,pH 7.2)洗涤3次,再用30%、50%、60%、70%、80%、90%、95%和100%的乙醇进行梯度脱水,最后采用FESEM观察C.vulgaris形态。
将收集的藻细胞置于戊二醛溶液(2.5%)中,在4 ℃条件下固定过夜。倒掉固定液,用磷酸盐缓冲液(0.1 M,pH 7.2)洗涤3次,每次15 min。然后用锇酸溶液(1%)固定样品1~2 h。吸取锇酸废液,用磷酸盐缓冲液(0.1 mol/L,pH 7.2)再次洗涤样品3次,每次15 min。随后用梯度浓度的(30%、50%、70%、80%、90%和95%)乙醇溶液进行脱水处理,每种浓度处理15 min,再用100%的乙醇处理20 min,最后用丙酮处理20 min。将固定好的藻细胞用Spurr包埋剂包埋,用超薄切片机(LEICA EM UC7)切片。切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5 ~ 10 min。最后使用TEM观察藻细胞形态。
将牛血清白蛋白(Bovine serum albumin,BSA)溶解在生理盐水(27 mL)和碳酸盐缓冲液(3 mL,0.1 mol/L,pH 9.0)中,质量浓度为10 mg/mL。将异硫氰酸荧光素(Fluorescein isothiocyanate isomer,FITC)溶解在碳酸盐缓冲液(1 mL,0.1 mol/L,pH 9.0)中,质量浓度为0.1 mg/mL。然后,将FITC溶液添加到BSA溶液中,并在4 ℃下搅拌混合12 h。通过离心(2 500 r/min,10 min)获得上清液,再用分子量为500的透析袋透析3 d,去除游离异硫氰酸荧光素,即获得FITC-BSA。最后,将FITC-BSA加入CuII-BT悬浮液(1 mg/mL,10 mL)中,于4 ℃下搅拌24 h。通过离心(10 000 r/min,10 min)得到异硫氰酸荧光素-牛血清白蛋白标记的CuII-BT(Fluorescein isothiocyanate isome-Bovine serum albumin-CuII-BT,FITC-BSA-CuII-BT)沉淀,并重新悬浮于去离子水中,质量浓度为1 mg/mL。将FITC-BSA-CuII-BT悬浮液(1 mL)加入含有C.vulgaris(数量约为1×106个/mL)的BG11营养液中(24 mL)作为试验组。在不含有FITC-BSA-CuII-BT的BG11营养液(25 mL)中加入C.vulgaris(初始数量约为1×106个/mL)作为对照组。然后放置于植物培养箱中培养3 d(温度为25 ℃,无光照)。3 d后,取10 mL营养液,离心(10 000 r/min,3 min)后用去离子水连续洗涤3次,最终得到C.vulgaris细胞。将得到C.vulgaris细胞重悬于去离子水中(10 mL),并采用LCFM观察C.vulgaris细胞形态,激发波长:488和405 nm,发射波长:525和650~700 nm。
1.5 C.vulgaris细胞内铜含量、SOD活性和MDA含量分析
将CuII-BT悬浮液(1 mL,1 mg/mL)加入含有C.vulgaris(数量约为1×106个/mL)的BG11培养液中(24 mL)作为试验组。在不含有CuII-BT的BG11营养液(25 mL)中加入C.vulgaris(初始数量约为1×106个/mL)作为对照组(表1)。然后放置于植物培养箱中培养3 d(温度为25 ℃,光照强度为4 000 LUX,光暗比为12/12 h)。培养3 d后,分别取20 mL对照组和试验组营养液,离心(10 000 r/min,3 min)后得到C.vulgaris细胞,冰浴待用。取藻细胞使用EDTA·2 Na(0.1 M)洗涤3次,去除黏附在C.vulgaris表面的CuII-BT,得到C.vulgari细胞。最后,将C.vulgaris细胞经过硝酸和双氧水(V(硝酸)∶V(双氧水)=5∶2)消解、过滤(0.22 μm的水相滤膜)以及定容后,采用ICP-AES检测铜含量。用液氮反复冻融[29],对C.vulgari细胞进行破碎,随即采用SOD和MDA检测试剂盒测定SOD活性和MDA含量,同时采用BCA蛋白浓度测定试剂盒测定蛋白含量。
1.6 铜(II)-多酚纳米复合物在水培生产中的抑藻性能及其对植物的影响
将CuII-BT悬浮液(4 mg/mL)和CuSO4溶液(0.37 mg/mL)分别加入到Hoagland营养液中,分别得到含有CuII-BT和CuSO4的Hoagland营养液,质量浓度分别为160.0和14.7 μg/mL。利用含有CuII-BT和CuSO4的Hoagland营养液培养生菜幼苗(种子萌发15 d后的幼苗,中国农业科学院都市农业研究所成都国家农业科技中心提供)。同时,设计对照组为直接采用Hoagland营养液培养生菜幼苗(表1)。设置培养箱温度为22 ℃,光照强度为8 000 LUX,光暗比为12/12 h。在7 和15 d分别取营养液,使用显微镜在血球计数板中统计藻细胞数量。经过上述培养15 d后,分别取试验组和对照组的生菜叶,用硝酸和双氧水(V(硝酸)∶V(双氧水)=5∶2)消解、过滤(0.22 μm的水相滤膜)以及定容,采用ICP-AES检测铜含量。

表1 各试验分析对照组和处理组的分组设置Table 1 Grouping setting of each test analysis control group and treatment group
2 结果与分析
2.1 铜(II)-多酚纳米复合物的结构表征
制备铜(II)-多酚纳米复合物的具体步骤见图1。具体步骤如下:在室温下,取不同植物多酚(BT、VT、Tr、TA)分别和金属盐(CuSO4)溶解于去离子水中,再加入pH 7.4 的柠檬酸盐缓冲液,静置过夜。然后,离心分离沉淀物并重悬于去离子水中,形成铜(II)-多酚纳米复合物悬浮液,即CuII-BT、CuII-VT、CuII-Tr和CuII-TA。利用X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)解释铜(II)-多酚纳米复合物中多酚与铜离子的相互作用机理。O 1 s分谱图显示不同多酚具有C-O和C=O信号峰,当多酚和铜离子络合后,由于电子云密度增加,结合能降低,致使C-O信号峰会出现偏移。其中,杨梅单宁(BT)的C-O信号峰为533.21 eV,当铜离子与杨梅单宁配位后,CuII-BT的C-O信号峰结合能降低至532.77 eV。同样地,单宁酸(TA)与铜离子配位后,C-O信号峰结合能降低至533.16 eV。橡椀单宁(VT)与铜离子配位后,C-O信号峰结合能降低至532.87 eV。塔拉单宁(Tr)与铜离子配位后,CuII-Tr的C-O信号峰结合能降低至532.69 eV。
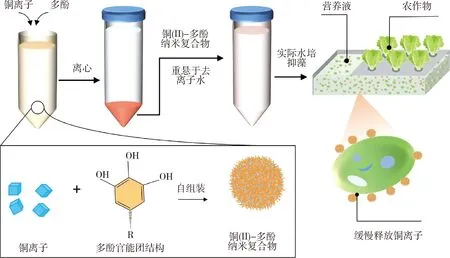
图1 铜(II)-多酚纳米复合物的制备及抑藻策略Fig.1 Preparation of copper(II)-phenolic nanocomplexes and algal inhibition strategies
多酚(BT、TA、Tr、VT)和铜(II)-多酚纳米复合物(CuII-BT、CuII-VT、CuII-Tr、CuII-TA)的傅立叶变换近红外光谱(Fourier transform infrared spectrometer,FT-IR)如图2(a)~(d)所示。在1 621~1 455 cm-1处的吸收峰和1 313 cm-1处的吸收峰分别对应于多酚苯环的拉伸震动吸收峰和-OH基团的弯曲振动吸收峰。当与铜离子配位后,铜(II)-多酚纳米复合物(CuII-BT、CuII-VT、CuII-Tr、CuII-TA)的苯环拉伸震动吸收峰强度和-OH基团的弯曲振动吸收峰强度都降低。综上所述,多酚酚羟基与铜离子配位形成了铜(II)-多酚纳米复合物。
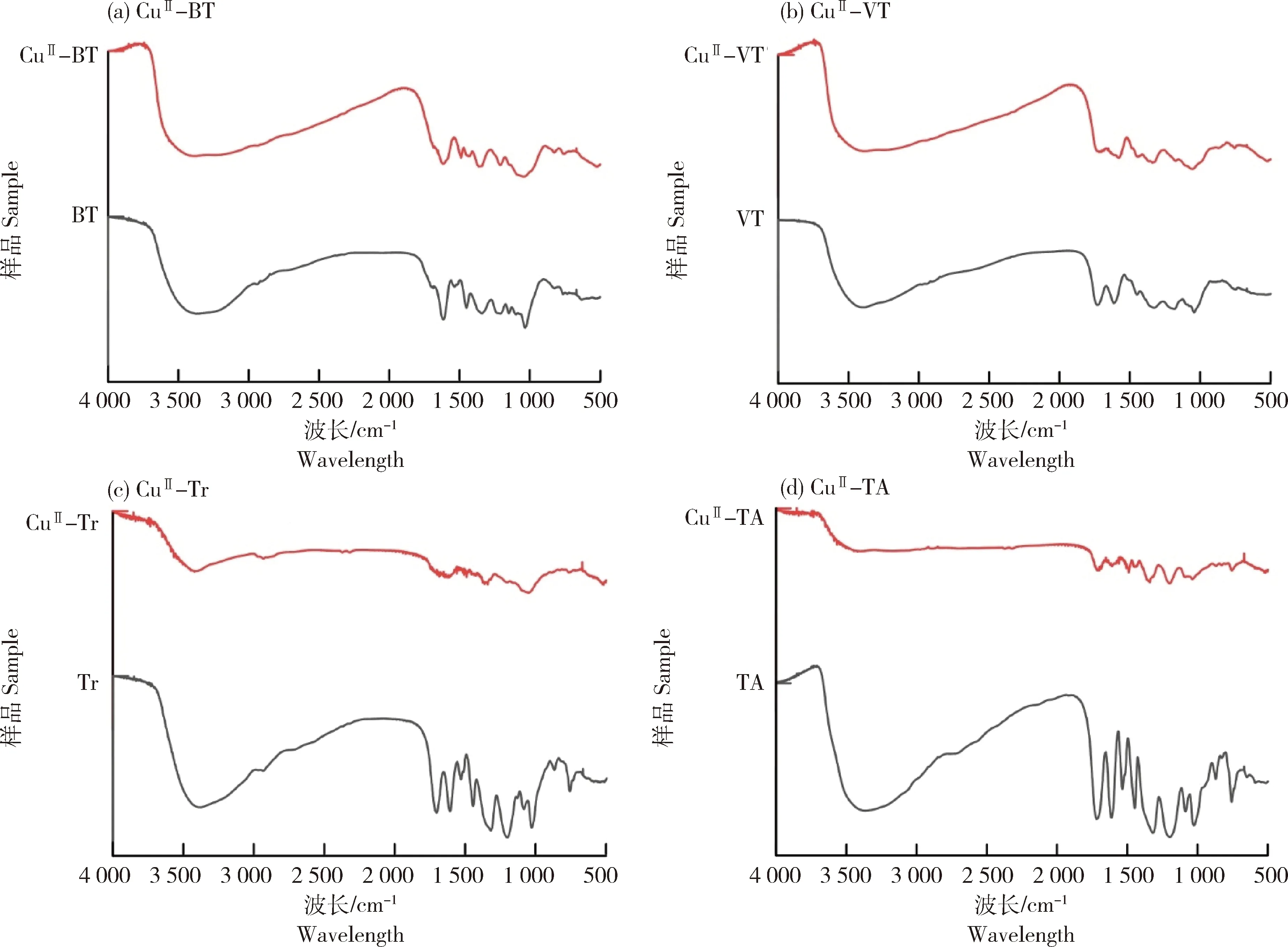
图2 不同多酚和铜(II)-多酚纳米复合的FT-IR光谱Fig.2 FT-IR Spectra of different polyphenol and copper(II)-phenolic nanocomplexes
采用激光纳米粒度仪(Dynamic light scattering measurements,DLS)及Zeta电位仪测量铜(II)-多酚纳米复合物(CuII-BT、CuII-VT、CuII-Tr、CuII-TA)在水溶液中的粒径大小及稳定性,结果见图3。由图可知,CuII-BT、CuII-VT、CuII-Tr和CuII-TA的粒径分别约为85、86、64和30 nm(图3(a)~(d))。在pH 7.1条件下,CuII-BT、CuII-VT、CuII-Tr和CuII-TA 的Zeta电位均为负值,分别为-44.2、-41.5、-41.1和-43.6 mV。由此可知,铜(II)-多酚纳米复合物(CuII-BT、CuII-VT、CuII-Tr、CuII-TA)能够形成稳定的悬浮液。
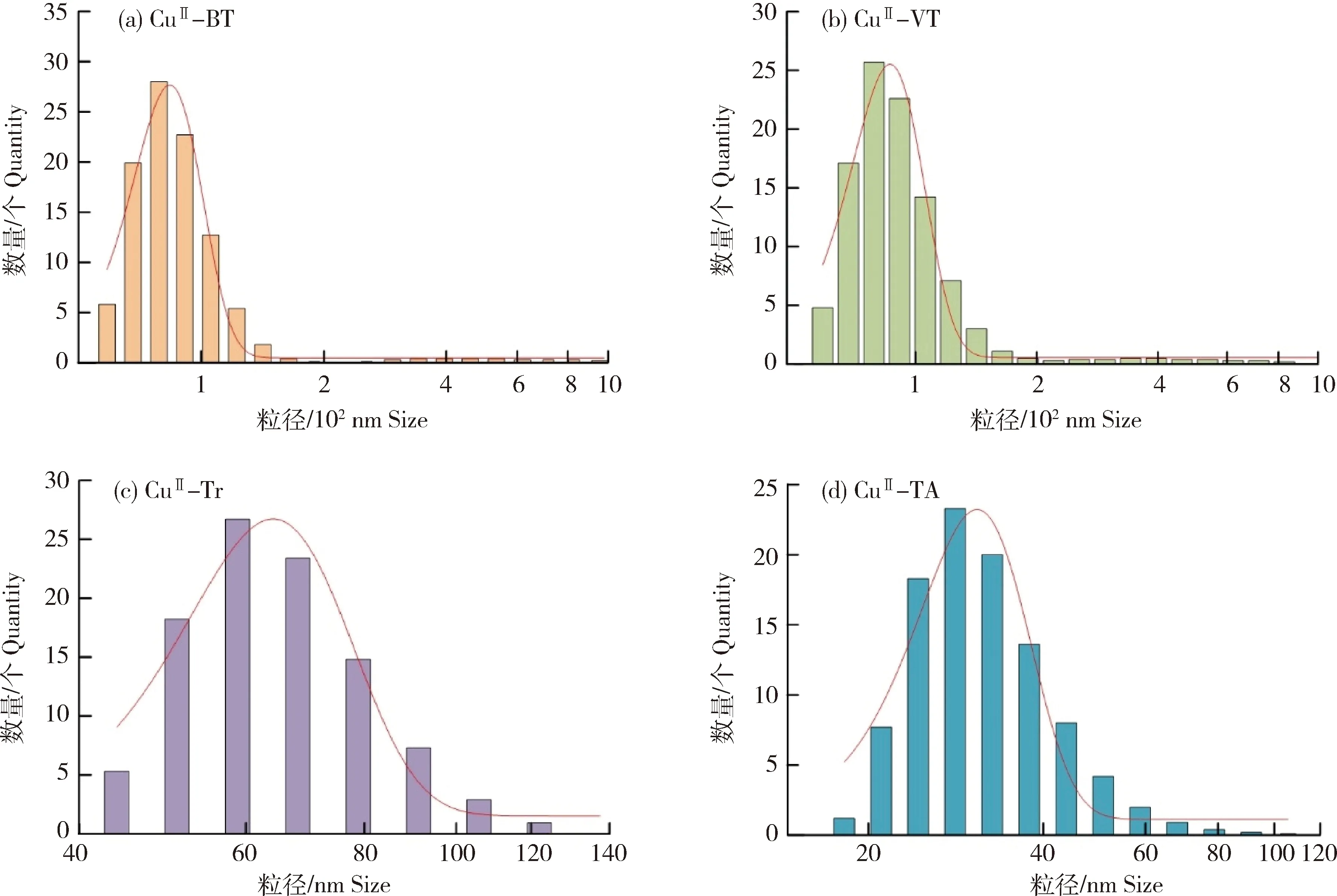
图3 不同铜(II)-多酚纳米复合物粒径分布Fig.3 Size distribution of different copper(II)-phenolic nanocomplexes
图4为铜(II)-多酚纳米复合物(CuII-BT、CuII-VT、CuII-Tr、CuII-TA)稳定悬浮液中铜离子含量。由图可知,在质量浓度为40 μg/mL时,CuII-BT、CuII-VT、CuII-Tr、CuII-TA中铜离子含量分别为0.66、1.35、0.20和3.02 μg/mL。随着CuII-BT、CuII-VT、CuII-Tr、CuII-TA浓度增大,铜离子含量增大。其中,同样浓度的铜(II)-多酚纳米复合物悬浮液中,缩合类多酚(BT、VT)形成的CuII-BT、CuII-VT悬浮液中铜离子含量大于水解类多酚(Tr、TA)形成的CuII-Tr、CuII-TA悬浮液,表明不同多酚与铜离子的络合能力不同。
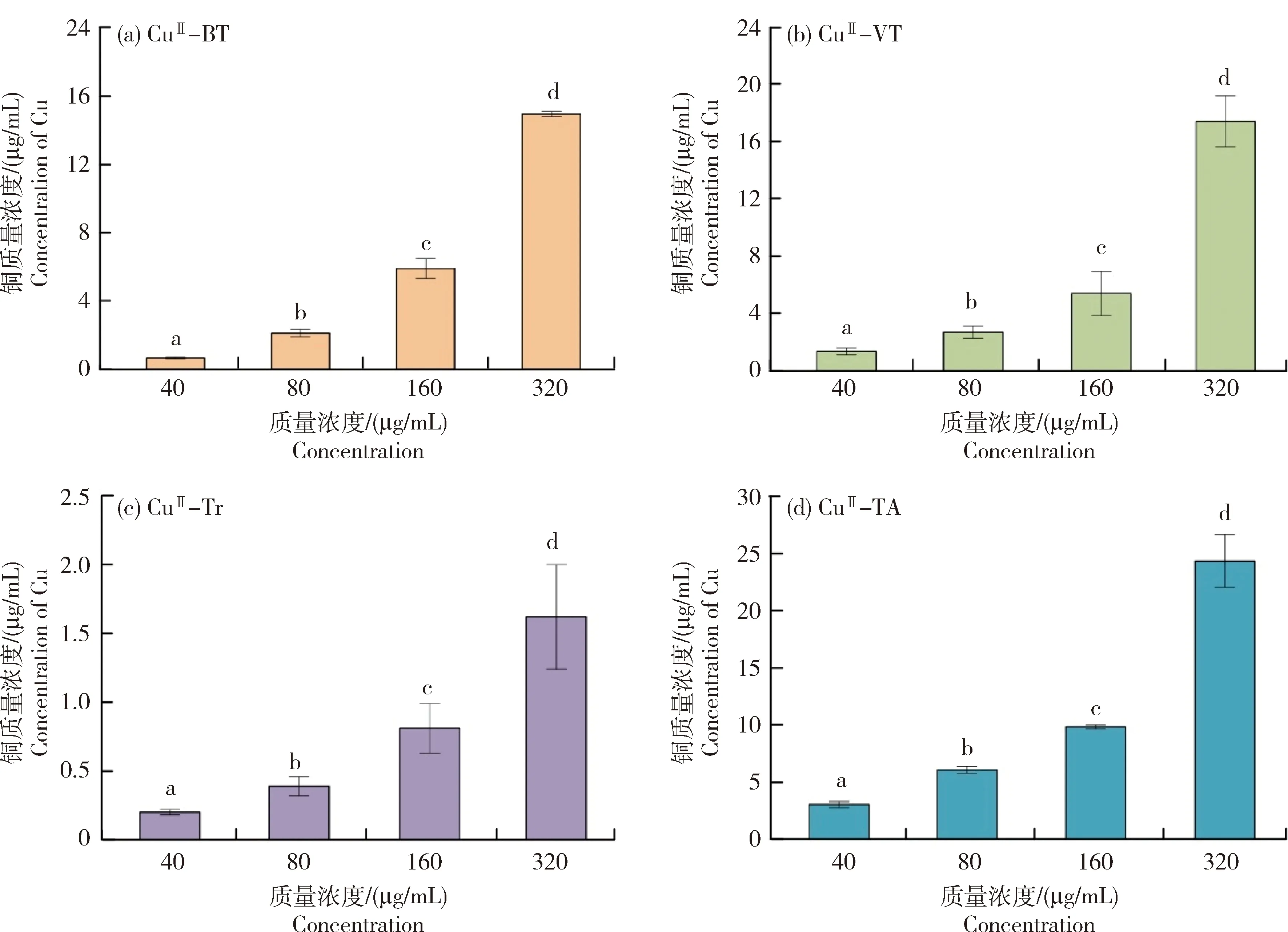
柱形图上方不同字母标记表示显著差异性,(P<0.05)。下同。Different letters above columns represent significant differences at P<0.05. The same below.图4 不同铜(II)-多酚纳米复合物的铜含量Fig.4 Concentration of Cu contained by different copper (II)-phenolic nanocomplexes
2.2 铜(II)-多酚纳米复合物的抑藻机理
利用FESEM观察C.vulgaris细胞的形貌结构,结果见图5(a)。由图可知,对照组C.vulgaris细胞的表面光滑、无颗粒物。试验组的C.vulgaris表面黏附有大量的CuII-BT纳米颗粒(红色箭头处),并且C.vulgaris细胞发生变形和塌陷。利用透射电子显微镜(Transmission electron microscope,TEM)观察的结果同样表明,相比于对照组完整的C.vulgaris细胞,经过含有CuII-BT的培养液培养的C.vulgaris细胞出现严重的变形(图5(b))。
此外,采用FITC-BSA-CuII-BT(40 μg/mL)处理C.vulgaris72 h,用激光共聚焦显微镜(Laser-scanning confocal fluorescence microscopy imaging,LCFM)观察C.vulgaris细胞形貌,结果如图5(c)所示。由于含有叶绿素,C.vulgaris细胞自身散发出红色荧光[30],同时,C.vulgaris细胞表面能够观测到FITC-BSA-CuII-BT散发的绿色荧光,表明CuII-BT能够黏附于C.vulgaris细胞表面,为精确递送铜离子至藻细胞内部提供基础。此外,经过CuII-BT处理的C.vulgaris细胞内部铜含量(0.059 μg/mL)显著高于对照组细胞(0.013 μg/mL),说明CuII-BT黏附在藻细胞表面并定向释放大量的铜离子至藻细胞内部。
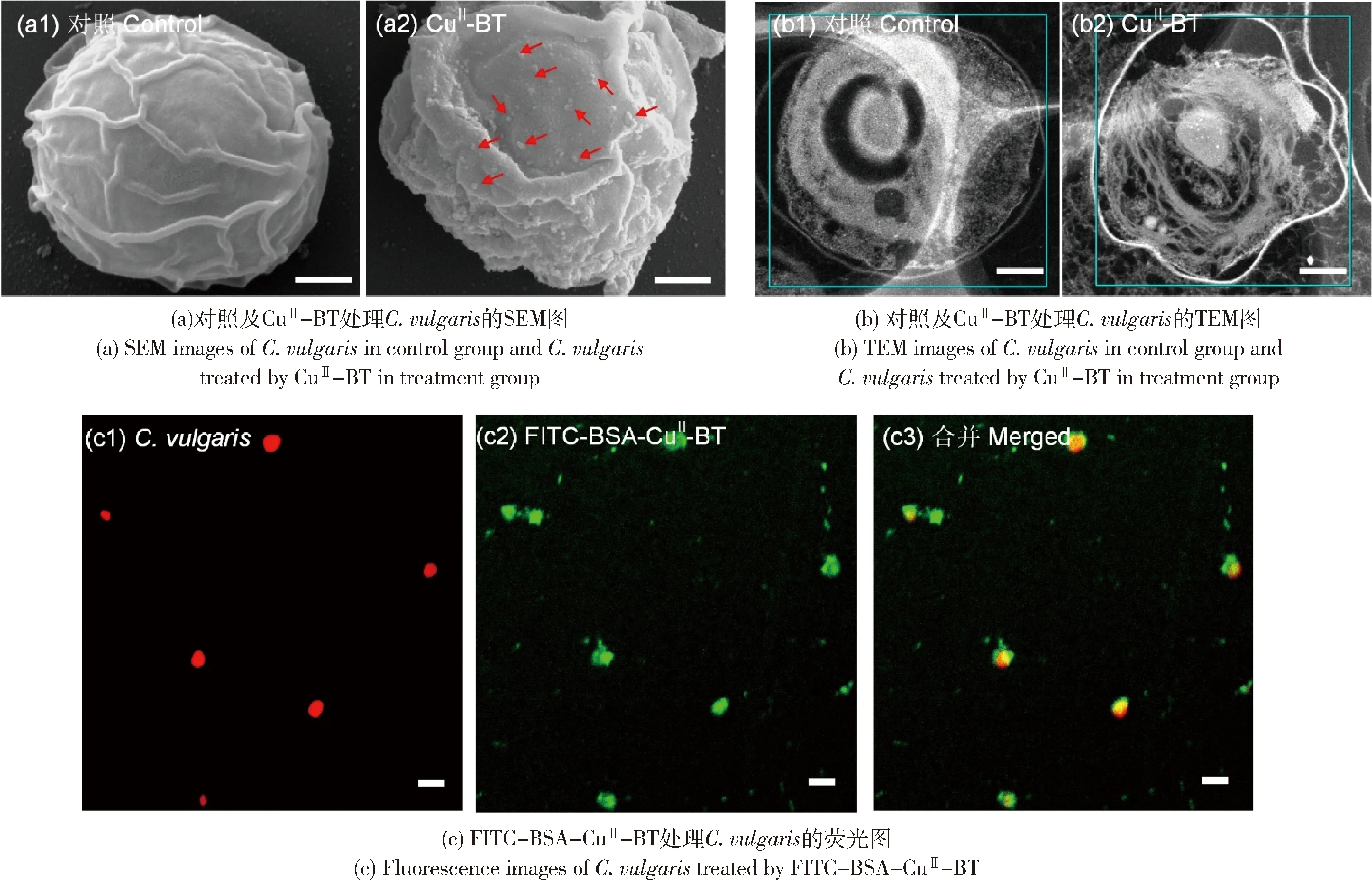
图5 CuII-BT处理组以及对照组中C.vulgaris的SEM、TEM图和FITC-BSA-CuII-BT处理C.vulgaris的荧光图Fig.5 SEM and TEM images of C.vulgaris in control group and CuII-BT treatment group and fluorescence images of C.vulgaris treated by FITC-BSA-CuII-BT
当铜离子进入藻细胞内部后,铜离子将引起藻细胞的非生物胁迫,藻细胞会产生大量的超氧化物歧化酶(Superoxide dismutase,SOD)以应对胁迫,所以此时检测藻细胞内部SOD活性则可以评估藻类对氧化应激的耐受性[29,31-32]。当细胞无法承受氧化应激产生的胁迫时,细胞会发生氧化损伤,膜酯过氧化并分解产生丙二醛(Malondialdehyde,MDA),所以MDA是细胞氧化损伤的重要标志物[32]。如图6(a)所示,经过CuII-BT处理C.vulgaris3 d后,细胞内部SOD活性(0.035 0 U/mg 蛋白)显著高于对照组(0.001 6 U/mg蛋白),说明C.vulgaris细胞正在遭受铜离子带来的巨大的非生物胁迫。图6(b)表明经过CuII-BT处理C.vulgaris3 d后,细胞的MDA含量也显著增大至0.033 1 nmol/mg 蛋白,远远大于对照组(0.006 8 nmol/mg 蛋白),说明此时铜离子引起的胁迫反应极强,C.vulgaris细胞膜遭受严重的氧化作用,进而产生更多的MDA。由此可知,多酚的多重作用力[20]促使CuII-BT黏附于藻细胞表面并向藻细胞内部定向释放铜离子,从而引起藻细胞严重的氧化损伤,破坏其正常的生理功能,最终造成藻细胞的死亡。
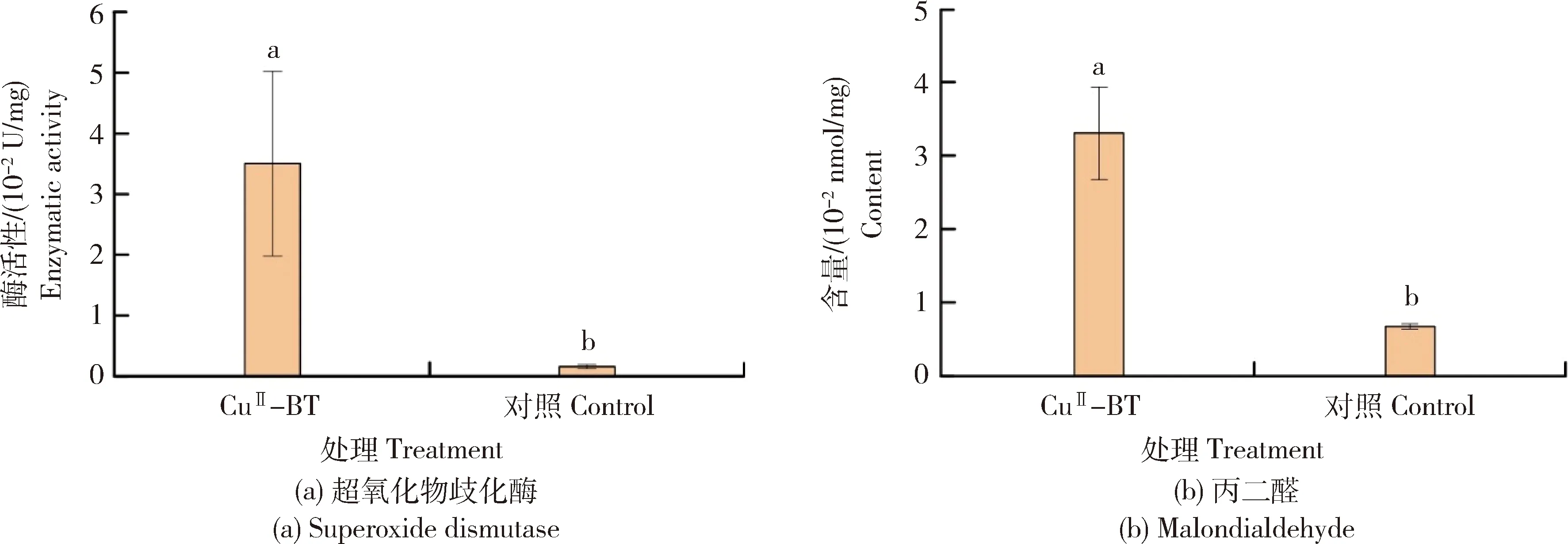
图6 对照和CuII-BT处理后C.vulgaris产生的超氧化物歧化酶活性(a)和丙二醛含量(b)变化Fig.6 Superoxide dismutase activity (a) and malondialdehyde content (b) of C. vulgaris for control group and CuII-BT treatment group
2.3 铜(II)-多酚纳米复合物的抑藻性能
以C.vulgaris为试验模型,用不同的铜(II)-多酚纳米复合物(CuII-BT、CuII-VT、CuII-Tr、CuII-TA)分别处理C.vulgaris,连续7 d监测处理组和对照组中C.vulgaris细胞生长数量的变化,绘制C.vulgaris的生长曲线,如图7所示。由图7(a)可知,当营养液中CuII-BT的质量浓度为40和80 μg/mL时,C.vulgaris细胞数从3 d开始维持不变,说明C.vulgaris的生长受到巨大非生物胁迫,从而C.vulgaris的正常生长被抑制。当CuII-BT的质量浓度进一步增大至160和320 μg/mL,C.vulgaris细胞个数急剧减少,表明随着CuII-BT浓度增大,C.vulgaris细胞的生长不仅能够被完全抑制,并且由于细胞膜遭受严重的氧化作用从而出现凋亡。在7 d时,C.vulgaris完全凋亡,此时CuII-BT对C.vulgaris的抑制率 >99%。由此可知,CuII-BT对C.vulgaris具有高效的抑制作用。
图7(b)是CuII-VT处理C.vulgaris的生长曲线。由图可知,随着CuII-VT质量浓度从40 μg/mL增大至320 μg/mL时,在7 d后的营养液中C.vulgaris细胞个数急剧较少至7.17×105个/mL,此时,CuII-VT 对C.vulgaris的生长抑制率达到了94%。同样说明随着CuII-VT浓度增大,C.vulgaris细胞生长不仅能够被完全抑制,且由于细胞膜遭受严重的氧化作用从而出现凋亡,表明CuII-VT可以抑制C.vulgaris在水培营养液中的生长,且能够消除藻类污染。
图7(c)展示了铜离子与Tr形成的CuII-Tr纳米复合物处理培养C.vulgaris的生长曲线。随着培养时间的延长,当CuII-Tr的质量浓度达到了320 μg/mL时,C.vulgaris细胞个数减少,说明此时的C.vulgaris生长受到抑制,且在7 d时,CuII-Tr对C.vulgaris的抑制率为32%。与CuII-Tr相比,CuII-TA对C.vulgaris生长抑制能力增强(图7(d)),在浓度为320 μg/mL时,7 d时的抑制率为63%。
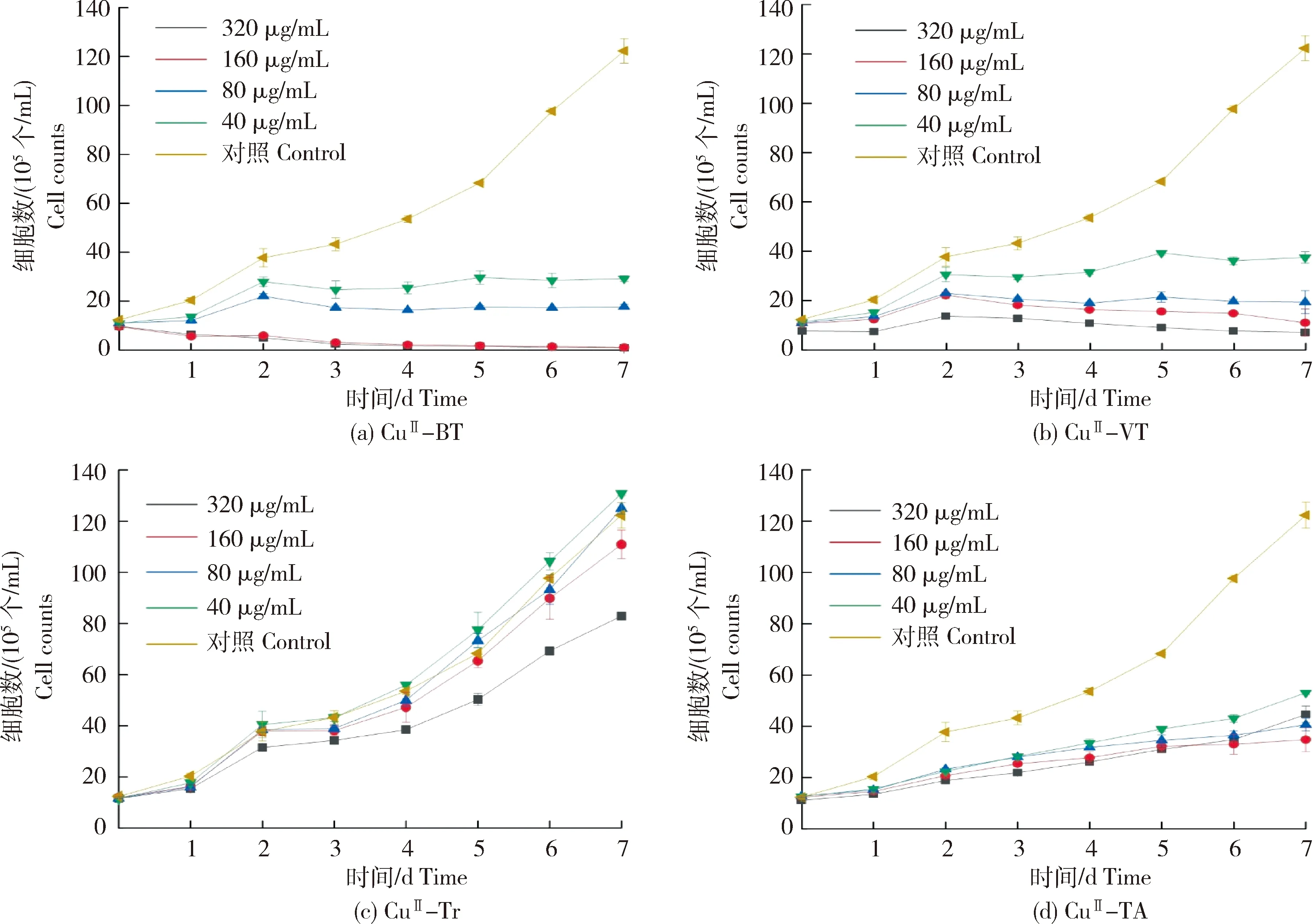
图7 不同铜(II)-多酚纳米复合物在不同浓度下处理C.vulgaris细胞7 d的生长曲线Fig.7 Growth curves of C.vulgaris after treatment with different concentrations copper(II)-phenolic nanocomplexes for 7 days
综上所述可知,铜离子与缩合类多酚形成的CuII-BT和CuII-VT对C.vulgaris的抑制能力明显强于水解类多酚形成的CuII-Tr和CuII-TA,这主要是由于粘附于C.vulgaris细胞表面的CuII-BT和CuII-VT能够释放更多的铜离子,对藻细胞造成更强的氧化损伤,从而实现对C.vulgaris的高效抑制(图(8))。
2.4 铜(II)-多酚纳米复合物在水培生产中的抑藻性能及其对植物的影响
在水培营养液(Hoagland营养液)中添加CuII-BT(160 μg/mL)纳米复合物后培养生菜15 d,并评估铜(II)-多酚纳米复合物的生物安全性及其在实际水培生菜过程中的抑藻能力。图9(a)和(b)所示是对照组与CuII-BT处理组培养15 d的生菜生长表型。相比于对照组,CuII-BT处理组的生菜叶表型没有表现出差异,生长状况良好。CuSO4(14.7 μg/mL,以CuII-BT铜含量计算)处理组生菜叶相对于对照组开始表现出萎蔫现象(图9(c))。根据计数水培营养液中的藻类数量可知,在生菜生长的7 d和15 d,CuII-BT处理组的营养液中,藻类生长受到极大的限制,并且在生菜根部无肉眼可见的藻类附着(图9(a)和(d))。但是,CuSO4处理组的营养液中的藻类生物量显著增加,并且大量的藻类附着在生菜的根部(图9(c)和(d))。
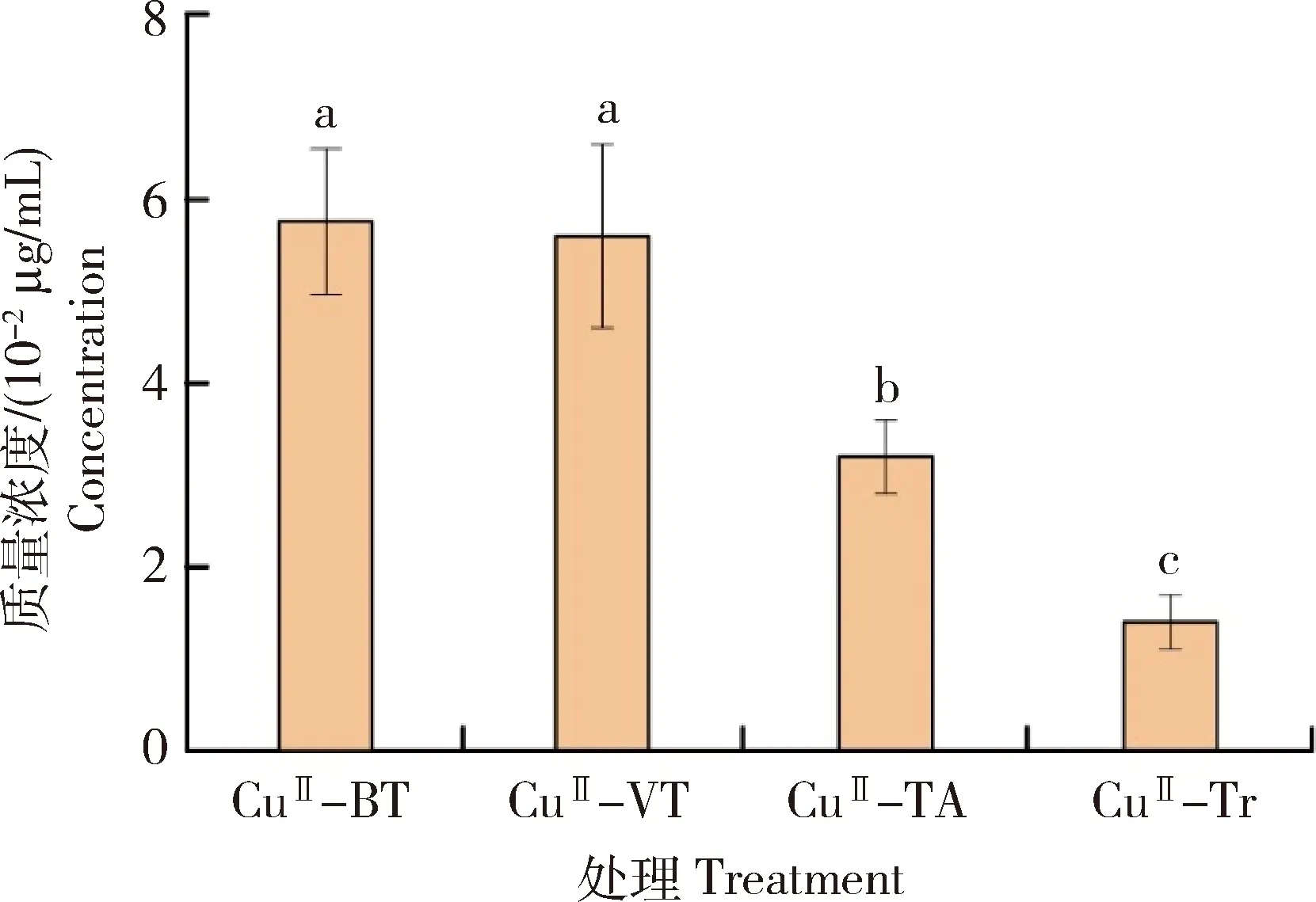
图8 不同铜(II)-多酚纳米复合物处理 C.vulgaris的胞内铜浓度Fig.8 Intracellular copper concentration of C.vulgaris after treatment with different copper(II)-phenolic nanocomplexes

图9 不同处理组生菜的表型(a)~(c)和营养液中的藻细胞数(d)Fig.9 Phenotype (a-c) and algal cell counts (d) in nutrient solution of lettuce seedling under different treatment groups
此外,相较于对照组的生菜根(平均根长10.2 cm),CuII-BT处理组的生菜根生长发育无差异(平均根长12.4 cm),而CuSO4处理组的生菜根的根长较短,平均根长仅6.0 cm(图10(a))。同时,培养15 d后,与对照组相比,含有CuII-BT处理组的生菜鲜重没有明显差异,但CuSO4处理组的生菜鲜重显著降低(图10(b))。测量生菜叶中的铜含量结果显示,与对照组相比,CuSO4处理组的生菜叶中铜含量显著增高,但CuII-BT处理组的生菜叶的铜含量没有明显变化(图11)。由此可知,营养液中加入的CuSO4作为微量元素被生菜大量摄入,致使营养液中的铜含量降低,进一步导致营养液中的铜含量不足以抑制藻类繁殖,反而可以作为微量元素促进藻类繁殖与生长,从而影响生菜生长。此外,当添加CuII-BT纳米复合物时,由于多酚黏附于藻细胞表面并定向向藻细胞内部释放铜离子,从而能够抑制藻类生长,有助于生菜生长。
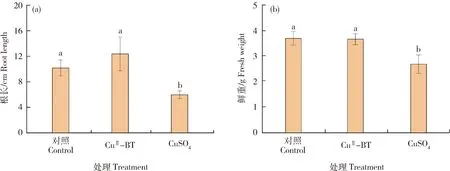
图10 不同处理组生菜的根长(a)和鲜重(b)Fig.10 Root length (a) and fresh weight (b) of lettuce seedling under different treatment groups
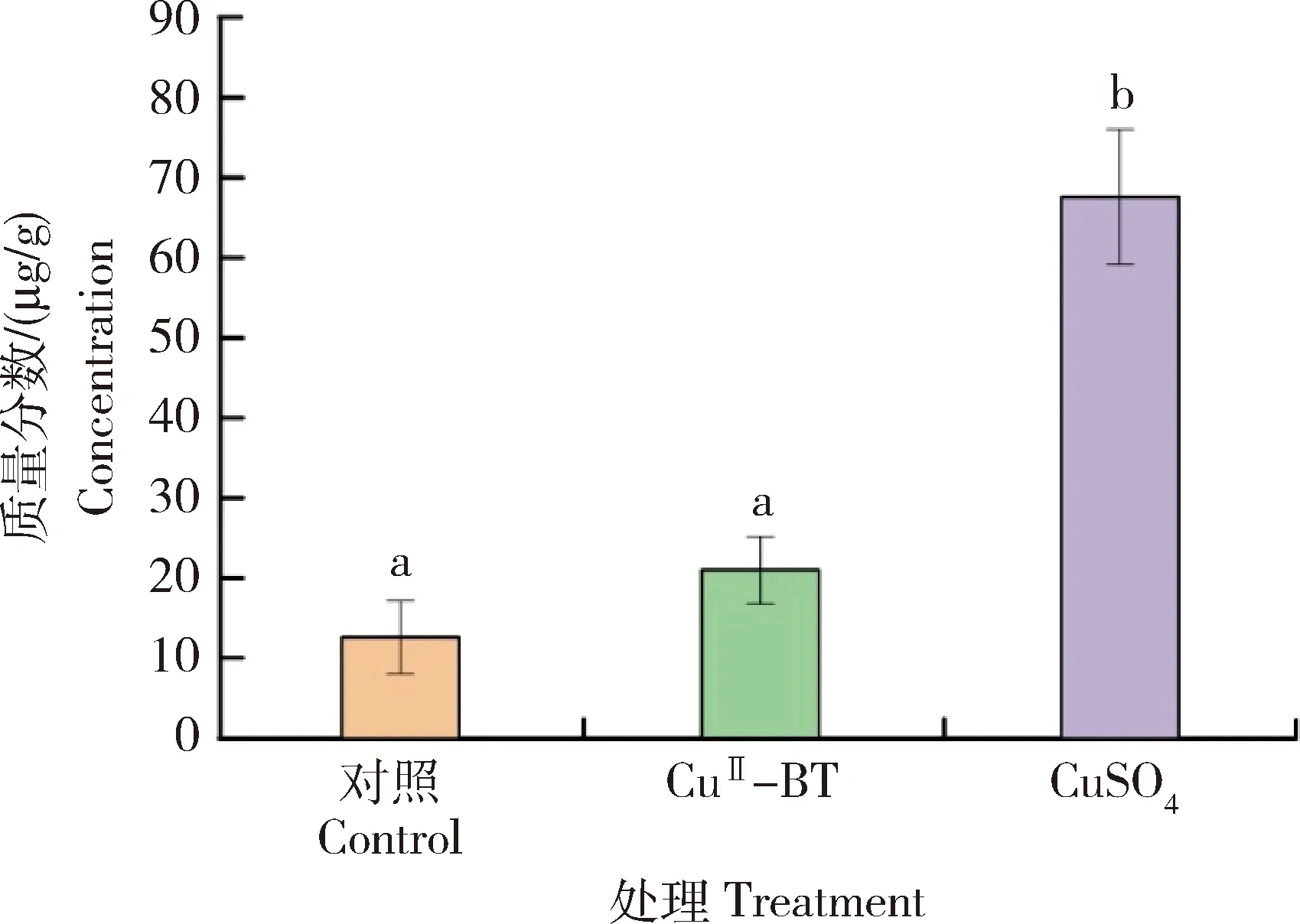
图11 不同处理组的生菜叶含有的铜质量分数Fig.11 Concentration of Cu in lettuce leaf after treatment with different groups
3 讨 论
由于水培所用营养液富含的营养成分高且培养环境开放,致使藻类会反复爆发,大大降低粮食作物产量,所以藻类的抑制或灭杀是水培生产中亟待解决的技术难题。针对藻类的抑制或灭杀通常使用铜基灭藻剂,但是仍然无法长期有效的抑制藻类的生长。此外,直接使用硫酸铜虽然能够有效的进行抑藻,但是自由的铜离子会严重阻碍植物的生长发育,甚至导致植物枯萎[33-34]。已有研究者表明农业生产上使用的农用化学品(农药)有99%的成分流入到了环境中,仅有1%能够被利用[35-37]。值得注意的是,大量的农药流入环境,不可避免地会造成生态环境污染,可能会破坏生态平衡(灭杀有益生物),也有可能会促进耐药菌的产生[37-38]。因此,为了能够使农药最大程度的被利用,研究人员提出了利用纳米技术作为新一代的农药使用策略[35-36]。
本研究利用天然植物提取物(多酚)与功能性金属离子(铜离子)合成铜(II)-多酚纳米复合物,其中天然多酚是一种生物相容性极高的材料,已经被用于食品工程和生物工程领域[18,21,39-40],使该纳米复合物能够成为一种理想的材料用于抑制水培中藻类的生长繁殖。铜(II)-多酚纳米复合物中的铜在营养液中是非自由态的离子,所以能够使营养液中的自由铜离子不会过量,故不会损伤植物生长。此外,由于多酚具有的多重作用力[20]且能够和蛋白质相互作用[41],促使铜(II)-多酚纳米复合物能够黏附于藻细胞表面并向藻细胞递送铜离子,从而导致藻细胞死亡。并且,相较于直接加硫酸铜,该纳米复合物能够长期持续的释放铜离子,拥有持续抑藻能力,同时,铜(II)-多酚纳米复合物不会造成植物的枯萎。以上说明,基于植物多酚自组装的纳米复合物,能够定向向藻细胞内部缓释铜离子,从而直接灭杀藻细胞,不会对农作物表现出毒性作用,表明其拥有高的生物安全性。因此,在未来的农业生产中,该纳米定向缓释技术将会是一种具有极大潜力的农用化学品使用策略,为实现粮食的增产和水培农业的可持续发展提供可行性的技术手段。
4 结 论
本研究基于天然植物多酚对铜离子螯合能力,开发了一种能够精确递送农用化学品和具有持久缓释能力的纳米复合物,主要结论如下:1)铜(II)-多酚纳米复合物能够黏附在藻细胞表面,进而持续地向藻细胞释放铜离子,造成藻细胞强烈的氧化应激,最终导致藻细胞的死亡;2)铜离子与缩合类多酚形成的纳米复合物比与水解类多酚形成的纳米复合物具有更强的抑藻性能,其中CuII-BT在7 d的抑制率达到99%;3)实际水培生菜试验证明,铜(II)-多酚纳米复合物能够抑制实际水培生产营养液中藻类的生长。并且相对于直接使用CuSO4,铜(II)-多酚纳米复合物对水培生菜没有毒性。
