宫颈上皮内瘤变患者宫颈锥切术后病变残留和复发的列线图预测模型构建与评估
2023-05-10李军英冯相珍
李军英 冯相珍
目前,锥切术为临床治疗确诊的宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),特别是3级CIN患者的常用方法,在有效切除病变部位同时还可尽可能保留患者子宫[1-2]。但是,芦恩婷、任妞等研究表明,宫颈上皮内瘤变锥切术后CIN残留及复发患者约4%~16%,需行二次手术,为妇科肿瘤医师面临的棘手问题[3-4]。故,本研究主要分析宫颈上皮内瘤病变术后病变残留和复发的影响因素并构建列线图评估其有效性,以便临床及时干预高危因素,减少病变残留和复发情况的发生。
1 资料与方法
1.1 资料
将2015年6月至2019年6月在本院完成治疗的325例宫颈锥切术后的CIN患者,根据是否复发及残留分为残留或复发组(48例)和未残留和复发组(277例)。其中复发27例,残留21例。纳入标准:①所有患者均经术后病理学检测符合《宫颈癌及癌前病变规范化诊疗指南》[5]中宫颈上皮内瘤病变相关诊断标准;②手术资料完善且自愿签署知情同意书患者;③手术过程顺利且无明显并发症发生患者;④能够接受长期随访患者。排除标准:①既往存在高危人乳头瘤病毒或宫颈疾病治疗史患者;②近3个月内使用药物影响免疫功能患者;③妊娠期、哺乳期患者。本研究经伦理委员会批准(批号:141225-3)。
1.2 方法
于患者月经干净3~7天进行宫颈锥切术,患者给予静脉麻醉或腰硬联合麻醉方式,严密监测患者生命体征。为患者进行阴道镜检查,采用椎高浅、椎底宽的锥切治疗宫颈浅表病变患者,以椎高深、椎底窄的锥切治疗宫颈管内病变。术前给予碘及冰醋酸试验。锥切术的宽度及类型根据病变程度及不着色范围确定。以碘不着色区域外5 mm处为切割点,低病变患者可将宫颈组织4 mm深度切除,宫颈管长度10~15 mm,需将侧缘及顶缘组织分别切除,尽量做到无残留。
1.3 指标
收集患者一般资料及麻醉前宫颈标本,分别行液基薄层细胞学(Thin-prep cytology test,TCT)及高危人乳头瘤病毒检测,其中TCT分为低级别上皮内瘤变、高级别上皮内瘤变、未见瘤变及癌细胞及非典型鳞状上皮细胞等类型。术后待患者月经结束3~7天检测TCT及高危人乳头瘤病毒,其中TCT:显露宫颈口(使用扩阴器),用棉拭子擦拭多余的分泌物,用专用取材刷在宫颈外扩顺时针旋转3圈并停留数秒获取宫颈口脱落细胞,置于细胞保存液样本管中。使用支链DNA技术(Quantirus TM诊断试剂盒及Quantirus TM冷光仪)检测HPVE6/E7mRNA拷贝数,不足1 copy/mL为阴性,达到1 copy/mL及以上即为阳性。HPV-HC2检测方法:采集完细胞后,以宫颈第二代杂交捕获试验专用工具采集宫颈管处标本,将宫颈刷头部于采集后放入专用细胞保存液中,沿折痕处将宫颈刷柄折断,保存液瓶口旋紧,并记录患者信息做好标记,再以荧光剂读取检测数值。若RLU/CO>1.0即可诊断为高危人乳头瘤病毒阳性。术后两次检测为阴性即确定高危人乳头瘤病毒检测结果为阴性。
1.4 随访
术后患者每3个月随访一次,进行妇科检查,术后3~6个月复查TCT,若TCT阳性或有肉眼可见病变,应进一步行阴道镜下宫颈搔刮术及宫颈活检进行病理检查。术后3个月进行第一次复查,检测HPV-HC2及TCT,若结果为阴性每3~6个月随访一次,有任何一次出现细胞学异常患者给予宫颈管组织搔刮或宫颈组织活检提示存在CIN即为复发。病变残留标准:患者于术后6个月联合检查HPV-HC2及TCT,结果异常者进行宫颈管组织搔刮术及宫颈组织活检,结果提示存在CIN即为病变残留。截止2021年6月进行为期2年的随访,根据患者术后是否复发或残留可将其分为残留及复发组及无残留及复发组。
1.5 统计学分析

2 结果
2.1 一般资料
本研究纳入病例中术后残留患者21例,复发患者27例,收集所有患者资料进行分析,结果显示,2组患者一般资料比较无统计学意义(P>0.05),见表1。
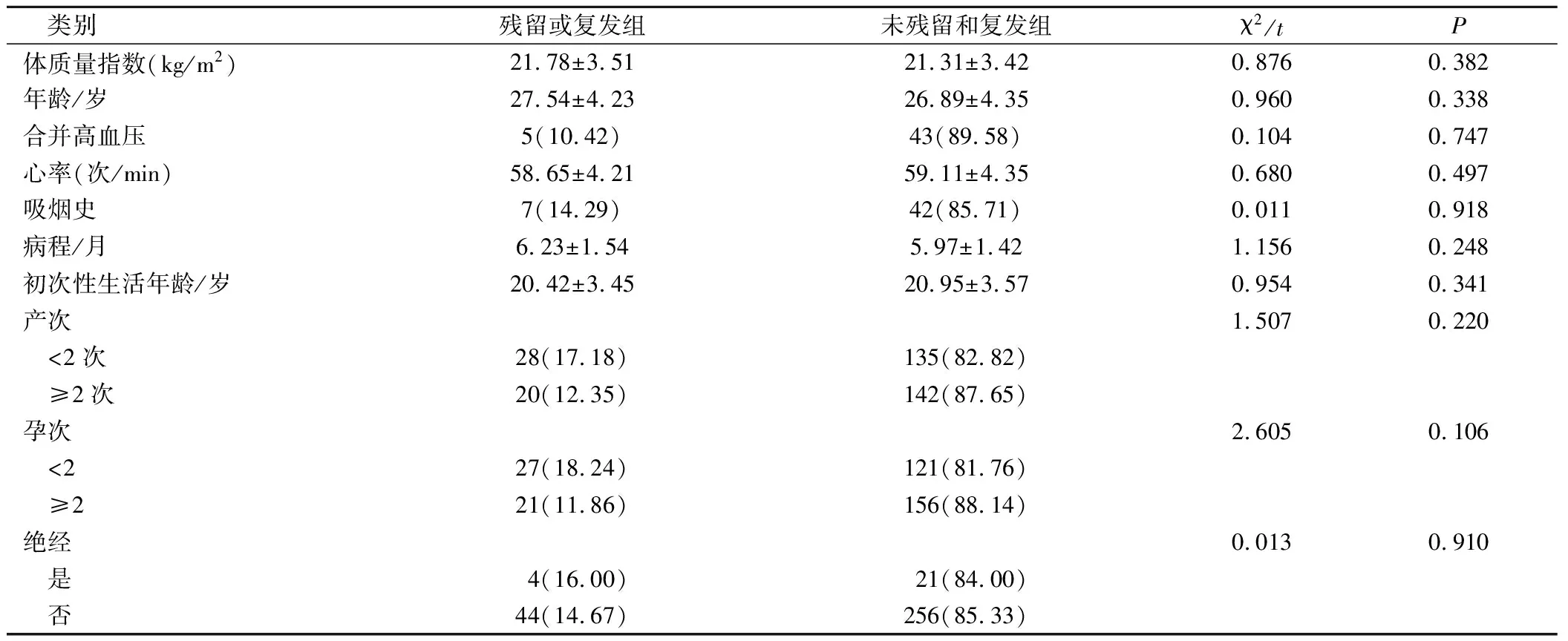
表1 2组患者一般资料比较
2.2 病理情况及单因素分析结果
残留或复发组术前CIN分级、HPVE6/E7mRNA阳性、病变累及腺体、手术切缘阳性人数占比与未残留和复发组比较均明显升高(P<0.05),见表2。
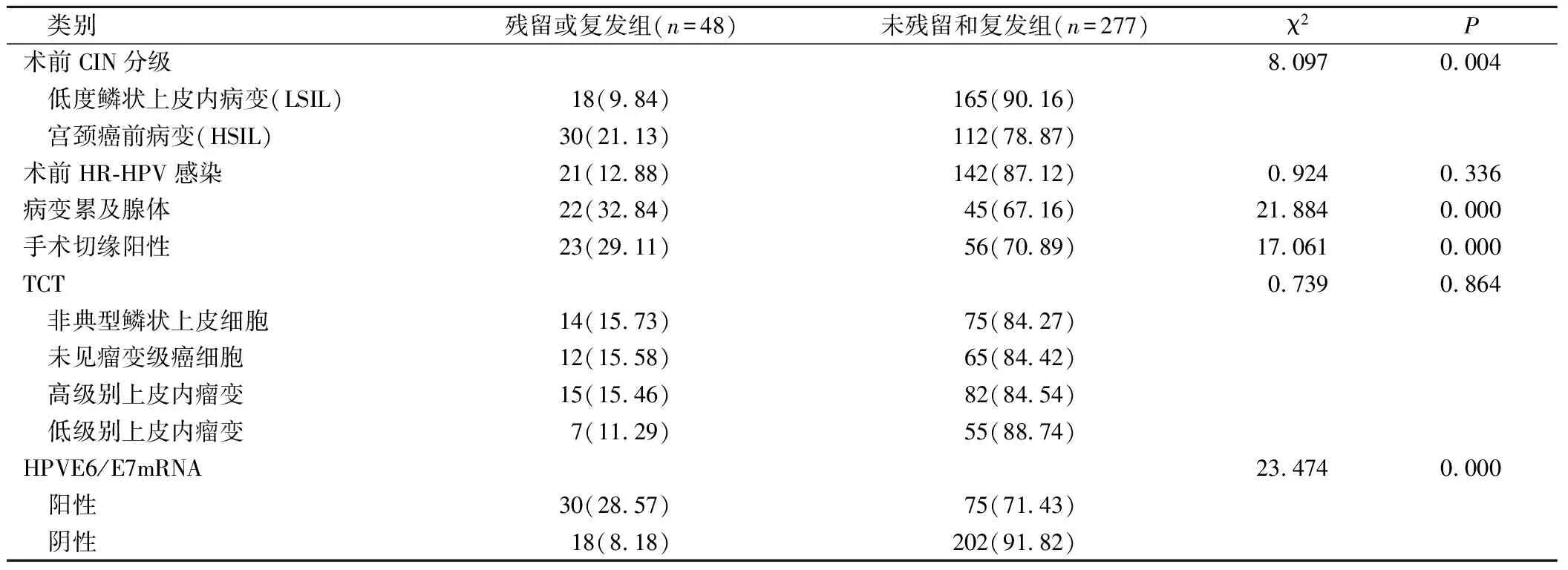
表2 2组患者病理情况及单因素分析结果(例,%)
2.3 宫颈上皮内瘤变术后病变残留和复发的Logistic回归分析
将单因素分析具有差异的指标作为自变量,以患者宫颈上皮内瘤变术后是否发生病变残留和复发作为因变量,进一步行二元Logistic回归分析,结果显示,术前HSIL、HPVE6/E7mRNA阳性、病变累及腺体及手术切缘阳性为影响宫颈上皮内瘤病变术后病变残留和复发的危险因素(P<0.05),见表3。
2.4 构建宫颈上皮内瘤变术后病变残留和复发的风险评分标准
根据Logisitic回归分析结果,以R软件构建列线图模型,见图1。在图中各变量轴对应点做垂直线于评分标尺处取得得分。再将各变量评分相加,总得分在预测概率对应的点取对应值即为宫颈上皮内瘤变患者术后病变残留和复发的风险。根据列线图模型可知,术前HSIL分级得分100分,HPVE6/E7mRNA阳性得分76分,病变累及腺体70分,手术切缘阳性56分。见图1。
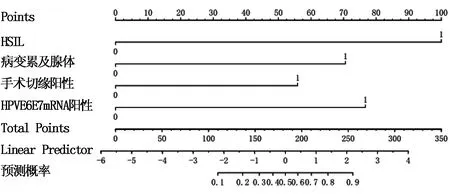
图1 宫颈上皮内瘤变术后病变残留和复发的风险预测模型
2.5 验证宫颈上皮内瘤变患者术后病变残留和复发的列线图
使用模拟重复采样法验证列线图,将原始数据重复采样500次后以ROC曲线下面积及H-L偏差度检验,其中ROC曲线下面积为0.868(灵敏度为81.20%,特异度为86.60%);H-L偏差度结果为χ2=3.142,P=0.512。提示,所建模型区分度较好,见图2、3。
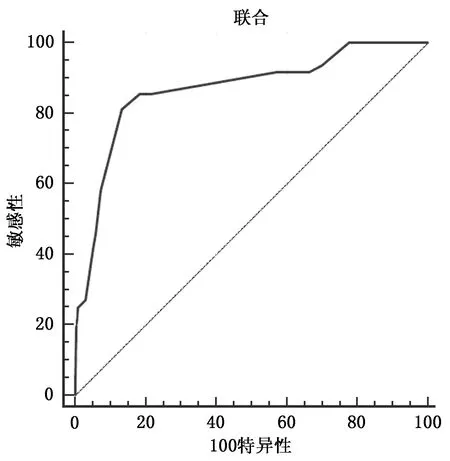
图2 预测宫颈上皮内瘤变术后病变残留和复发的列线图模型ROC曲线
2.6 预测模型的临床应用
绘制DCA曲线时以高风险阈值为横坐标(0,1),以净获益率为纵坐标,见图4。当高风险阈值为0.6~0.85时净获益率具有临床意义,且在此范围内取值越小临床意义越大。
3 讨论
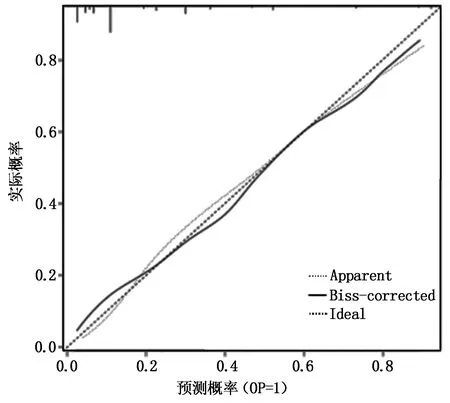
图3 预测宫颈上皮内瘤变术后病变残留和复发的列线图模型分类校准图
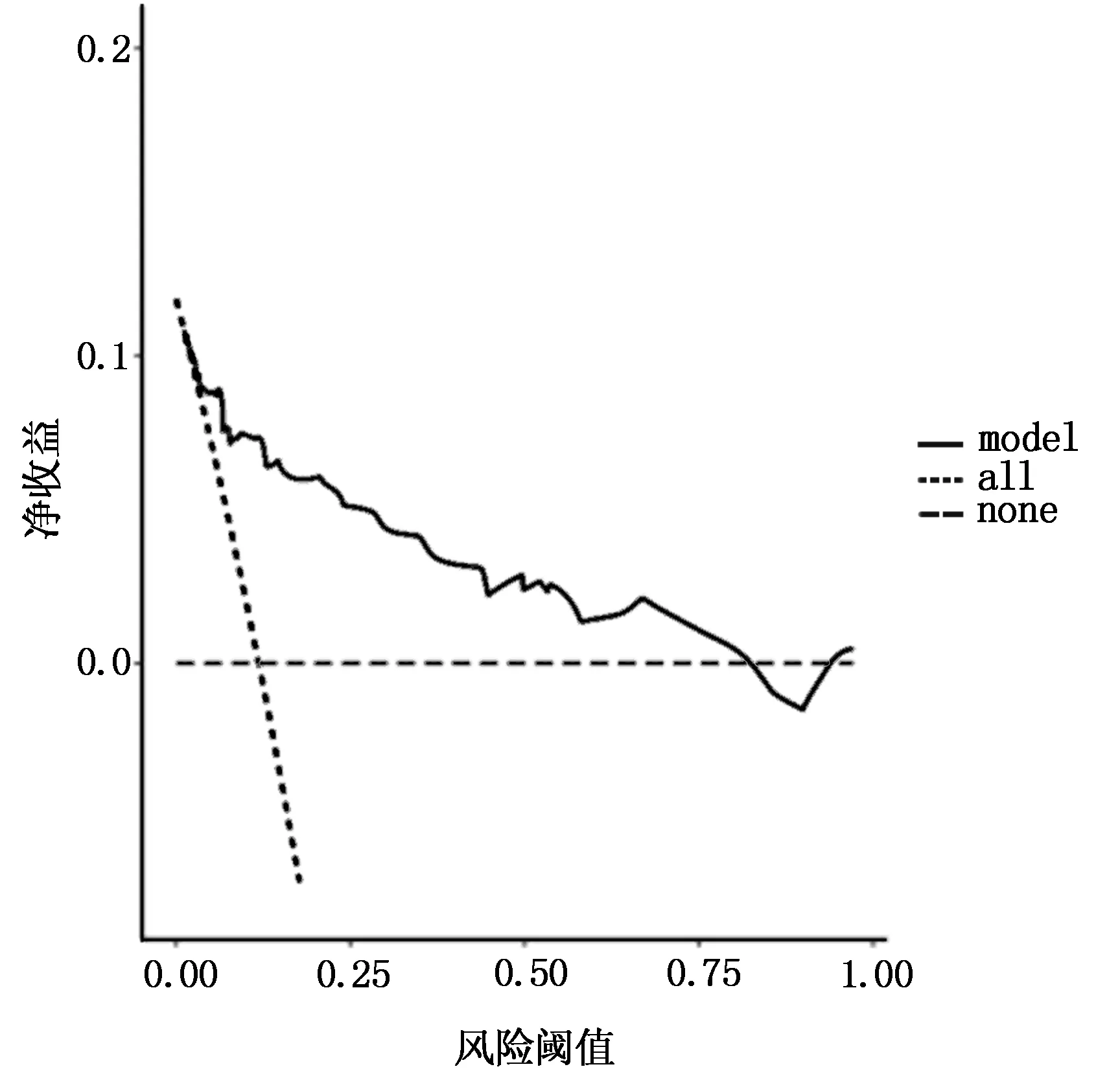
图4 DCA曲线
宫颈癌发病率高,为常见恶性肿瘤,严重影响女性健康[6-7]。近年来,宫颈癌筛查已大大地提高宫颈癌早期病变的检出率,为临床早期干预提供了重要条件,从而可有效改善患者预后,并提高其生活质量[8]。CIN为宫颈癌前病变,若不能及时干预处理,可进展为宫颈癌,对患者预后影响较大[3-9]。目前,宫颈锥切术为临床治疗CIN的常用方法,可有效切除病变组织,以防引发宫颈癌,但是仍存在术后病变残留和复发情况[10]。故,如何有效预测CIN术后残留和复发情况对于治疗、改善预后意义重大。而列线图能够将影响因素以图形方式呈现出来,可整合多种因素得到大概率值,操作性及直观性较好。宫颈锥切术具有术后并发症少、微创、操作简单等优点,目前已成为治疗CIN的首选方法[11]。
本研究对宫颈上皮内瘤变锥切术后患者资料进行统计分析,结果显示,其术后病变残留和复发率为14.77%(48/325),与相关研究结果类似[4,12]。另外,收集患者资料进行单因素及二元Logistic回归分析结果显示,术前HSIL分级、HR-HPV感染、病变累及腺体及手术切缘阳性为影响CIN术后病变残留和复发的重要因素,与聂淑容研究结果一致[4,13]。CIN术后病变残留和复发风险随着CIN分级不同分值不同,HSIL级患者风险评分可达100分,且HSIL(为重度不典型增生及原位癌)病灶较多,锥切术难以将其完全切除。HPVE6/E7mRNA阳性得分可达76分,与林映平[14]研究中HPVE6/E7mRNA阳性患者发生术后复发或持续的结果基本一致。病变累及腺体评分可达70分,手术切缘阳性评分可达56分,能够将病变特点从侧面反映出来,徐燕[3]研究亦证实其与CIN术后复发有关。
本研究以H-L拟合优度检验及ROC曲线检验所构建列线图,结果显示,以术前HSIL分级、HPVE6/E7mRNA阳性、病变累及腺体、手术切缘阳性作为预测变量信效度较好。实际使用时,临床可将患者风险因素对应得分之和得出,评估患者CIN术后病变残留和复发的风险值。应用本模型可帮助宫颈上皮内瘤变锥切术后患者有效预测其术后病变残留和复发风险,并采取措施对术前HSIL分级、HPVE6/E7mRNA阳性、病变累及腺体、手术切缘阳性患者术后病变残留和复发进行预防,进而减少其发生率。绘制DCA曲线亦显示,该模型高风险阈值为0.6~0.85时净获益率具有临床意义,且在此范围内取值越小临床意义越大。
综上所述,术前HSIL分级、HPVE6/E7mRNA阳性、病变累及腺体、手术切缘阳性为影响CIN术后病变残留和复发的独立危险因素,以此建立的列线图模型准确度及区分度良好,能够有效识别高风险人群,以利于及时预防、减少术后病变残留及复发。但是本研究尚不清楚CIN的具体复发机制及各项危险因素的互相作用机制,且本研究时间有限,尚未进行外部验证列线图。
