早期胃癌患者ESD术后迟发性出血危险因素的Logistic回归方程构建及预测价值
2023-05-10马志杰
李 军 丁 娟 马志杰
胃癌(gastric cancer,GC)为常见恶性肿瘤,起源于胃黏膜上皮,多数发生于胃窦部,胃前后壁、胃小弯、胃大弯均可受累[1]。早期胃癌(early gastric cancer,EGC)患者多无明显症状,可存在嗳气、恶心、呕吐、上腹不适等症状,但特异性不显著。研究发现,ME-NBI联合超声内镜探测病变浸润深度与病理检测一致性比单独使用超声内镜高,对提高早期胃癌的诊断率有很大帮助,在治疗上,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)安全性及可靠性均较高[2]。ESD术是治疗EGC的重要手术方法,可在内镜下一次性切除病灶,具有术野清晰、创伤小、切除率高、恢复快等优点,受到临床广泛关注。研究显示,早期胃癌的预后与外科手术相当,但具有手术时间短、术中出血量少、术后恢复快等优点,可改善患者生活质量[3]。出血是ESD术后常见并发症,包括早发性出血与迟发性出血,迟发性出血具有起病急骤、出血量较大等特点,可能引起严重后果[4],故应早期识别ESD术后迟发性出血,并采取有效预防策略,对改善患者预后具有积极意义。因此,本研究分析EGC患者ESD术后迟发性出血的危险因素,并制定针对性的预防策略。
1 资料与方法
1.1 一般资料
回顾性分析2021年11月至2022年9月我院收治的260例早期胃癌患者的临床资料,术后迟发性出血诊断标准[5]:①伴有呕血、黑便、头晕、头痛等身体不适;②血红蛋白(Hb)丢失超过20 g/L;③血压下降超过2.66 kPa或心率增加20 次/min;④经内镜检查证实创面出血。若患者症状符合上述标准中的2项及以上,则可断定为迟发性出血。
1.2 纳入及排除标准
纳入标准:符合《中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)》中EGC诊断标准[6];均由内镜手术经验丰富、主治医师以上职称医生行ESD术治疗;经X线检查、腹部超声、肿瘤标志物、病理活检等检查确诊;临床资料完整;符合《赫尔辛基宣言》要求。排除标准:心、肝、肾等重要脏器异常;合并其他恶性肿瘤;癌细胞深层浸润或远处转移;存在手术禁忌证;重症感染、凝血功能障碍;患有精神科疾病,认知功能异常;中途因其他原因退出本研究。
1.3 资料收集及研究方法
260例EGC患者均行ESD术治疗,术后随访30 d,查看患者是否发生过迟发性出血,将18例发生迟发性出血者纳入迟发组,242例未发生迟发性出血者纳入非迟发组。收集2组临床资料,包括年龄、性别、肿瘤部位、肿瘤直径、抗血小板药物停用时间、术前活检次数、术中出血、术中使用肾上腺素。分析EGC患者ESD术后迟发性出血的危险因素,构建Logistic回归方程,并分析其预测价值。
1.4 统计学方法
2 结果
2.1 2组患者临床资料差异性比较
2组性别、术中使用肾上腺素比较,差异无统计学意义(P>0.05);迟发组年龄≥60岁、肿瘤部位、肿瘤直径≥5 cm、抗血小板药物停用时间<3 d、术前活检次数>2次、术中出血发生率与非迟发组比较,差异有统计学意义(P<0.05)。见表1。
2.2 EGC患者ESD术后迟发性出血危险因素Logistic回归分析
以ESD术后是否发生迟发性出血为因变量(否=0,是=1),将2组临床资料差异具有统计学意义的因素作为自变量(赋值方法见表2)予以多因素二元Logistics回归分析,结果显示:年龄≥60岁、肿瘤直径≥5 cm、抗血小板药物停用时间<3 d、术前活检次数>2次、术中出血是EGC患者ESD术后迟发性出血的危险因素(P<0.05),见表3。
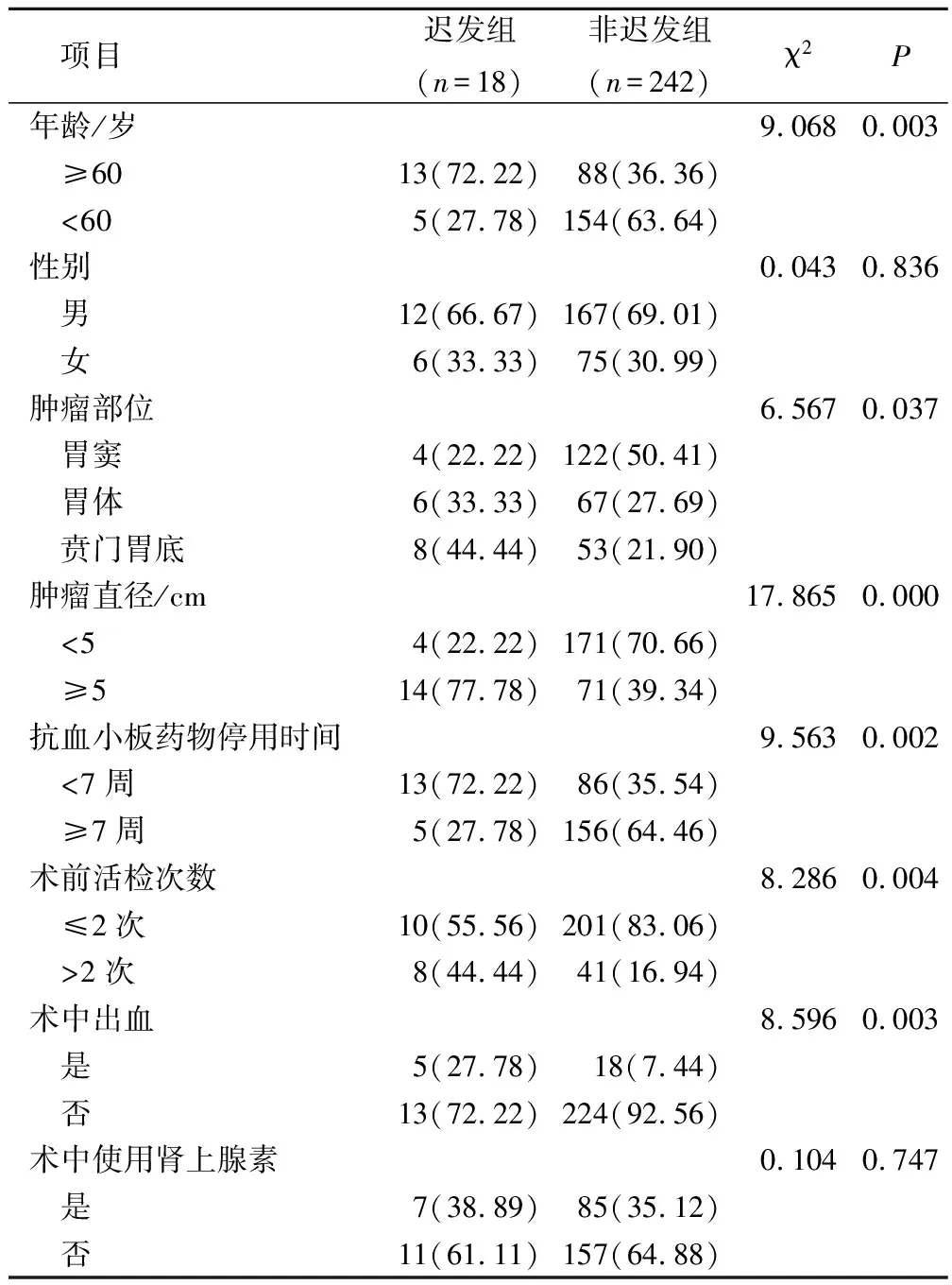
表1 2组患者临床资料差异性比较(例,%)
2.3 构建EGC患者ESD术后迟发性出血发生的回归方程
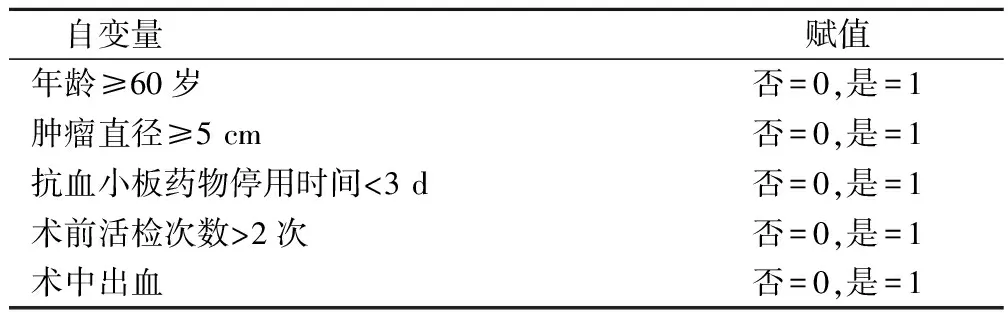
表2 赋值表
把上述危险因素纳入回归方程,得到Logit(P)=-6.273+5.376×年龄≥60岁+8.811×肿瘤直径≥5 cm+12.098×抗血小板药物停用时间<3 d+6.322×术前活检次数>2次+3.013×术中出血。
2.4 Logistic回归模型评价
似然比卡方=74.279,df=5,P<0.001,提示模型总体有意义,对模型拟合优度效果予以量表评价,-2对似然值=141.572,Hosmer-Lemeshow检验对拟合优度效果予以质性评价,χ2=7.484,DF=8,P=0.485,说明该模型拟合优度效果较好。
2.5 回归模型对EGC绘制ESD术后迟发性出血发生的预测价值
对回归模型绘制Logit(P)的ROC曲线,得到Logit(P),依据预测值与真实值绘制Logit(P)的ROC曲线,AUC=0.876,95%CI:0.830~0.914,当最佳截断值>13.13时,敏感度为88.89%,特异度为74.49%,见图1。
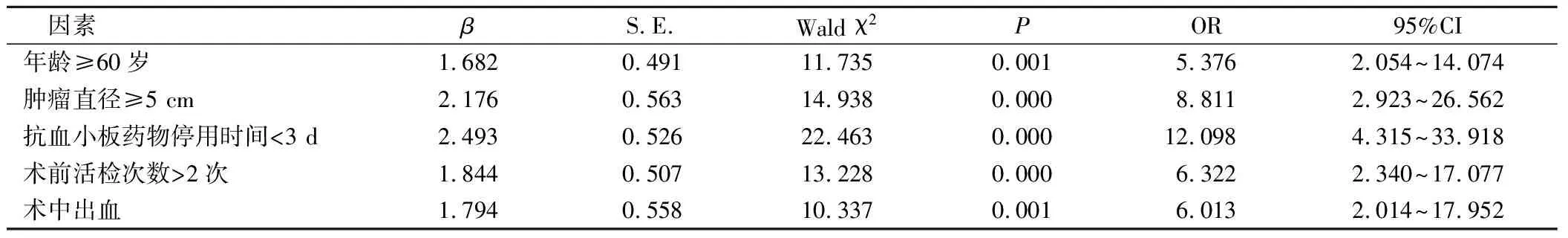
表3 EGC患者ESD术后迟发性出血的Logistic回归分析
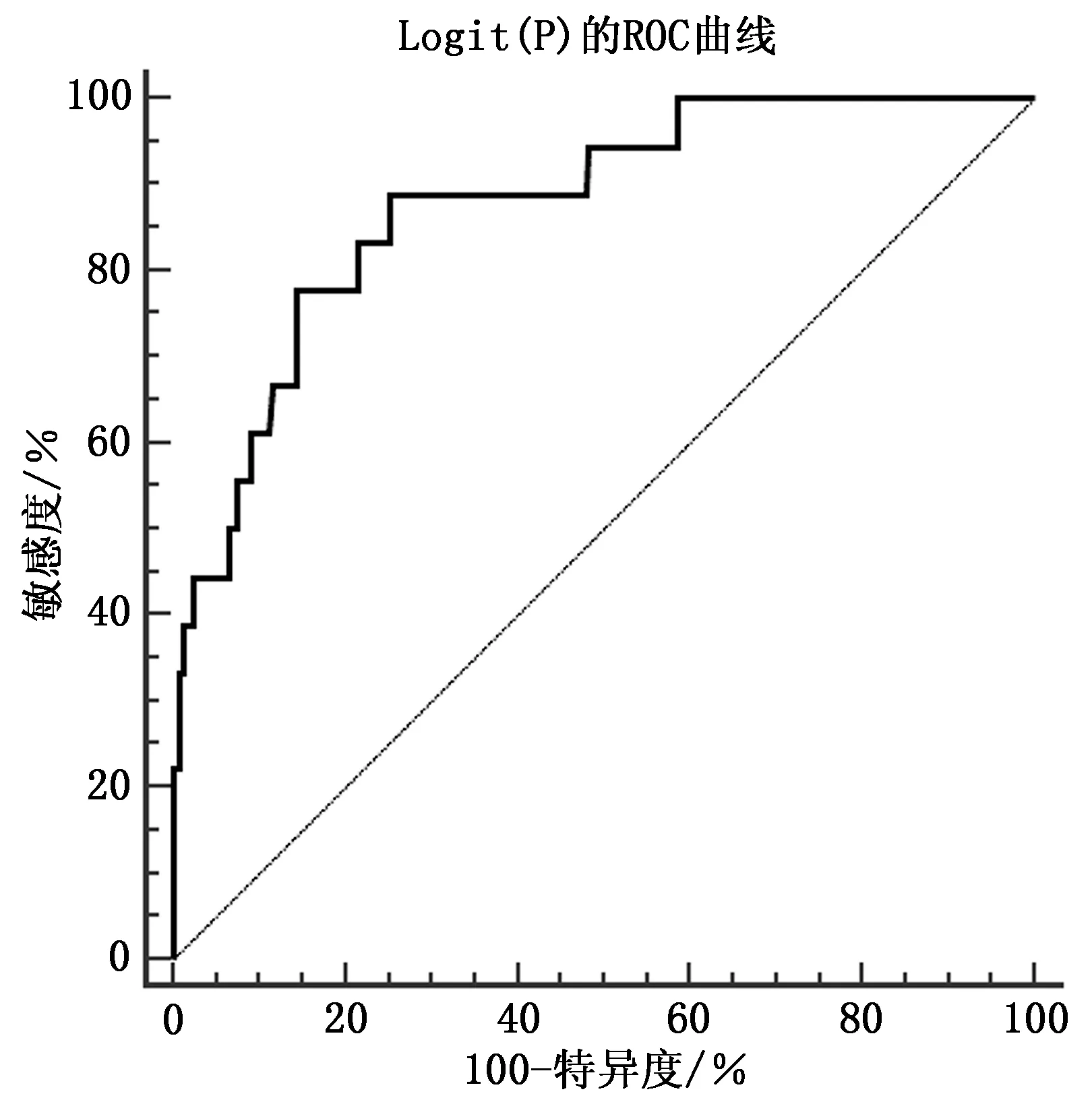
图1 Logit(P)的的ROC曲线
3 讨论
胃癌可能是由遗传、幽门螺旋杆菌感染、癌前病变、不良饮食等多种因素共同导致[7-8]。10%胃癌患者存在遗传倾向,有胃癌家族史者发病率较正常人高2~3倍[9]。而幽门螺旋杆菌感染是Ⅰ类致癌原,腌菜、霉变食物等会提高患胃癌风险。研究指出,幽门螺杆菌感染能促进胃癌细胞的侵袭迁移能力,可能与其通过ERK信号途径增强MMP-9表达而诱导胃癌的发生发展有关[10]。早期发现胃癌,并及时进行手术切除肿瘤组织,是根治早期胃癌的重要方法,多数患者预后良好。常规外科手术虽可有效切除肿瘤病灶,但手术创伤较大,术后易发生并发症,不利于患者快速康复[11]。随着内镜技术发展,内镜手术在胃肠道肿瘤治疗中的应用逐渐增多。ESD术适用于胃黏膜及下层肿瘤诊疗,对未转移的早期胃癌、胃肠道间质瘤等均可有效切除,手术效果显著[12]。
但ESD术可能引发穿孔、迟发性出血等并发症,迟发性出血严重时,可引发失血性休克,甚至诱发心脑血管疾病,需引起临床重视。多数迟发性出血未能及时发现,内镜检查因血凝块覆盖,查找出血部位难度大,加之术后创面、切缘肿胀,可能无法有效止血[13]。因此,有效识别ESD术后迟发性出血危险因素,并实施针对性预防措施,是减少迟发性出血发生的重要途径。
本研究Logistic回归分析显示:年龄≥60岁、肿瘤直径≥5 cm、抗血小板药物停用时间<3 d、术前活检次数>2次、术中出血是EGC患者ESD术后迟发性出血的危险因素(P<0.05)。提出针对性预防策略,首先需对EGC患者ESD术后的危险因素予以逐条深入剖析,本研究遵循以上原则,分析具体如下:①老年EGC患者血管管壁黏多糖、胶原纤维增多,弹性纤维减少,管壁钙化,造成血管硬化、弹性下降[14],同时老年EGC患者组织修复能力差,再生能力弱,创面愈合减缓,易出现迟发性出血。②迟发性出血也可能与肿瘤直径有关。肿瘤直径会加大手术操作难度,增大切除范围,术后创面完全愈合延迟,加之胃黏膜表面血管网丰富,黏膜受损时,易出现较大出血。③抗血小板药物的使用可能也是术后迟发性出血发生的重要影响因素,抗血小板药物会抑制血小板聚集,控制血栓形成,导致凝血功能障碍,影响创面愈合,可能引起持续性出血,加之术前抗血小板药物停用较迟,EGC患者体内可能存在药物残留,从而影响血小板聚集,不利于创面愈合,产生迟发性出血风险。④病理活检是恶性肿瘤疾病诊断的准确方法,临床常采取病理活检的方法对EGC患者进行诊断,结果准确,可有效确定肿瘤性质、肿瘤分期及指导临床治疗、评估预后,但EGC患者可能在不同的医院进行病理活检,以排除患有恶性肿瘤的结果,多次活检可能引起血管增生、切口渗血、肿瘤基底部黏连,增加迟发性出血发生风险。⑤一项研究显示,年龄越大,穿刺针数越多,术前血清肌酐值越高以及术中患者不能配合都会导致超声引导下穿刺活检术后出血的机会增加[15],术中出血若未能完全止血,术后可能发生隐性出血,切口无法及时愈合,随时间推移,出血量不断增加,最终导致迟发性出血的发生。对以上危险因素分析的同时,经查阅严海荣等[16]研究文献得知:病灶黏膜下层纤维化、切除标本直径大于4 cm、使用抗凝药和/或抗血小板药,这3个独立危险因素构建的风险预测评分系统,能够有效识别EGC ESD术后发生迟发性出血的高风险患者。而本研究中,年龄≥60岁、肿瘤直径≥5 cm、抗血小板药物停用时间<3 d、术前活检次数>2次、术中出血5个因素构成选例对象的危险因素,将以上危险因素纳入Logistic回归方程,对模型总体、模型拟合优度经验证后均有统计学价值,故通过绘制ROC曲线对模型的预测价值予以评价,结果显示:AUC=0.876,95%CI:0.830~0.914,当最佳截断值为>13.13时,敏感度为88.89%,特异度为74.49%,说明该模型对事件的发生预测价值较好,可有效评估EGC患者ESD术后迟发性出血发生风险。
对于EGC患者,对发现ESD术后迟发性出血,接诊后需立即协同处置。但围术期预防同样重要,可有效减少术后迟发性出血发生。对于EGC患者,需有效评估其ESD术后迟发性出血发生风险,根据其存在的术后迟发性出血危险因素,积极实施针对性的预防措施,经查阅多篇文献,同时结合本人在消化内镜中心多年临床经验,特提出以下干预策略,希望对于同行间交流与学习有所帮助,具体如下:①老年EGC患者血管弹性低,组织修复能力弱,需积极增强患者免疫能力,促进组织修复,可指导患者多食用富含维生素的食物,如菠萝、芒果、胡萝卜、空心菜等果蔬,提升机体修复能力,加快切面愈合,降低迟发性出血风险。研究发现,维生素D3联合美沙拉嗪治疗对轻-中度活动期溃疡性结肠炎患者的疗效显著,能降低血清氧化型低密度脂蛋白和过氧化脂质、降钙素原、二胺氧化酶水平,对肠黏膜氧化应激损伤具有良好的修复作用[17]。②肿瘤直径≥5 cm的EGC患者,手术切除难度高,病灶面积大,迟发性出血风险较高。对于此类患者,术中需注意彻底止血,对创面、切缘进行有效电凝止血,对疑似出血点喷洒生物蛋白胶止血,术后注意观察引流液颜色、性质等,发现出血,立即进行内镜检查、止血等处理。③抗血小板药物会抑制血小板聚集,不利于血栓形成,减缓创面愈合[18]。对于术前服用抗血小板药物的患者,术前至少3 d指导患者停止服用抗血小板药物,避免抗血小板药物残留引起EGC患者ESD术后迟发性出血发生。④对于术前活检次数>2次的EGC患者,考虑术后迟发性出血与术前活检造成的器官损伤有一定关系,ESD术应在活检造成的损伤修复后进行,避免活检损伤与手术创伤叠加,增大ESD术后迟发性出血发生风险。⑤术中出血若未彻底止血,ESD术后可能有隐性出血,导致术后发生迟发性出血。因此,ESD术中应充分冲洗术区,检查出血点,电凝与生物蛋白胶等联合使用,以完全止血,防止因止血不彻底,引发术后迟发性出血。大出血前患者可能出现少量出血、上腹部不适、间断性低热等症状,发现EGC患者出现此类症状,应考虑存在术后迟发性出血风险,积极进行内镜、CT检查提前处理。
综上所述,EGC患者ESD术后迟发性出血的发生可能与年龄、肿瘤部位、肿瘤直径、抗血小板药物停用时间、术前活检次数、术中出血有关。年龄≥60岁、肿瘤直径≥5 cm、抗血小板药物停用时间<3 d、术前活检次数>2次、术中出血是EGC患者ESD术后迟发性出血的危险因素,针对以上危险因素,结合本人多年临床经验,总结提出的预防性策略希望可促进同行间交流与学习,为预防EGC患者ESD术后迟发性出血提供借鉴。受本人专业统计学知识掌握欠缺,本研究存在以下不足:①未设置协变量,加之分组不均衡,研究可能存在混杂偏倚;②本研究属于回顾性队列研究,临床资料统计上可能存在信息偏移。未来须排除以上因素干扰,将更多影响因素纳入回归模型,以期获得更具代表性的结论。
