非小细胞肺癌患者血清NSE、ProGRP的变化及其临床意义
2023-05-10丁纪涛赵乐华张密雪
丁纪涛 王 祥 赵乐华 张密雪
非小细胞肺癌(non-small cell lung cancer,NSCLC)属于临床上常见的疾病类型,病理类型分为腺癌和鳞癌[1]。临床上常采用支气管镜活检、影像学检查以及经皮肺穿刺活检等检查,但大部分确诊后处于晚期,无法手术治疗,且5年生存率较低,最高仅15%[2]。血清胃泌素释放肽前体(recombinant Pro-Gastrin releasing peptide,ProGRP)在正常组织内表达极少,外周血中稳定性更高[3],多项研究均表明[4-5],ProGRP为肺癌较为可靠的肿瘤标志物,并且敏感度及特异度均较高,能够用于鉴别NSCLC和SCLC。神经元特异性烯醇化酶(neuron-specific enolase,NSE)属于神经内分泌家族成员之一,通过诱导肿瘤细胞表面的膜糖蛋白的结合,进一步影响肿瘤细胞的生物学行为[6],研究称[7],NSE水平可作为评估指标,用于预测患者预后。刘琳等[8]研究中,NSE水平可用于鉴定肺部良恶性疾病。血清ProGRP、NSE在晚期NSCLC中的作用还需要进一步研究。本次研究主要探讨血清ProGRP、NSE在晚期非小细胞肺癌中的表达及临床意义,内容如下。
1 材料与方法
1.1 纳入标准
研究组均符合2018年版《中华医学会肺癌临床诊疗指南》中关于NSCLC的诊断标准[9];研究组均经过纤维支气管镜毛刷、痰细胞学、细针肺穿刺细胞学等检查后,病理类型均为腺癌或者鳞癌;既往均无免疫抑制剂治疗史、放射治疗史及化疗治疗史等;入院资料均完整;预计患者生存时间≥3个月;研究组根据国际肺癌研究协会(international association for the study of lung cancer,IASLC)发布的第8版国际TNM分期标准[10],均为Ⅲ~Ⅳ期患者;均已签署知情同意书。
1.2 排除标准
合并先天性心脏病;伴有其他严重脏器功能不全,如肝、肾等;合并其他原发性肿瘤疾病、自身免疫性疾病;难治性终末心衰;正在参与其他临床研究。
1.3 一般资料
收集2019年1月至2020年12月在我院肿瘤内科、心胸外科就诊的晚期非小细胞肺癌患者84例作为研究组,同时期收集体检健康的志愿者84例作为对照组。研究组:男性47例,女性37例;年龄≤60岁45例,>60岁39例。对照组:男性35例,女性49例;年龄≤60岁43例,>60岁41例。两组一般资料比较,P>0.05。
1.4 检测方法
1.4.1 主要检测仪器与实验试剂 ProGRP电化学发光法检测试剂盒、NSE电化学发光法检测试剂盒均来源于德国罗氏公司;离心机来源于湘仪离心机仪器有限公司,型号为L720R-3。
1.4.2 血清ProGRP、NSE水平检测 所有研究对象均需要禁食禁水至少8 h,均于第2日清晨抽取肘部静脉血2 ml,置于真空管中,静置30 min,离心,4000 r/min,r为5 cm,离心5 min,采用酶联免疫吸附试验检测。血清ProGRP水平≤50 pg/ml,血清NSE水平≤25 ng/ml。如结果高于正常范围则判定为阳性,否则为阴性。
1.5 统计学方法

2 结果
2.1 两组患者血清ProGRP、NSE水平比较
与对照组比较,研究组患者血清ProGRP(70.98±30.16)pg/ml、NSE(26.36±2.36)ng/ml水平均显著更高,P<0.05。见表1。

表1 血清ProGRP、NSE水平比较
2.2 人口学特征
84例晚期NSCLC患者资料,其中男性47例,女性37例;年龄≤60岁45例,>60岁39例;44例具有吸烟史,ECOG评分≤1分56例,≥2分28例;TNM分期:T分期T1~2 42例,T3~4 42例,N分期57例,无者27例,M分期淋巴结转移数目<3个 44例,≥3个 40例;病理类型腺癌 65例,鳞癌 19例;EGFR基因表达阴性37例,阳性47例;分化程度:低分化44例,中分化37例,高分化3例。
2.3 血清ProGRP、NSE水平与NSCLC临床病理特征的关系
淋巴结转移数目≥3个、病理类型为腺癌、EGFR基因表达阳性者血清ProGRP、NSE水平均明显更高(P<0.05)。见表2。
2.4 不同检测方法误诊率、漏诊率比较
与单独检测比较,血清ProGRP、NSE水平联合检测晚期NSCLC患者的误诊率(9.52%)及漏诊率(14.29%),均明显更低(χ2=4.869,P=0.042;χ2=4.966,P=0.036)。见表3、图1。
3 讨论
NSCLC发病疾病机制复杂,耐药性高,患者预后恢复差。肿瘤标志物表示经由肿瘤细胞分泌,宿主对肿瘤细胞反应,从而出现水平异常的一类物质,存在创伤小、高效及方便等优势,逐渐被广泛用于NSCLC诊断和治疗[11]。
NSE属于一类水解酶,经神经源性细胞分泌,在神经源性恶性肿瘤疾病中水平较高,属于目前临床上常用的检测指标。血清NSE可用于鉴别NSCLC和SCLC,同时还可用于疗效的检测。ProGRP属于GRP的前体,稳定性好,且半衰期长,大量存在于神经纤维组织、脑组织的神经内分泌细胞中。相关研究显示[12],血清GRP水平与ProGRP水平之间呈现正相关性。一项meta分析显示,与单独检测血清NSE水平,联合检测血清NSE和ProGRP,可有效提高肺癌疾病的诊断效能,并且其中血清ProGRP特异度更高。又如马晓平等的研究称[13],血清NSE和ProGRP均可以作为预测肺癌患者疗效的指标。本次研究结果显示,与对照组比较,研究组患者血清ProGRP、NSE水平均明显更高,此项研究结果说明在诊断晚期NSCLC方面具有一定诊断价值。分析其原因,其中NSE水平异常上升可能与肺泡上皮细胞异常增殖存在关系,肺泡腺体上皮细胞增殖时,存在少部分肿瘤细胞凋亡后,可引起线粒体内含有的NSE分泌至血液中,同时内质网中含有的NSE也会进入血液,导致血清中NSE水平增加。本次研究结果还发现,血清ProGRP、NSE水平与晚期NSCLC患者年龄、性别、吸烟史、临床肿瘤直径、区域性淋巴结转移、肿瘤分化程度及不同ECOG评分无明显的相关性,此项研究结果与某人的研究结果具有一致性[14]。但与晚期NSCLC患者淋巴结转移数目、病理类型、EGFR基因表达有关。相关研究显示[15],肿瘤患者机体内血清肿瘤标志物水平越高,患者的生存预后越差。GRP与受体相互作用后,可通过促进肿瘤细胞生物学行为,如增殖、转移及侵袭等过程,进而参与肺癌疾病进展,而导致肺癌患者预后差的主要原因由于ProGRP的促生长作用。本次研究结果还显示,与单独检测比较,血清ProGRP、NSE、水平联合检测晚期NSCLC患者,误诊率9.52%、漏诊率14.29%均明显更低,表明联合检测血清ProGRP、NSE水平,有利于提高晚期NSCLC诊断效能。

表2 血清ProGRP、NSE水平与NSCLC临床病理特征的关系
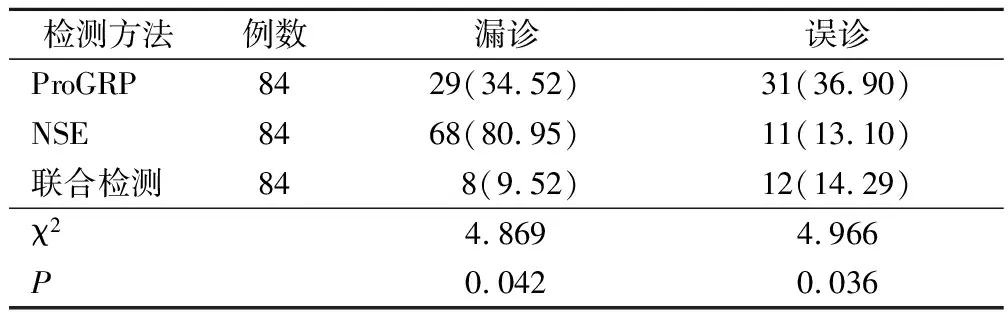
表3 不同检测方法误诊率、漏诊率比较(例,%)

图1 ROC曲线评估血清NSE、ProGRP联合诊断价值
综上所述,血清ProGRP、NSE均与晚期NSCLC病理类型、TNM分期中淋巴结转移数目、EGFR基因型及病理组织类型存在关系,且通过联合检测血清ProGRP、NSE水平,可以有效提高诊断晚期非小细胞肺癌的效能。
