miR-153-3p靶向KLF7基因调控IL-6/STAT3通路抑制食管癌细胞的增殖和转移的机制研究
2023-05-10赵亚培张向苗王秋冬
赵亚培 张向苗 王秋冬
食管癌是消化道常见恶性肿瘤,手术、放射治疗和化疗是目前主要治疗手段,然而其临床疗效均不甚理想[1]。有研究报道miR-153可显著促进食管癌KYSE450细胞和乳腺癌MCF-7细胞自噬[2]。KLF7在人口腔鳞状细胞癌中的过度表达促进细胞迁移和上皮-间质转化[3];KLF7高表达与胃癌预后不良相关,敲低KLF7抑制胃癌细胞迁移[4]。肠道富集的Kruppel样因子在食管鳞状细胞癌中下调表达,与其进展和转移相关[5]。然而miR-153-3p与KLF7调控对食管癌细胞研究机制不清楚,本实验通过miR-153-3p和KLF7的相关表达载体研究其对食管癌细胞的增殖和转移的影响、其靶向调控关系以及可能的作用机制。
1 材料与方法
1.1 材料
人正常食管上皮细胞株HEEC和人食管癌细胞EC9706、Eca-109、EC-1、TE-1购自上海弘顺生物科技有限公司。胎牛血清(FBS)、RPMI-1640培养基购自赛默飞世尔科技中国有限公司;LipofectamineTM2000转染试剂、四甲基偶氮唑盐比色法(MTT)试剂盒购自美国Invitrogen公司;凋亡试剂盒购自碧云天生物;兔抗人KLF7多克隆抗体、兔抗人p-STAT3多克隆抗体、兔抗人STAT3多克隆抗体、兔抗人β-actin多克隆抗体和山羊抗兔IgG购自上海煊翎生物;白细胞介素IL-6试剂盒购自上海联科生物;载体质粒购自北京普瑞金科技有限公司;双荧光素酶报告基因检测试剂盒购自艾博抗(上海)贸易有限公司。
1.2 方法
1.2.1 细胞活化 食管癌细胞(EC9706、Eca-109、EC-1、TE-1)、正常食管上皮细胞株HEEC培养于RPMI-1640培养基(含10%FBS)置于细胞培养箱中。
1.2.2 细胞转染、分组 取对数生长期细胞EC9706,用anti-miR-con、anti-miR-153-3p、miR-con、miR-153-3p、si-con、si-KLF7转染细胞,分别为anti-miR-con组、anti-miR-153-3p组、miR-con组、miR-153-3p组、si-con组、si-KLF7组;将miR-153-3p与pcDNA、miR-153-3p与pcDNA-KLF7共转染细胞,记为miR-153-3p+pcDNA组、miR-153-3p+pcDNA-KLF7组。
1.2.3 RT-qPCR检测KLF7 mRNA和 miR-153-3p水平 总RNA提取提取后,反转录cDNA,根据试剂盒说明书进行PCR。相对表达量用2-△△Ct法计算。
1.2.4 Western Blot检测Kruppel样因子7(KLF7)、磷酸化信号转导与转录激活因子3(p-STAT3)、信号转导与转录激活因子3(STAT3)蛋白表达 加入裂解液提取总蛋白,蛋白浓度用BCA法测定。随后进行电泳,转膜,封闭1 h,4 ℃加一抗(1∶1000)过夜后,PBS洗膜,加二抗(1∶2000)37 ℃孵育2 h,加入显影液显影,利用蛋白条带的吸光度计算蛋白表达量。
1.2.5 MTT检测细胞活性 分别在细胞培养的24 h、48 h、72 h时,加入MTT溶液,培养2 h后,加DMSO混匀,在490 nm波长条件下用酶标仪检测各孔吸光值。
1.2.6 细胞迁移和侵袭实验 细胞培养48 h后重悬细胞。细胞迁移实验:取浓度为(1×105个/mL)细胞悬液100 μL接于Transwell上室,下室加500 μL含血清的培养液,培养24 h,加入固定液固定20 min,PBS冲洗,加入结晶紫染色,显微镜观察并拍照。
侵袭实验:1∶4比例加培养液稀释Matrigel,包被Transwell上室,后续步骤同迁移实验。
1.2.7 ELISA法检测IL-6的表达 取以上各组细胞,离心取上清,后续步骤严格按照ELISA试剂盒说明书进行。
1.2.8 荧光素酶报告基因检测miR-153-3p对KLF7的靶向调控 构建KLF7的3′UTR野生型、突变型基因载体WT-KLF7和MUT-KLF7,取对数期EC9706细胞,待细胞生长至80%融合时将WT-KLF7和MUT-KLF7分别与miR-con和miR-153-3p转染细胞。按照说明书进行检测。
1.3 统计学分析
2 结果
2.1 食管癌细胞中KLF7、miR-153-3p的表达
人食管癌细胞系中KLF7 mRNA和蛋白表达高于正常食管上皮细胞HEEC,miR-153-3p表达水平低于HEEC(P<0.05)(图1,表1)。可见,在食管癌细胞中miR-153-3p呈低表达,KLF7呈高表达。
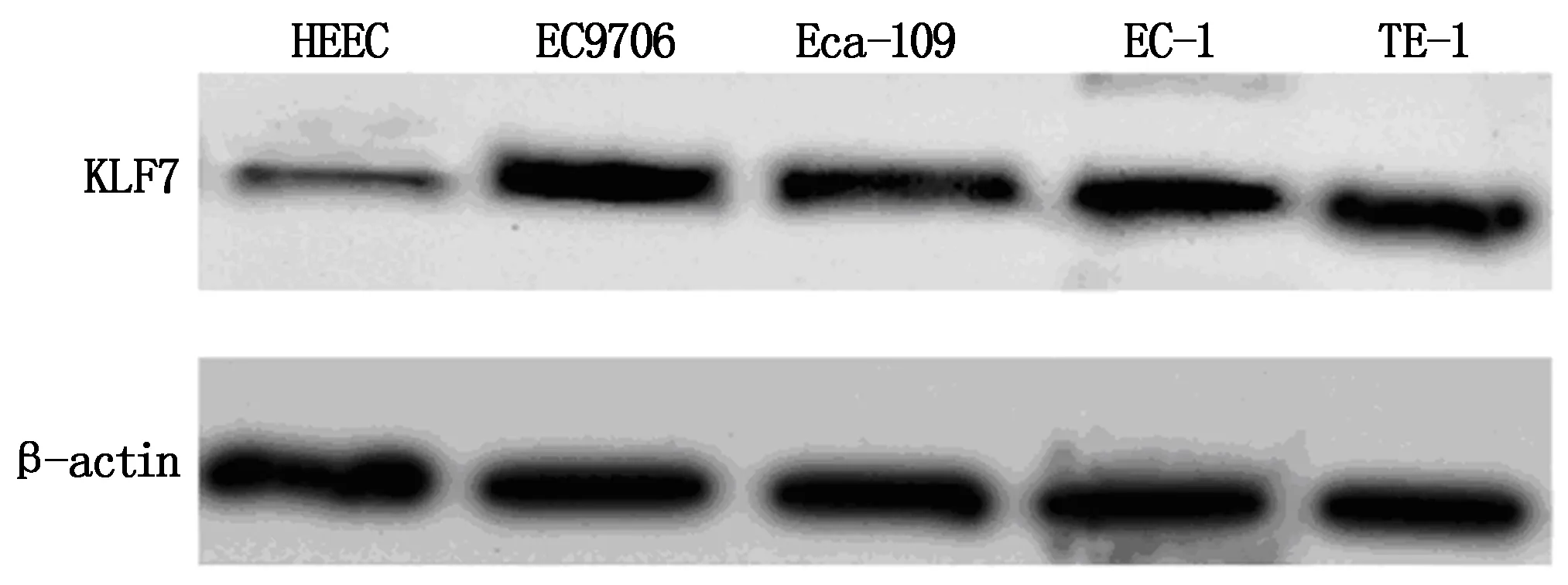
图1 Western blot检测食管癌细胞中KLF7蛋白的表达
2.2 miR-153-3p对EC9706细胞的增殖、迁移和侵袭影响
与miR-con组相比,miR-153-3p组食管癌细胞EC9706活力、迁移和侵袭数量降低(P<0.05)(表2)。可见,miR-153-3p过表达抑制食管癌细胞EC9706的增殖、迁移和侵袭。
2.3 miR-153-3p抑制食管癌细胞EC9706中IL-6/STAT3信号通路
与miR-con组相比,miR-153-3p组食管癌细胞EC9706中IL-6含量显著降低,p-STAT3表达水平显著降低(P<0.05)(图2,表3)。
2.4 miR-153-3p靶向KLF7
图3为KLF7与miR-153-3p存在结合位点。miR-153-3p组WT-KLF7荧光素酶活性低于miR-con组(P<0.05);而MUT-KLF7荧光素酶活性差异不显著,见表4。 miR-153-3p组KLF7表达水平显著低于miR-con

表1 食管癌细胞和人正常食管上皮细胞中miR-153-3p和KLF7的表达
组;anti-miR-153-3p组KLF7表达水平高于anti-miR-con组(P<0.05),见表5。
2.5 沉默KLF7抑制食管癌细胞增殖、转移和IL-6/STAT3信号通路
si-KLF7组食管癌细胞与si-con组相比,细胞活力、迁移和侵袭、KLF7、IL-6、p-STAT3表达水平显著降低(P<0.05)(图4,表6)。可见,沉默KLF7抑制食管癌细胞增殖、转移和IL-6/STAT3信号通路。
2.6 过表达KLF7部分逆转miR-153-3p抑制食管癌细胞增殖、转移和IL-6/STAT3信号通路与miR-con组相比,miR-153-3p组食管癌细胞中KLF7表达水平、细胞活力、迁移和侵袭数量、IL-6含量、p-STAT3表达水平显著降低(P<0.05);与miR-153-3p+pcDNA组相比,miR-153-3p+pcDNA-KLF7组中KLF7表达水平、细胞活力、细胞迁移和侵袭数、IL-6含量、p-STAT3表达水平显著升高(P<0.05)(图5,表7)。
表2 miR-153-3p抑制食管癌细胞EC9706的增殖和转移
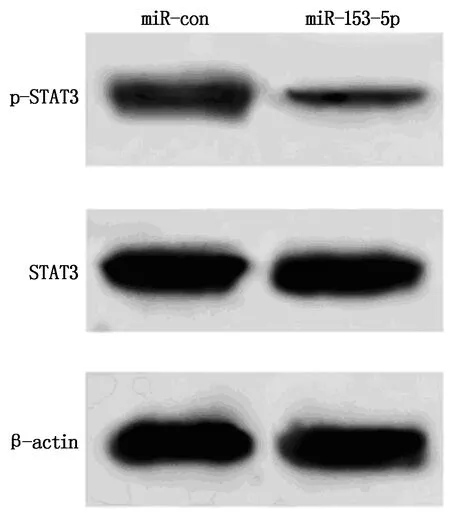
图2 Western blot检测食管癌细胞中p-STAT3和STAT3蛋白的表达
表3 miR-153-3p抑制食管癌细胞EC9706中IL-6分泌、p-STAT3和STAT3蛋白的表达

图3 KLF7与miR-153-3p 互补的核苷酸序列
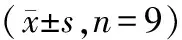
表4 双荧光素酶报告实验
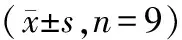
表5 miR-582-5p 调控KLF7蛋白的表达
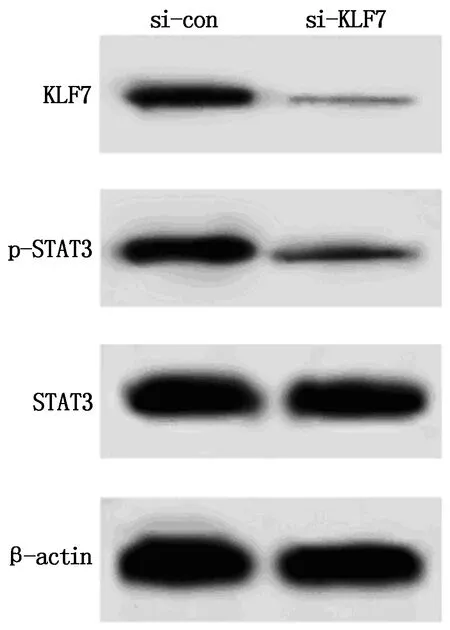
图4 Western blot检测食管癌细胞中KLF7、p-STAT3和STAT3蛋白的表达

图5 Western blot检测食管癌细胞中KLF7、p-STAT3和STAT3蛋白的表达
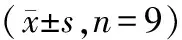
表6 沉默KLF7抑制食管癌细胞EC9706增殖、迁移、侵袭、IL-6分泌、p-STAT3和STAT3蛋白的表达
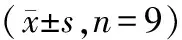
表7 过表达KLF7和转染miR-153-3p对食管癌细胞EC9706增殖、迁移、侵袭、IL-6、p-STAT3和STAT3蛋白水平的影响
3 讨论
食管癌在全球范围内发病率和死亡率均较高,其侵袭性强,预后差,确诊时多为晚期和转移性食管癌,难治愈[6];分子靶向治疗成为其新的治疗方式[7]。miRNA参与多种肿瘤的发生发展过程,如miR-153通过靶向Snail抑制肝细胞癌的上皮-间质转化[8]。circRNA_0084043通过靶向调控miR-153-3p/Snail轴促进恶性黑素瘤细胞进展[9]。miR-153-3p过表达明显降低了急性淋巴细胞白血病的细胞增殖,迁移和侵袭[10]。敲低CASC15表达可以介导miR-153-3p/KLF5通路抑制乳腺癌细胞增殖和上皮间质转化进程[11]。在本研究结果中,miR-153-3p在食管癌细胞中低表达,上调miR-153-3p表达可以降低细胞活性、迁移、侵袭数量。提示上调miR-153-3p抑制食管癌细胞增殖、迁移和侵袭。
KLF7是一种锌指转录因子,在癌症发展中起着重要作用;上调KLF7表达可以促进癌细胞的迁移侵袭,如胶质瘤细胞[12],下调KLF7表达可以抑制坐骨神经损伤后的施万细胞[13]和非小细胞肺癌的癌细胞[14]的上皮间质转化进程。本实验结果发现,KLF7食管癌细胞中高表达,沉默KLF7可降低细胞活性和迁移、侵袭数量。说明KLF7在食管癌可能作为促癌因子起作用,沉默KLF7可抑制食管癌细胞的增殖、迁移和侵袭。miR-153-3p靶向调控KLF7,过表达KLF7能部分回复miR-153-3p对EC9706细胞增殖、迁移、侵袭的作用。说明miR-153-3p通过调控KLF7影响食管癌细胞进展。
白细胞介素6(Interleukin-6,IL-6)是一种重要的炎性因子,与其受体结合可以激活STAT3,而异常活化的STAT3在肿瘤的增殖、侵袭、转移中发挥重要作用[15]。IL-6/STAT3信号通路与肿瘤的发生发展密切相关,研究发现伊拉霉素C通过抑制IL-6诱导的STAT3磷酸化诱导细胞凋亡并抑制三阴性乳腺癌的迁移和侵袭[16]。miRNA-26b抑制IL-6/STAT3信号通路的激活促进肝癌细胞自噬[17]。协同刺激分子B7-H4活化了IL-6/STAT3信号通路,并促进食管鳞状细胞癌细胞增殖[18]。本实验结果显示,miR-153-3p过表达和沉默KLF7均降低了p-STAT3表达水平,且抑制IL-6的分泌。说明miR-153-3p过表达和沉默KLF7抑制了IL-6/STAT3信号通路的激活。而过表达KLF7逆转了miR-153-3p对IL-6/STAT3信号通路的抑制作用,说明miR-153-3p可能通过调控KLF7进而抑制IL-6/STAT3信号通路抑制食管癌细胞增殖、迁移和侵袭。
过表达miR-153-3p可通过调控KLF7/IL-6/STAT3通路抑制食管癌细胞增殖、迁移、侵袭。
