基于细胞骨架差异的心肌细胞纯度快速鉴定方法*
2023-05-10潘丛彬王思琪赵宝清郭西英欧阳昌汉任展宏
潘丛彬,王思琪,赵宝清,尧 青,郭西英,欧阳昌汉,任展宏**,刘 超**
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室)
目前,细胞免疫荧光染色是鉴别心肌细胞类型的常用方法[1-2],然而,此方法对抗体的要求较高,并且具有操作复杂和用时长等较多缺点。因此,摸索出一种简单、快速及有效的区分和鉴别心肌细胞的方法对于心血管疾病研究极为重要。心肌细胞有一个规律排列的细胞骨架网络,以执行心脏收缩功能。这些执行收缩功能的肌原纤维和闰盘都是多蛋白复合物,必须在发育过程中以有规律的方式组装,以保证心脏的功能完整性[3]。而心肌成纤维细胞位于结缔组织网络中,呈细长状,可分泌包括多种胶原在内的大量细胞外基质成分[4]。我们通过使用荧光标记染料Phalloidin(鬼笔环肽)与Tubulin Tracker分别标记微丝和微管,首次发现心肌细胞能被标记,而心肌成纤维细胞不能被标记。基于此,我们为鉴定心肌细胞纯度提供了一种新的方法,可以简便及快速区分心肌细胞与成纤维细胞,并为心血管疾病研究提供了细胞学基础。
1 材料与方法
1.1 实验动物与细胞
Sprague-Dawley(SD)大鼠(出生1~3d,SPF级),雌雄不限,由湖北科技学院医药研究院SPF级动物实验室提供。H9c2与MCFs细胞系购于北纳生物。
1.2 试剂耗材
试剂耗材见表1。

表1 主要试剂与耗材
1.3 主要仪器设备
FV3000激光共聚焦显微镜系统(OLYMPUS),CO2培养箱(Thermo Fisher),倒置显微镜(Nikon)。
1.4 方法
1.4.1 与原代细胞的分离和细胞培养
原代细胞的分离培养参考实验室指南[2],有细微修改,具体操作如下:乳鼠全身75%乙醇消毒,开胸取出心脏,置于4℃预冷的PBS中清洗残余血液。将心脏转移至含有冷的PBS无菌安瓿瓶中,取心尖部位并剪碎成约1mm3的碎片。弃去PBS,加入约10倍体积的0.1%Ⅱ型胶原酶消化液,轻柔吹打后静置,待组织块自然沉降后,弃去上清液。重复上述消化过程,每次消化后的上清液收集于37℃等体积的含20%胎牛血清的DMEM培养基,终止胶原酶消化到组织消化完全。将收集到的细胞悬液在室温条件下以1000rpm,5min离心,弃去上清液。加入完全培养基重悬细胞沉淀,用40μm细胞过滤网过滤细胞悬液。将细胞接种于100mm培养皿中进行差速贴壁90min。收集上层未贴壁的原代大鼠心肌细胞(neonatal rat primary cardiomyocytes,NRCM)于50mL无菌离心管中,加入终浓度为0.1mmol/L的5-溴脱氧尿嘧啶,并接种于28.2mm玻底培养皿中,37℃,5% CO2培养48h。更换含0.1 mmol/L 5-溴脱氧尿嘧啶的完全培养基,继续培养24h后用于后续实验。差速贴壁后,贴壁的细胞主要是原代大鼠心肌成纤维细胞(neonatal rat cardiac fibroblasts,NRCF),向NRCF中加入适量完全培养基,将这两种细胞放入37℃、5% CO2培养箱中,48h更换一次培养基。待NRCF培养至约90%融合度时,用0.25%胰蛋白酶消化传代(1∶2)进一步纯化。将第二代NRCF接种于28.2mm玻底培养皿中用于后续实验。H9c2细胞系(北纳生物,BNCC340098)在含10%胎牛血清和1%青链霉素的DMEM培养基中培养。Mouse cardiac fibroblasts细胞系(MCFs,北纳生物,BNCC340098)在含10%胎牛血清和1%青链霉素的RPMI-1640培养基中培养。
1.4.2 细胞存活率鉴定
取0.2mL第二次差速贴壁的心肌细胞悬液,加入0.5mL 0.4%台盼蓝染色液和0.3mL PBS,混匀后静置5min。取适量混合液与细胞计数板,显微镜下计数活细胞数。死细胞为蓝色,活细胞透明。细胞成活率(%)=(总细胞数-蓝色死细胞数)/总细胞数×100%。
1.4.3 免疫荧光染色
弃去玻底培养皿中培养基,PBS洗涤2次。用4%多聚甲醛室温固定15min,PBS洗涤3次。加入0.1% Triton X-100室温穿透20min,PBS洗涤1次。10%BSA室温封闭1h,PBS洗涤3次,每次5min。滴加适宜稀释比的一抗室温孵育1h,PBS洗涤3次,每次5min。滴加适宜稀释比的带荧光基团偶联的山羊抗兔IgG避光室温孵育1h,PBS洗涤3次,每次5min(若一抗带有荧光基团偶联,此步可省略)。滴加适量体积ProlongTMGold antifade reagent with DAPI封片,共聚焦荧光显微镜观察和拍照。
1.4.4 Phalloidin固定染色
弃去玻底培养皿中培养基,PBS洗涤2次。用4%多聚甲醛室温固定15min,PBS洗涤3次。加入0.1% TritonX-100室温穿透20min,PBS洗涤1次。滴加适量体积100nM Acti-stainTM488 Fluorescent Phalloidin室温染色30min,PBS洗涤3次,滴加适量体积ProlongTMGold antifade reagent with DAPI封片,共聚焦荧光显微镜观察和拍照。
1.4.5 Tubulin Tracker 活细胞染色
弃去培养基,PBS洗涤2次。加入适量体积的10μg/mL的Hoechst 33342染色液,37℃,5%CO2孵育20min,弃去染色液,用PBS洗涤3次。加入适量体积1×Tubulin TrackerTMDeep Red(用基础培养基配制),37℃ 5% CO2孵育30min,弃去染色液,用含1%丙磺舒的PBS洗涤3次。共聚焦荧光显微镜观察和拍照。
2 结 果
2.1 细胞存活率鉴定和形态观察
台盼蓝染色法鉴定NRCM存活率达85%以上。NRCM分离培养72h,通过显微镜观察到心肌细胞相互连接形成片状或细胞簇,且有搏动(图1A)。NRCF分离培养48h后,通过显微镜观察到细胞伸展呈细长梭形且排列紧密,偶见混有少量心肌细胞形成的可搏动细胞簇(图1B),传代后簇状细胞团消失(图1C)。

A:培养72h的原代大鼠心肌细胞,可见搏动细胞簇(箭头所指);B: 培养48h的NRCF;C:第二次传代后的NRCM图1 NRCM与NRCF的形态图(比例尺=100 μm)
2.2 传统免疫染色法鉴定NRCM与NRCF
为了鉴定所提的原代心肌细胞类型,我们采用传统的免疫荧光染色法进行鉴定,即用与中间丝起反应的抗波形蛋白(Vimentin)抗体特异性标记NRCF和抗α-actinin抗体标记NRCM。结果表明,NRCM能够被抗α-actinin抗体所标记,而不能被抗Vimentin抗体所标记。NRCF可以被抗Vimentin抗体所标记,而不能被抗α-actinin抗体所标记(图2)。此实验结果显示本研究中所提纯的NRCM与NRCF纯度较高。
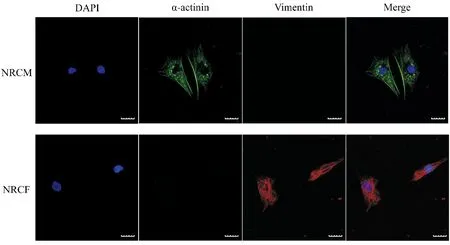
蓝色为细胞核,红色为α- actitinin,绿色为Vimentin图2 免疫荧光染色NRCM和NRCF的鉴定(比例尺= 20 μm)
2.3 Phalloidin固定染色鉴定NRCM与NRCF
我们使用微丝的特异性标记物Phalloidin对NRCM与NRCF进行染色标记。结果发现,在NRCM中存在微丝骨架网络,微丝排列整齐且分布均匀,而NRCF未能被Phalloidin染色标记(图3)。此实验结果直观揭示了NRCM和NRCF的微丝骨架差异。
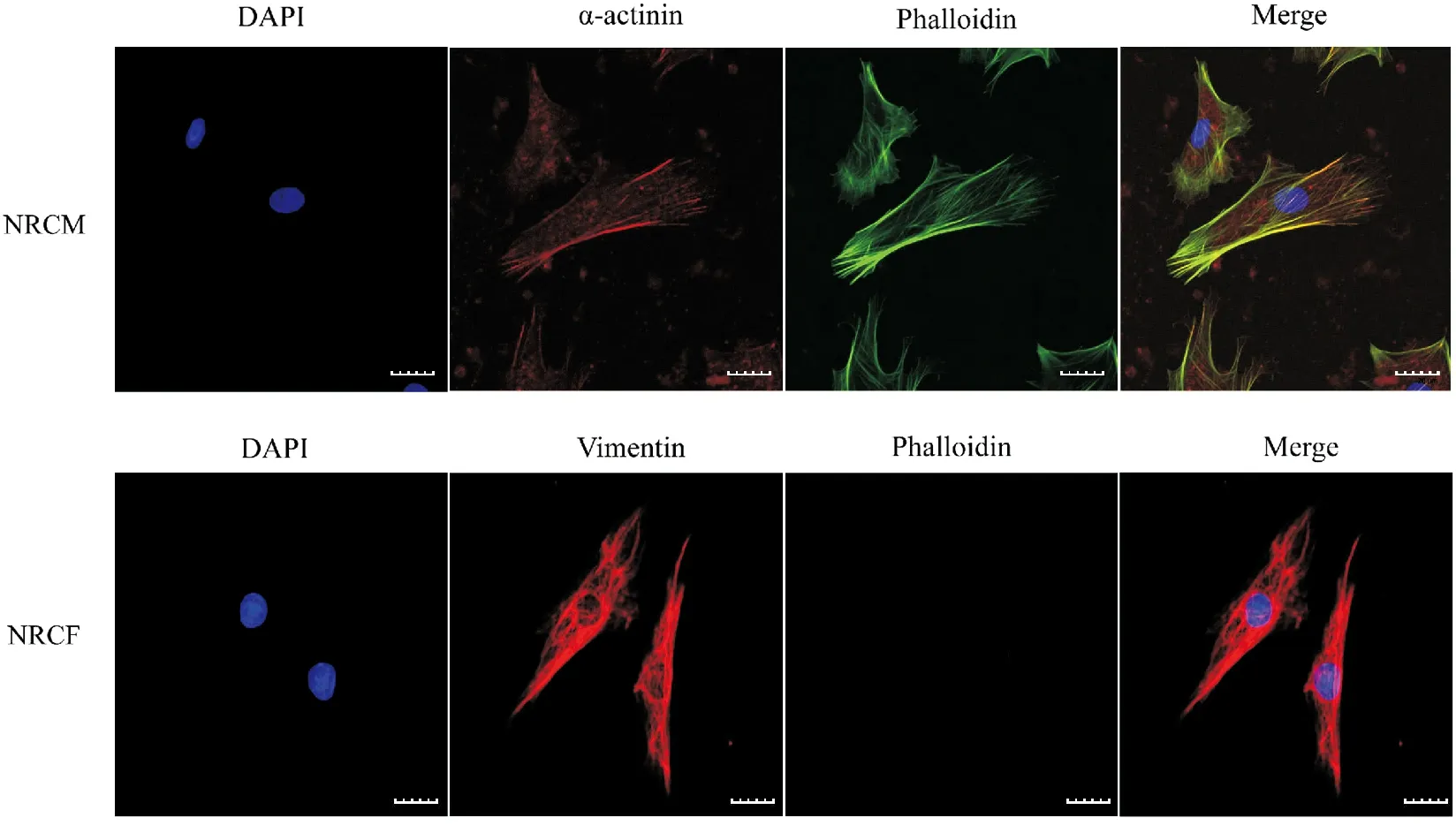
蓝色为细胞核,红色为α- actitinin (NRCM) 或Vimentin (NRCF) 特异性染色,绿色为微丝图3 phalloidin固定染色鉴定NRCM和NRCF(比例尺= 20 μm)
2.4 Tubulin Tracker染色鉴定NRCM与NRCF
我们使用微管的特异性标记物Tubulin Tracker对NRCM与NRCF进行染色标记。结果显示,NRCM内存在微管骨架网络,而NRCF未能被Tubulin Tracker标记(图4)。微管染色的结果与微丝类似,进一步证实基于细胞骨架差异的染色方法可用于鉴定NRCM与NRCF。

蓝色为细胞核,红色为微管图4 Tubulin Tracker染色鉴定NRCM和NRCF(比例尺= 20 μm)
2.5 Phalloidin固定染色鉴定H9c2和MCFs细胞系
为了验证此方法是否适用于心肌细胞系的鉴定,我们使用Phalloidin对H9c2和MCFs进行染色标记。实验结果显示,H9c2可被Phalloidin染色标记,细胞内呈现清晰可见的微丝骨架网络,MCFs无法被Phalloidin染色(图5)。本实验结果表明基于微丝骨架差异的鉴定方法也适用于MCFs与H9c2的鉴定。
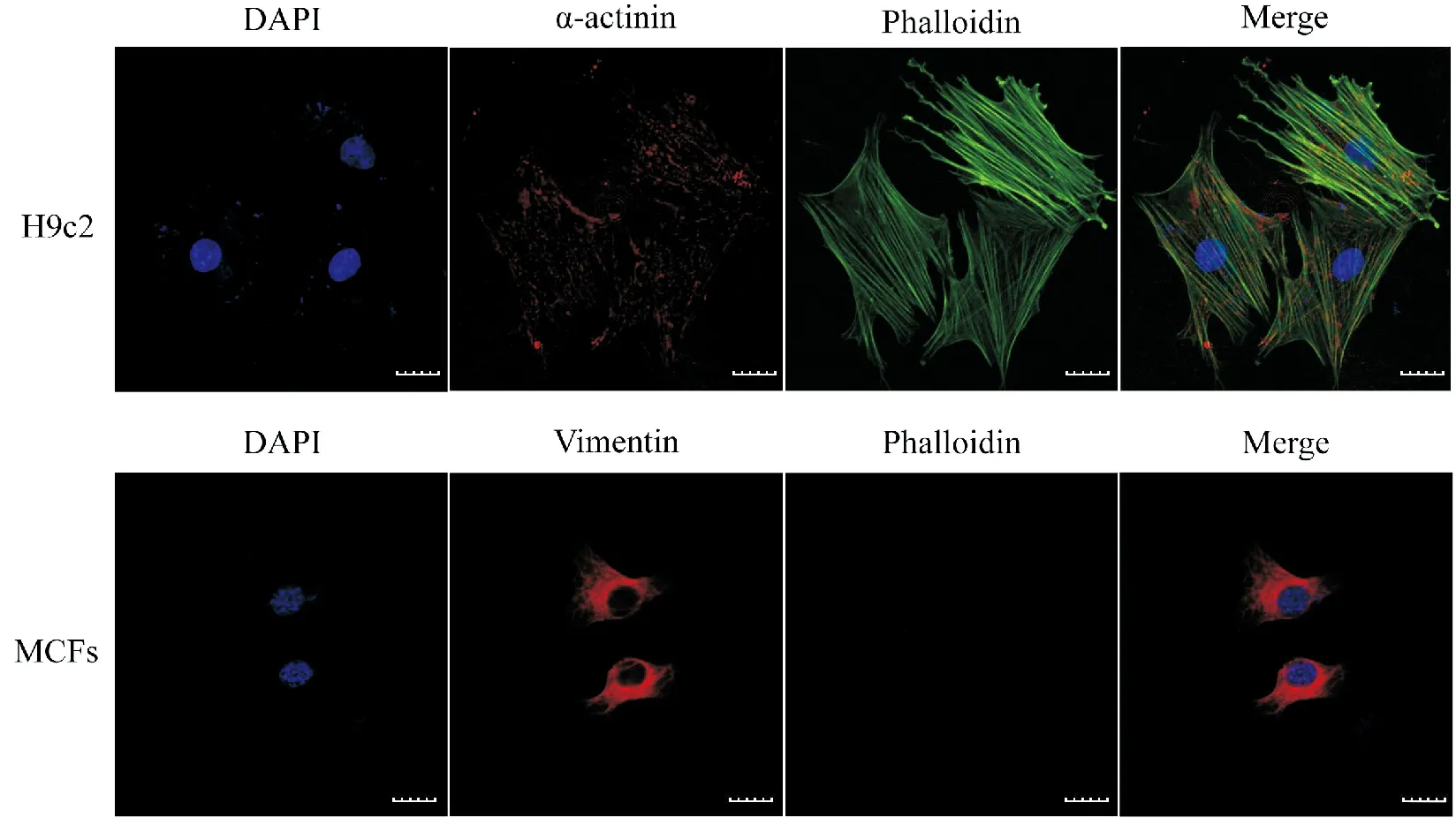
蓝色为细胞核,红色为α- actitinin (H9c2) 或Vimentin (MCFs),绿色为微丝图5 Phalloidin固定染色鉴定H9c2和MCFs(比例尺= 20 μm)
2.6 Tubulin Tracker染色鉴定H9c2和MCFs细胞系
我们使用Tubulin Tracker对H9c2细胞系和MCFs细胞系进行标记,结果显示,H9c2细胞系能被Tubulin Tracker标记,呈现出清晰可见的微管骨架网络,而MCFs细胞系被Tubulin Tracker标记的微管骨架较少且暗淡,绝大多数细胞未观察到微管骨架网络(图6)。本实验结果进一步证实,通过观察微管骨架的差异可应用于H9c2与MCFs的鉴定。

蓝色为细胞核,红色为微管图6 Tubulin Tracker染色鉴定H9c2和MCFs(比例尺= 20 μm)
2.7 三种鉴定方法的比较
免疫荧光染色法操作过程需6步,耗时245.5min,Phalloidin固定染色法操作过程需4步,耗时65.5min,Tubulin Tracker染色法操作过程需2步,耗时50min。Phalloidin标记微丝或Tubulin Tracker标记微管的实验方法具有实验步骤简便及耗时较短等优点 (见表2)。
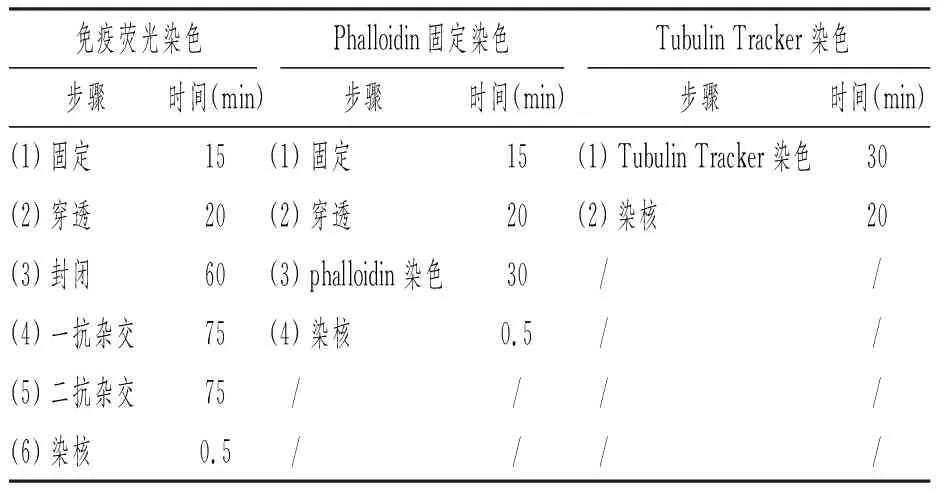
表2 三种鉴定方法的比较
3 讨 论
自1963年Harary和Farley等人在体外首次成功分离和培养心肌细胞之后,心肌细胞分离培养技术得到不断发展与完善[1,5-7]。因为心肌细胞培养具有可视化、精确靶向、简单、经济、自发搏动性、不受神经和体液因素影响等优点[6],所以,体外分离和培养的心肌细胞与心肌成纤维细胞在心血管疾病的研究中被广泛应用[8-9]。由于心脏主要是由心肌细胞与成纤维细胞组成[10],因此,在分离培养心肌细胞的过程中常常会出现成纤维细胞的污染,最终影响实验结果的可信度。有研究表明[1,6],在提取原代心肌细胞和心肌成纤维细胞的过程中,通过梯度浓度的percoll液离心,以及添加5-溴脱氧尿嘧啶有利于提高心肌细胞的纯度,而针对心肌成纤维细胞可通过传代进行纯化[2]。
近年来,体外培养心肌细胞和心肌成纤维细胞已成为心血管疾病研究过程中至关重要的一环[8-9]。在细胞的分离提纯过程中,常常出现这两种细胞的交叉污染,因此,需要对细胞进行纯度鉴定。传统的心肌细胞鉴定方法主要针对心肌细胞内特异性蛋白进行免疫荧光标记,进而达到鉴定效果。但是,传统鉴定方法存在操作过程繁锁以及用时较长等缺点。
在本项研究中,我们采用Phalloidin固定染色和Tubulin Tracker活细胞染色分别对心肌细胞与心肌成纤维细胞的微丝和微管进行标记。结果发现心肌细胞既能被Phalloidin标记,也能被Tubulin Tracker标记;相比较之下,心肌成纤维细胞既不能被Phalloidin标记,也不能被Tubulin Tracker标记。这可能是由于两种行使不同功能的细胞存在细胞骨架结构的差异。基于此,我们首次提出并确定鬼笔环肽固定染色法和Tubulin Tracker活细胞染色作为心肌细胞鉴定的方法。与传统的免疫荧光染色法比较,新鉴定方法具有实验步骤简便及耗时较短等优点,大幅度节约实验时间以及提高工作效率。另外,Tubulin Tracker可满足活细胞的实验需求,使用Phalloidin标记微丝或Tubulin Tracker标记微管的实验方法可快速鉴定和区分心肌细胞与心肌成纤维细胞,将有助于心血管疾病的细胞学研究。
