超声参数联合血清ProGRP、CEA及SF诊断乳腺癌的临床价值
2023-05-10苏巧霞刘艳群
苏巧霞,刘艳群
(甘肃省第三人民医院超声医学科 甘肃 兰州 730000)
乳腺癌是临床常见恶性肿瘤,其发病机制与遗传易感性、免疫功能紊乱等多种因素密切相关[1]。据2020 年全球癌症统计报告显示,全球范围内乳腺癌新发病例226.1万,约占总体癌症发病的11.7%,新增死亡68.5 万,约占总体癌症死亡的6.9%[2]。因此早期筛查、诊断、治疗是改善乳腺癌患者预后的重要因素。随着影像学技术的发展,超声检查借助安全无创、组织分辨率高等优势,已成为乳腺病变的主要检查手段,但结果具有一定主观性[3-4]。血清肿瘤标志物在肿瘤早期诊断的作用已得到临床广泛认可,其中血清胃泌素释放肽前体(ProGRP)、癌胚抗原(CEA)及铁蛋白(SF)在胃肠道肿瘤、肺癌等多种恶性肿瘤中异常高表达,且表达水平与临床病理参数及预后密切相关[5-6]。鉴于此,本研究选取48例乳腺癌患者、50例乳腺良性增生患者和50名健康志愿者为研究对象,比较各组超声检查结果及血清ProGRP、CEA、SF表达水平,旨在探讨超声参数联合血清ProGRP、CEA及SF对乳腺癌的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年7月—2020年7月甘肃省第三人民医院收治的48例乳腺癌患者(乳腺癌组)及50例乳腺良性增生患者(乳腺良性病变组)为研究对象,另选取50 名健康志愿者为对照组。乳腺癌组患者年龄33~76岁,平均(55.26±4.33)岁;肿瘤类型:浸润性导管癌30例,导管原位癌12例,其他6例;TNM分期:Ⅰ~Ⅱ期33例,Ⅲ~Ⅳ期15例。乳腺良性病变组患者年龄32~75岁,平均(55.08±4.09)岁;乳腺增生36例,乳腺纤维瘤14例。对照组年龄29~73岁,平均(54.66±3.98)岁。三组年龄资料比较差异无统计学意义(P>0.05),有可比性。受试者均知情同意本研究。
纳入标准:①所有乳腺癌、乳腺良性增生患者均经组织病理学或活检穿刺确诊;②均接受超声检查,临床资料完整者。排除标准:①合并其他系统原发性恶性肿瘤者;②合并严重肝、肾功能损害者;③合并血液系统疾病或存在大出血倾向者;④哺乳期或妊娠期妇女;⑤ 组织标本污染或缺失者;⑥合并精神系统疾病者。
1.2 方法
超声检查:采用美国GE公司生产的LOGIQ-E9彩色超声诊断仪,探头频率为10 MHz,所有受试者均取仰卧位,充分暴露两侧腋窝及乳房组织,利用探头以乳头为中心呈放射状全方位扫查乳腺,并扫查腋窝、锁骨上下窝淋巴结,当发现可疑病灶时,需观测病灶位置、形态、结构及回声特点,着重观测血流动力学特征,并选取感兴趣区,由1名超声科医师记录最大血流量(maxi-mum flow value,Vmax)、血流阻力指数(resistance index,RI)、搏动指数(pulse index,PI),每个指标检测3次,取平均值。
血清ProGRP、CEA及SF检测:采集三组受试者空腹静脉血5 mL,置于抗凝试管中,以15 cm离心半径,3 000 r/min,离心10 min分离提取血清;采用电化学发光免疫分析法检测血清胃泌素释放肽前体(pro-gastrinreleasing,ProGRP)、癌胚抗原(carcino-embryonic antigen,CEA)水平,采用化学发光免疫法检测铁蛋白(serum ferritin,SF)水平。
1.3 统计学方法
采用SPSS 26.0统计软件处理数据,符合正态分布的计量资料采用()表示,两组间比较采用t检验,多组间采用方差分析;计数资料以频数(n)、百分率(%)表示,采用χ2检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析超声参数联合血清ProGRP、CEA及SF对乳腺癌的诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 各组超声参数水平比较
乳腺癌组超声参数Vmax、RI、PI水平均显著高于乳腺良性病变组和对照组(P<0.01),见表1。
表1 各组超声参数水平比较(± s)

表1 各组超声参数水平比较(± s)
注:与对照组比较,①P<0.05;与乳腺良性病变组比较,② P < 0.05。
组别 例数 Vmax m/s RI PI乳腺良性病变组 50 10.77±3.97① 0.70±0.16① 1.20±0.20①乳腺癌组 48 15.91±5.40①② 1.01±0.35①② 1.60±0.40①②对照组 50 9.05±2.06 0.60±0.09 0.98±0.14 F 38.290 43.578 66.981 P<0.001 <0.001 <0.001
2.2 各组血清ProGRP、CEA及SF水平比较
乳腺癌组血清ProGRP、CEA及SF均显著高于乳腺良性病变组和对照组(P<0.01),见表2。
表2 各组血清ProGRP、CEA及SF水平比较(± s)
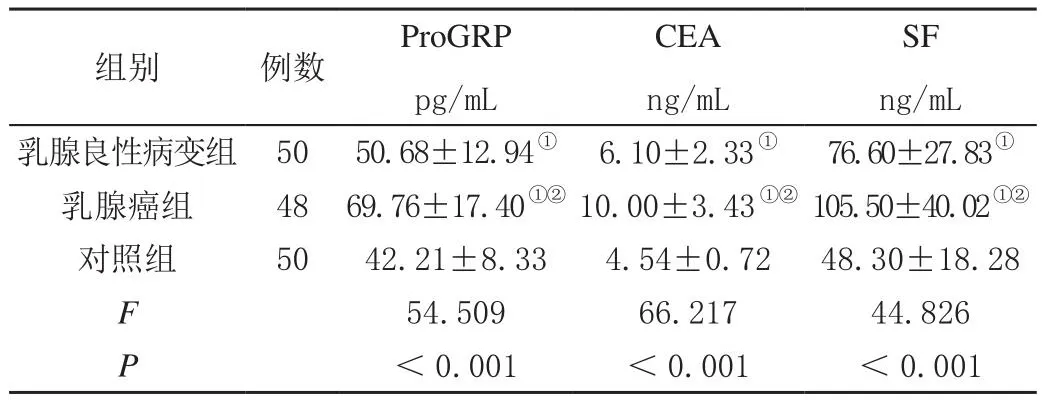
表2 各组血清ProGRP、CEA及SF水平比较(± s)
注:与对照组比较,①P<0.05;与乳腺良性病变组比较,②P<0.05。
组别 例数 ProGRP pg/mL CEA ng/mL SF ng/mL乳腺良性病变组 50 50.68±12.94① 6.10±2.33① 76.60±27.83①乳腺癌组 48 69.76±17.40①② 10.00±3.43①② 105.50±40.02①②对照组 50 42.21±8.33 4.54±0.72 48.30±18.28 F 54.509 66.217 44.826 P<0.001 <0.001 <0.001
2.3 超声参数联合血清ProGRP、CEA及SF对乳腺癌的诊断价值
结果显示,超声参数联合血清ProGRP、CEA及SF诊断乳腺癌的AUC为0.979,预测灵敏度、特异度分别为93.8%、92.0%,均高于各项指标单独检测,见表3、图1。
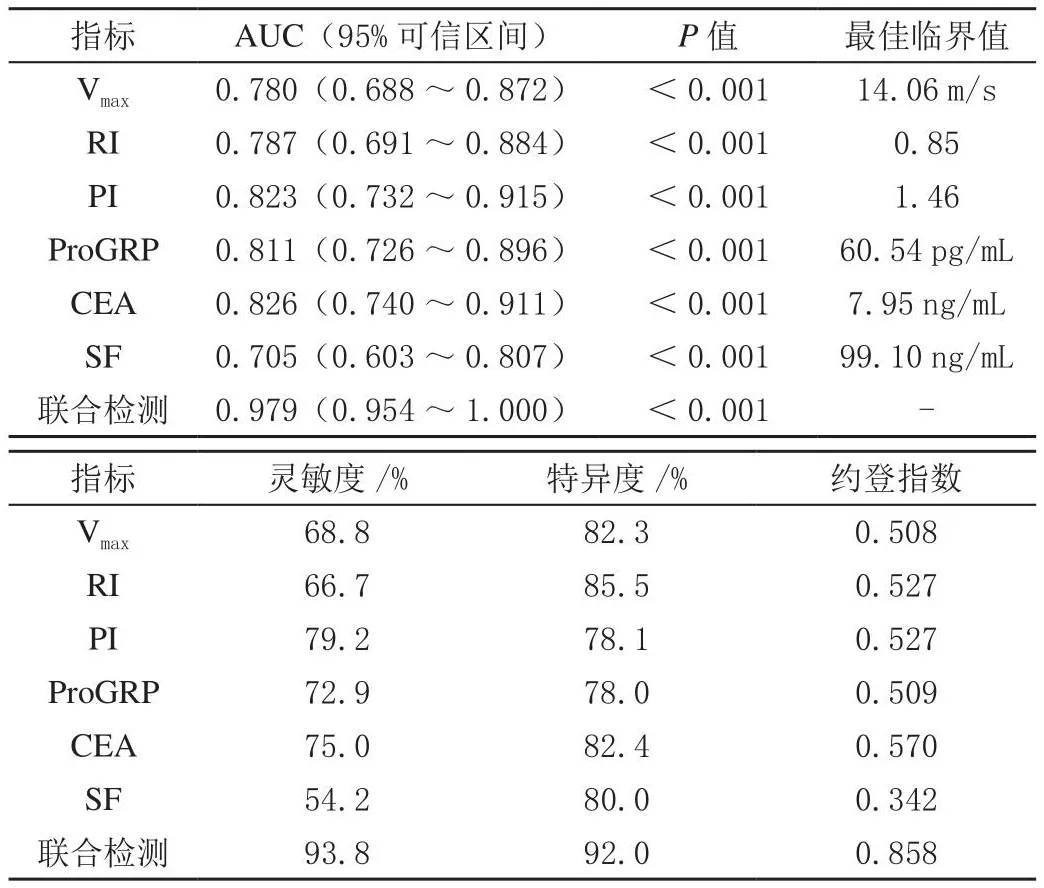
表3 ROC曲线分析超声参数联合血清ProGRP、CEA及SF对乳腺癌的诊断价值
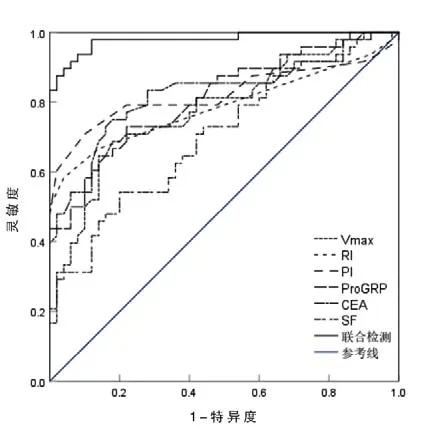
图1 超声参数联合血清ProGRP、CEA及SF诊断乳腺癌的ROC曲线
3 讨论
乳腺癌是一种发生于乳腺腺上皮组织的恶性肿瘤,患病风险和死亡率均较高,由于其发病较为隐匿,且组织学形态、分子分型均具有强异质性,故早期诊断较为困难,随着病情进一步发展可侵犯周围组织,甚至发生远处转移,也是导致预后不良的重要因素。因此,早期筛查和诊断乳腺癌,对改善患者预后、延长生存时间具有重要意义。
超声是临床诊断乳腺病变的主要影像学手段之一,其软组织分辨率高、可重复性强,可获得乳腺任意断面图像,并可通过评价乳腺病变血供情况提供临床诊断信息。另外,超声探头频率较高,可根据乳腺形态自动调节聚焦范围、深度等,优化图像质量,有助于提高病变检出率,减少假阳性结果。但超声检查结果具有一定的主观性,导致结果可能发生误差,故在进行乳腺癌筛查时需与其他检查手段联合应用。本研究结果显示,乳腺癌组超声参数Vmax、RI、PI水平均显著高于乳腺良性病变组和对照组(P<0.01),与张琳颖等[7]研究报道一致。考虑原因主要是:乳腺癌作为血管依赖性肿瘤,其病灶内部血管网络复杂、分布不均,进而导致血管微循环、组织间隙容量明显增大,故超声参数Vmax、RI、PI水平显著升高。
随着临床研究的深入,多项研究证实,无论是乳腺癌的发生还是侵袭转移过程中均伴有细胞因子异常表达现象[8-9]。ProGRP是近年来发现的新型肿瘤标志物,作为促胃液素释放肽的前体,广泛存在于神经内分泌细胞中,其半衰期更长、更稳定,故对于神经内分泌细胞增殖诱发的非小细胞肺癌的诊断效能已得到临床广泛认可[10]。新近研究也表明,乳腺癌患者血清ProGRP表达水平上调,且与肿瘤TNM分期、远处转移等较高的肿瘤负荷状态有关[11]。CEA是临床中经典的血清肿瘤标志物,对乳腺癌的早期诊断及预后评估具有重要应用价值[12]。但也有研究表明,单独应用CEA筛查乳腺癌的阳性表达率仅为58.00%,在早期乳腺癌患者中阳性表达率更低[13]。由此可见,单独的一种肿瘤标志物检测不足以满足临床诊断需求。SF是一种血清蛋白质,可参与调控机体细胞代谢及结合铁元素。多种实体恶性肿瘤可促进铁蛋白异构体的合成、分泌,导致血清SF水平异常增高。也有研究表明,乳腺癌患者血清SF表达水平显著高于乳腺良性增生患者及健康人群,并与肿瘤细胞的恶性生物学行为密切相关,充分说明SF参与乳腺癌的发生及发展[14]。本研究中乳腺癌组患者血清ProGRP、CEA及SF均显著高于乳腺良性病变组和对照组(P<0.01)。说明乳腺癌患者血清ProGRP、CEA及SF表达水平显著升高,三者可用于辅助诊断乳腺癌。另外,本研究通过绘制ROC曲线发现,超声参数联合血清ProGRP、CEA及SF诊断乳腺癌的AUC为0.979,预测灵敏度、特异度均大于90.0%,且高于各项指标单独检测。说明超声参数联合血清肿瘤标志物对乳腺癌的诊断效能更佳,也可使临床获得更为全面的参考信息。
综上所述,超声参数联合血清ProGRP、CEA及SF可提高乳腺癌的诊断灵敏度、特异度,可作为早期筛查乳腺癌的有效指标。
