抑郁症与双侧前额叶区能量代谢、脑缺血灶的关系研究
2023-05-10王凤寒王成伟通信作者
王凤寒,王成伟(通信作者)
(石河子大学第一附属医院CT/MRI室 新疆 石河子 832000)
作为一种常见的且严重损害身心健康的精神障碍类疾病,抑郁症(major depressive disorder,MDD)会对患者心理、职业和家庭功能产生严重的影响。特别是在全球新型冠状病毒大流行期间,MDD人数大幅增加[1]。在MDD诊断过程中,对MDD真正的发病机制认识不清晰[2]。而抑郁症的全基因组关联研究通常难以确定相应的特定遗传变异或主观性和潜在变异性水平[3]。迫切需要具有更客观性的诊断工具或方式,以改善目前主要依靠症状自我报告和临床访谈的精神病学实践。MDD的诊断仍然依赖于单个临床医生的临床判断,MRS是磁共振波谱技术和磁共振成像的结合,该技术可以无损害监测某一个区域代谢的情况,并且对某些疾病早期的诊断、早期病理生理特征均有一定的临床应用价值[4]。近些年,研究表明,抑郁症患者的双侧前额叶NAA/Cr、Cho/Cr值与健康人群相比存在显著差异[5]。为了进一步探究抑郁症患者的脑部代谢情况,本研究开展头颅MRI及MRS影像学特征分析,为抑郁症患者的医学辅助诊断,提供重要的科学依据。
1 资料方法
1.1 一般资料
选取2020年10月—2022年10月在石河子大学第一附属医院就诊的门诊及住院首次发病未经治疗的MDD患者79例,设为MDD组,其中男33例,女46例;患者年龄24~48岁,均龄(41.2±6.5)岁;平均受教育年限(12.24±2.78)年;汉密尔顿抑郁量表-24(HAMD-24)平均评分(38.53±5.06)分。另选取同期60名健康者为对照组,包括男26名,女34名,年龄24~49岁,均龄(39.07±7.43)岁;平均受教育年限(10.98±3.44)年;HAMD-24平均评分(4.67±1.52)分。两组受试者年龄、性别、教育程度差异均无统计学意义(P>0.05)。纳入对象均自愿参加并且签署知情同意书。
抑郁组纳入标准:①汉密尔顿抑郁量表(24-item Hamilton Depression Scale,HAMD-24)评分大于20 分;②年龄范围为18~65岁;③杨氏躁狂状态评定量表(YMRS)评分小于6分;④入组前1个月未服用过任何精神科类的药物者;⑤右利手;⑥初中及以上文化水平者。排除标准:①其他任何类型精神障碍的患者;② 伴颅脑损伤脑部的器质性疾病者;③酒精、其他药物依赖者;④妊娠期及哺乳期女性;⑤近期接受过电休克治疗或使用过长效抗精神病药物;⑥磁共振扫描禁忌者。
对照组纳入标准:①健康成年人,年龄18~65岁;②HAMD-24评分<8分;③YMRS评分<6;④右利手;⑤初中及以上文化水平者。排除标准:①任何类型精神障碍的患者;②伴颅脑损伤脑部的器质性疾病;③酒精、其他药物依赖者;④妊娠期及哺乳期女性;⑤磁共振扫描禁忌者。
1.2 方法
所有检查均采用飞利浦1.5T磁共振扫描仪器,使用标准的头部线圈。自旋回波扫描序列包含矢状位 T2WI(TR/TE=3 647 ms/100 ms) 和 T1WI(TR/TE=476 ms/15 ms)轴位层厚5 mm,激发次数为128。1H-MRS采用快速T2WI轴位及冠状位定位层厚为5 mm无间隔。结合轴位及冠状位找到双侧的前额叶感兴趣区VOI定位在双侧的前额叶为正方体,体素大小为20 mm×20 mm×20 mm。结合轴位及冠状位分别确定双侧的前额叶VOI为正方体,体素大小为20 mm×20 mm×20 mm。选择VOI时应该尽可能地避开脑沟裂、骨质及脂肪组织。
1.3 统计学方法
采用SPSS 26.0统计软件分析数据。符合正态分布的计量资料以均数±标准差()表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验;针对P<0.05的指标行ROC曲线分析,以最大约登指数作为诊断阈值,计算ROC曲线下面积(AUC)。对差异有统计学意义的指标行多元Logistic回归分析,建立模型进行预测,并对预测模型进一步行ROC曲线分析。0.5<AUC≤0.7意味着价值相对偏差,AUC>0.7则意味着价值较为理想。
2 结果
测量两组双侧海马肌酸(Cr)、N-乙酰天门冬氨酸(NAA)、胆碱(Cho)峰下面积。MDD组出现额叶、额顶叶的多发小缺血灶比例显著高于对照组(P<0.01);两组的其他部位出现缺血灶的比例差异无统计学意义(P>0.05),见表1。双侧MDD前额叶脑白质中的NAA/Cr、CHo/Cr代谢物水平显著低于对照组(P<0.01),见表2,由双侧前额叶代谢产物的比值预测MDD的ROC曲线下面积显示为:左侧NAA/Cr、右侧NAA/Cr、左侧Cho/Cr、右侧Cho/Cr曲线下面积分别为0.866、0.880、0.805、0.830(P<0.05),灵敏度分别为62.0%、60.8%、53.2%、62.0%;特异度分别为95.0%、83.3%、100.0%、86.7%,见图1、表3。
表2 双侧前额叶1H-MRS相关代谢产物分析(± s)

表2 双侧前额叶1H-MRS相关代谢产物分析(± s)
组别 NAA/Cr(左侧) Cho/Cr(左侧)MDD 组(n=79) 1.52±0.07 1.54±0.04对照组(n=60) 2.02±0.05 1.64±0.07 t 46.947 13.811 P<0.001 <0.001

表2 (续)
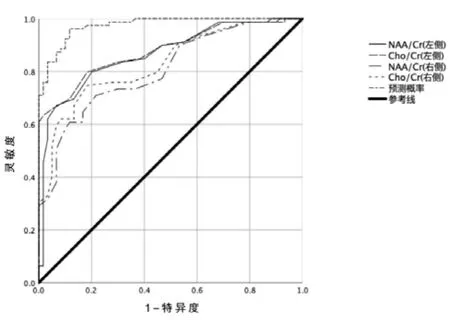
图1 双侧前额叶代谢指标的ROC曲线
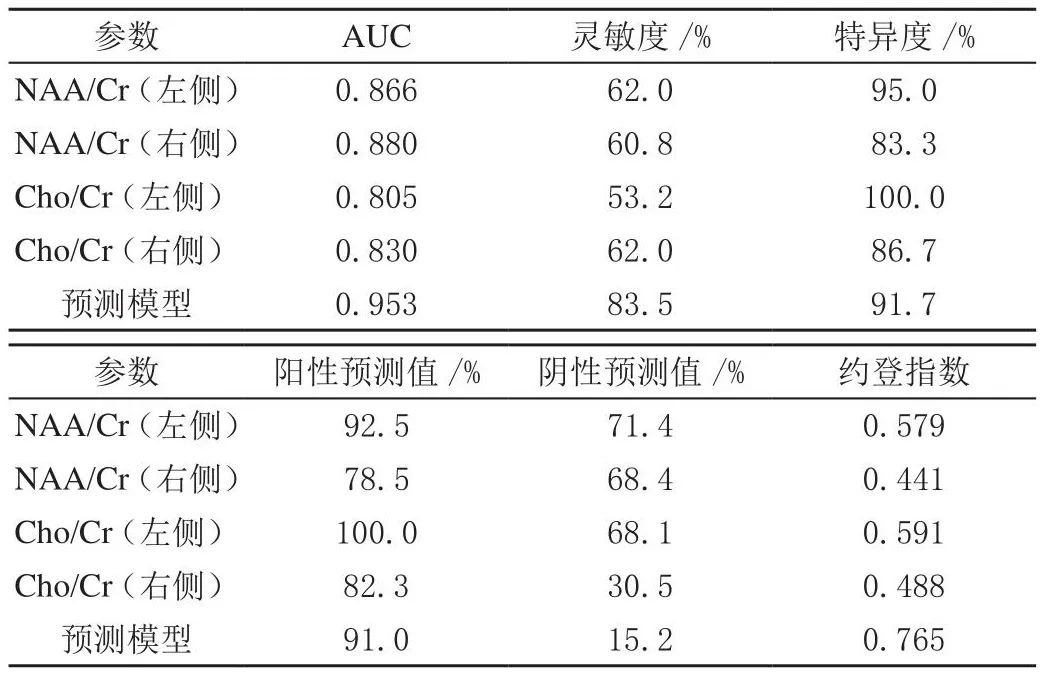
表3 双侧前额叶脑代谢指标诊断分析
3 讨论
在疾病早期不受药物干扰的情况下,MMD患者中较低水平的NAA/Cr、Cho/Cr发生在前额叶的白质中,其中,双侧前额叶NAA/Cr及Cho/Cr值的AUC>0.7,意味着预测价值理想。MDD患者的结构MRI研究已经发现白质高信号影增加在额叶、额顶叶皮质下区域是最常见及最严重的;与本研究中,使用多体素MRS,仅对包含在白质区域内的体素进行采样。主要发现是MMD患者的MRS测定的较低水平的神经化学物质发生在前额叶白质,额叶、额顶叶的脑缺血灶与MDD相关的观点相同,另外,有研究发现MDD中白质完整性和皮质-皮质下回路的破坏[4],本文结果支持此观点。在这项研究中,与健康受试者相比,在双侧前额叶脑白质中观察到MDD患者的NAA/Cr值比较低。NAA被认为几乎仅存在于神经元及其树突和轴突延伸中,而不存在于神经胶质细胞中[6]。NAA信号提供了神经元和轴突完整性的标记。由于这个原因,NAA水平变化表示该区域内的神经元和/或轴突群体减少,或者至少是神经元和/或轴突功能障碍。然而,最近的研究表明NAA水平可以在成熟的少突胶质细胞中表达[7]。已知少突胶质细胞在灰质中充当神经元卫星并在白质中形成髓鞘[8]。目前,关于MDD患者前额叶NAA的研究存在许多争议。有研究表明,前额叶中的NAA值降低[9],而另有研究认为NAA值增加或处于正常水平[10]。结果不一致的原因可能与磁共振技术参数、疾病状况、药物的影响等因素有关。
本文结果显示,MDD患者前额叶的Cho/Cr值减小。Cho是神经递质乙酰胆碱和膜脂质、磷脂酰胆碱和鞘磷脂的必需前体[11]。Cho水平的降低与膜更新减少和/或细胞内信号传导系统受损有关;或者由于Cho大量存在于少突胶质细胞中[12]。一般来说,Cr被认为是相对稳定的个体和大部分脑区;出于这个原因,它通常是作为一个内部参考[13],但是把Cr作为标准是有争议的。有些研究还报道了MDD患者前额区少突胶质细胞的密度较低和与少突胶质细胞功能相关的基因的表达显著降低[12,14]。总之,这些结果表明,白质MDD异常与少突胶质细胞的改变特别相关,这最终可能导致髓鞘完整性和神经元网络异常。
综上所述,这些发现表明,额叶、额顶叶脑缺血灶与MDD相关,并且前额叶的脑白质生化异常,可能是发生在MDD过程的早期,也可能与抑郁症的神经病理学有关。NAA/Cr和Cho/Cr值较低表明神经元和/或轴突完整性受到干扰。未来的研究可以使用1H-MRS绝对定量来探索这种生化异常是否在整个过程中是进行性的MDD以及这些异常与抑郁症严重程度、治疗反应和复发风险之间的关系。
