非小细胞肺癌CT值与免疫治疗疗效的相关性探讨
2023-05-10霍雨华通信作者张明敏
霍雨华,张 强(通信作者),庄 翔,张明敏
(1包头医学院 内蒙古 包头 014040)
(2包头市肿瘤医院放射科 内蒙古 包头 014030)
肺癌是全球男性癌症死亡原因的首位,在女性中排名第二[1];非小细胞肺癌(non-small cell lung cancer,NSCLC)是其主要的类型,约占肺癌的85% ~90%[2]。癌细胞的糖酵解较为活跃,即使在有氧状态下,肿瘤细胞也会优先进行糖酵解,这就是著名的瓦博格(Warburg)效应,它不是通过产生三磷酸腺苷(adenosine triphosphate,ATP)通过更多的有氧氧化途径为细胞生长提供能量[3-5]。肿瘤在生长中异常的微血管空间无序化会导致实体瘤的缺氧,限制了肿瘤进行氧化磷酸化的能力,糖酵解在复氧后持续存在,产生大量乳酸[6]。肿瘤细胞通过细胞膜上的质子泵向细胞外分泌H+以逃避酸化,导致肿瘤酸性细胞微环境(tumor microenvironment,TME)[7]。
PD-L1是目前应用最广的免疫治疗正性预测生物标志物[8]。肿瘤微环境乳酸的低pH值使免疫细胞凋亡,后者在肿瘤内的分布不均,与PD-L1的表达不稳定,引起非小细胞肺癌免疫治疗疗效的不确定性,临床迫切需要影像学检测微环境。CT值被定义为物质衰减系数与水相比的相对值,可作为预测模型之一。CT纹理分析通过显示瘤内个别图像元素的分布和强度来反应细胞亚群的不均匀分布,为免疫治疗提供量化数据[9-10]。最近,越来越多的CT纹理分析或放射组学研究通过特定的影像学征象反映整个肿瘤来评估一些生物学事件,包括肿瘤细胞结构、生长、坏死、肿瘤相关炎症和血管生成,以指导临床决策。这些生物事件均可反映肿瘤进展或对免疫检查点抑制剂(ICIs)的反应性[11-12]。如放射纹理Delta(DelRADx)模式可以预测非小细胞肺癌患者对ICI治疗的反应和总生存期[13]。影像学检查为无创性检查,且图像可以反映肿瘤内、外环境的表现,因此不受采样偏差的影响。目前尚未有使用CT值与整个肿瘤体积测定非小细胞肺癌酸化比率与免疫治疗相关性的研究。本研究通过分析特定CT值相对范围与免疫治疗疗效相关性,探索酸化TME对免疫治疗的影响。
1 资料与方法
1.1 一般资料
选取2020年10月—2022年6月包头市肿瘤医院收治的非小细胞肺癌患者42例,其中男性35例,女性7 例。患者年龄58~80岁,平均年龄(65.24±8.95) 岁。纳入标准:①经检查发现肺部占位性病变,且经病理组织活检证实为非小细胞肺癌;②均为实体瘤并经CT增强扫描,瘤体至少于5个层面(间隔5 mm,层厚5 mm)可见;③均接受免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗,遵循治疗规范治疗至少4周;④ 有完整的住院资料者。排除标准:①存在肺外原发恶性肿瘤病史;②存在活动性肺结核或其他肺部良性疾病;③未做两次及以上增强扫描;④纵隔窗观察肿瘤内部存在大量钙化;⑤纵隔窗观察肿瘤内部存在大量不规则支气管及气泡影;⑥碘过敏者。
1.2 方法
检查设备采用飞利浦Brilliance CT(16排),扫描时间8.517 s,管电压120 kV,管电流30 mA,层厚5 mm,间隔5 mm。患者吸气后屏气扫描,扫描范围自胸廓入口至膈平面。平扫后,经肘正中静脉以1.5~2.0 mL/s速率注入碘佛醇65~75 mL,开始注入对比剂后50 s进行增强扫描。
1.2.1 勾画感兴趣区(region of interest,ROI)
ROI包括完整的单处原发病灶,酸化区域定义设定为CT值18~35 HU,为了避免酸化区域内体素相差过大,均化物质的密度造成误差,选取平均差σ<13 HU的区域。分别测量肿瘤第1~n层(肿瘤于n层可见)的面积Si与第1~n’层酸化区域的总面积△Si。为了避免部分容积均化效应,选择层厚为5 mm的图像,见图1。
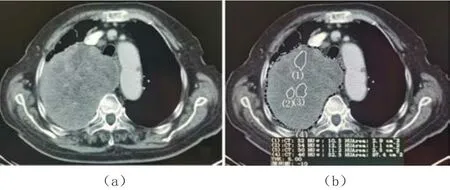
图1 典型病例CT图像
1.2.2 公式计算瘤体酸化比率(tumor acidification rate,TAR)
1.2.3 疗效评价
疗效评价依据免疫实体肿瘤疗效评价(immune response evaluation criteria in solid tumor,iRECIST)标准,分为完全缓解(complete remission,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD),如为未经证实的进展(unconfirmed progressive disease,iUPD),则4~8周后复查再评估。
1.3 统计学方法
采用SPSS 21.0统计软件分析数据。符合正态分布的计量资料以均数±标准差()表示,采用t检验;不符合正态分布的计量资料以中位数(四分位间距)[P50(P25,P75)]表示,采用Kruskal-Wallis H非参数秩和检验。计数资料以频数(n)、百分率(%)表示,采用χ2检验,2个等级资料组间比较用Mann-Whitney U检验,多个等级资料组间比较用Kruskal-Wallis H非参数秩和检验。等级资料相关性用Spearman相关性分析。用ROC曲线确定指标诊断截点并进行指标评价。图形用Graphpad Prism 7.0软件绘制。以P<0.05为差异有统计学意义。
2 结果
2.1 非小细胞肺癌患者增强CT纵隔窗表现
所测非小细胞肺癌瘤体内反映为强化明显区域扭曲的微血管、微血管瘘,强化区域增殖的瘤细胞,低强化的酸化区域,无强化的囊变坏死区域,见图2。
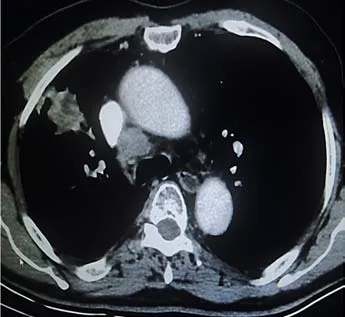
图2 典型病例CT图像
2.2 不同疗效组间的治疗前酸化比率相关性分析及疗效与酸化比率的相关性与PD-L1与疗效的相关性强弱比较
PR组的酸化比率显著低于PD、SD组(P<0.01)。不同PD-L1组别间的疗效经Kruskal-Wallis H检验,差异显著(P<0.01),且随着疗效变好,PD-L1阳性越来越高,经Spearman相关性分析,疗效与酸化比率的相关性较PD-L1强(|r酸化比率|>|PD-L1|),见表1。
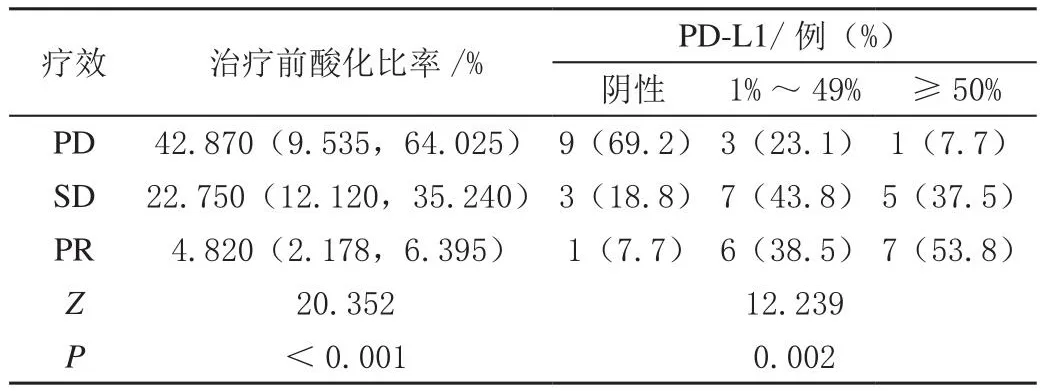
表1 不同疗效组间的治疗前酸化比率比较
2.3 不同PD-L1组间的治疗前酸化比率与疗效的相关性分析
经Spearman相关性分析,PD-L1阴性组的治疗前酸化比率与疗效间无显著相关关系(P>0.05),PD-L1在1%~49%组和≥50%组的治疗前酸化比率与疗效间呈负相关(P<0.05),见表2及图3。
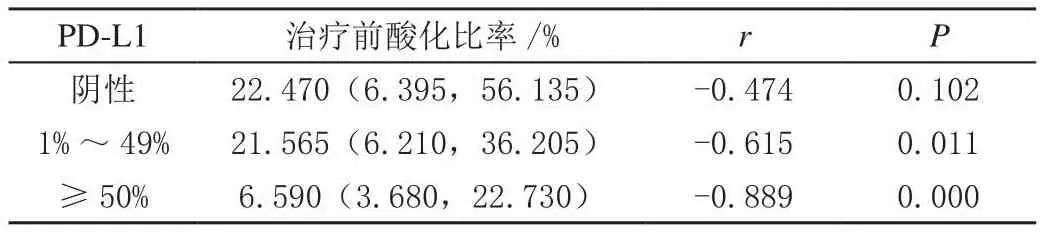
表2 不同PD-L1组别间的治疗前酸化比率与疗效的相关性分析
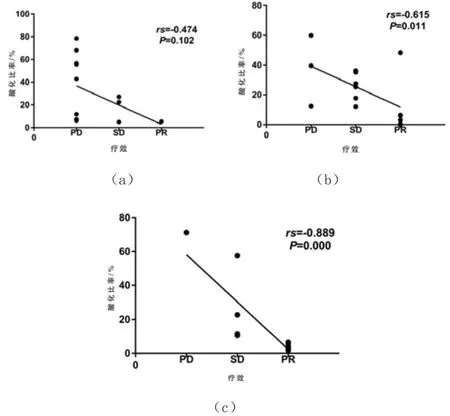
图3 不同PD-L1组间的治疗前酸化比率与疗效的相关性分析
2.4 不同疗效组间的治疗前后差值比较
不同疗效组间治疗前后酸化比率比较差异有统计学意义(P<0.05),且两两比较结果显示,PR组的酸化比率差值显著低于PD组,见表3。

表3 不同疗效组间的治疗前后差值比较
2.5 不同病理类型组间的疗效比较
不同病理类型组间的疗效比较,差异无统计学意义(P> 0.05),见表4。
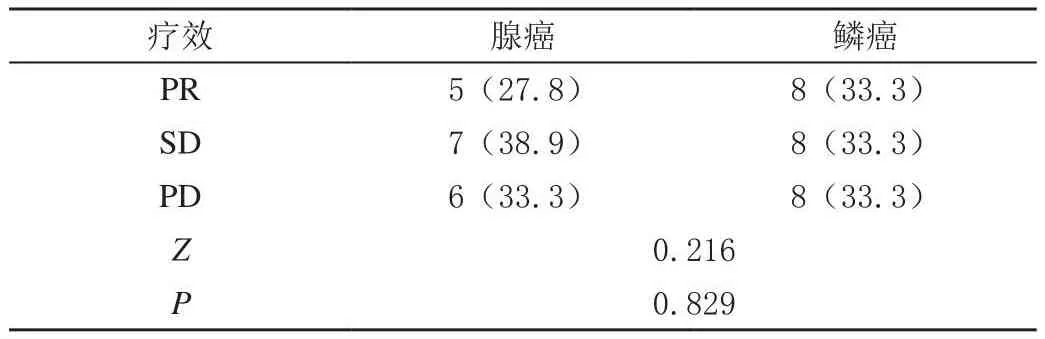
表4 不同病理类型组间的疗效比较[n(%)]
2.6 治疗前酸化比率预测进展的诊断价值
判断治疗前的酸化比率指标是否发生进展,选择ROC曲线分析。未进展组(PR和SD)的酸化比率为(16.219±15.311)%,进展组(PD)的酸化比率为(39.759±27.479)%,两组间酸化比率经Mann-Whitney U检验,差异有统计学意义(Z=-2.952,P=0.003)。治疗前的酸化比率指标曲线下面积0.788,标准误0.078,P=0.003,95%置信区间(0.635~0.940),表明治疗前的酸化比率指标诊断疾病的诊断灵敏度为61.5%,特异度为93.1%,诊断截点为37.915%,见图4。
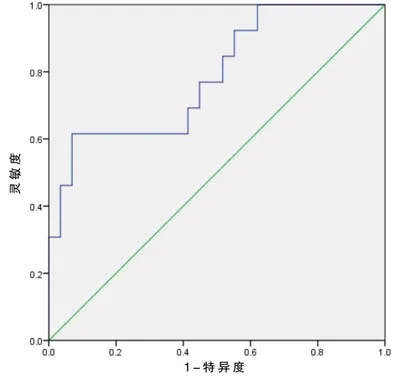
图4 治疗前酸化比率预测进展的ROC曲线
3 讨论
随着以程序性死亡蛋白-1(programmed cell death-1,PD-1)/PD-L1抗体为代表的免疫检查点抑制剂(ICIs)作为晚期和转移性NSCLC治疗方案被纳入到美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)及欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)指南[14-15],免疫治疗给众多晚期NSCLC患者带来了新的希望。
TME是免疫细胞和肿瘤细胞的复杂动态环境,免疫治疗的耐药主要取决于T细胞的耗尽[4],重编程能量代谢是癌细胞最常见的特征之一[16]。TME的形成不仅关系到调控有氧糖酵解限速酶的癌基因与抑癌基因的过表达与低表达[17],还与CAⅨ[18]和NHE-1[6]在肿瘤浸润区的上调密切相关。乳酸水平在10 mM至40 mM之间时,酸化低于pH 6.5[19],pH低于6.5将产生有害的影响[20]。随着亚细胞结构及功能调查的开展,肿瘤突变负荷(tumor mutational burden,TMB)、肿瘤淋巴细胞浸润(tumor infiltrating lymphocyte,TLI)等成为新的免疫治疗疗效的预测因子[4,7,21]。目前影像学尚未有特定CT值相对范围与免疫治疗疗效关系的详细研究。
目前关于CT值研究方面,CT值作为非小细胞肺癌甲状腺转录因子1表达状态的预测指标之一[22],作为预测模型判断肺纯磨玻璃结节为浸润性[23]。Pamilo等[24]利用肝的CT值区别脂肪肝变性患者的轻度、中度、重度组:轻度脂肪肝组的CT值为39~60 HU,中度脂肪肝组的CT值为4~46 HU,重度脂肪肝组的CT值为6 ~16 HU。肿瘤酸化区域是瘤细胞有氧糖酵解产生乳酸所致[25],在CT上表现为不同于囊变坏死的低密度区,通过计算TAR,特定CT值范围,本研究发现瘤体内酸化区域CT值为18~35 HU。
通过CT值检测可以预测肺癌治疗疗效,肺癌的灌注值、血容量愈高,介入治疗近期效果愈好[26]。本研究发现瘤内低CT值酸化区域的NSCLC实体瘤TAR大于37.915%免疫治疗效果较差,AUC为0.788,这与T细胞酸化有关[20]。
Ladwa等[9]曾通过CT纹理分析发现经纳武利尤(Nivolumab)单抗治疗获得较好疗效的患者CT扫描肿瘤病灶后显示出相对均质的较高密度影。本研究发现肿瘤细胞增殖、微血管生成区域,酸化比率较低,CT值较高,PD-L1表达与疗效呈正相关,在PD-L1表达1%~49%与 ≥50%组酸化比率与疗效呈负相关,不同病理类型(腺癌/鳞癌)对免疫治疗疗效的预测无价值。
尽管PD-L1在肿瘤内分布不均且表达不稳定,PD-L1在一定程度上可结合酸化比率预测免疫治疗疗效。治疗前后酸化比率的变化与疗效有关,不同疗效组间的治疗前后差值比较,差异有统计学意义(P<0.05),且两两比较结果显示,PR组的酸化比率差值显著低于PD组。这与PD组酸化成分增加,免疫细胞受酸性环境影响,ICIs无通过解除PD-1/PD-L1免疫检查点对免疫细胞的抑制作用恢复T细胞对肿瘤的杀伤功能有关[27]。
免疫治疗以增强T细胞应答为机制,疗效受TME影响,当暴露于酸性环境时,T细胞和NK细胞等抗肿瘤效应物会失去功能,而TME使髓系细胞和调节性T细胞(Treg)等免疫抑制成分受益,阻断抗肿瘤免疫反应[18-20,28]。通过分析治疗前的酸化比率对是否发生进展的诊断价值,ROC曲线可以实现。在抗肿瘤T细胞应答的上游和下游成分(TMB、TLI等)被聚焦为有效的免疫治疗疗效预测因子的时代[29],影像学是可以提供肿瘤酸化机制疗效预测有效方法之一。
