含复合贝莱斯芽孢杆菌和γ-聚谷氨酸的功能性育苗基质混配工艺优化
2023-05-10穆文强尚庆茂武瑞赟康慎敏李平兰
穆文强 尚庆茂 武瑞赟 康慎敏 李平兰*
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.中国农业科学院 蔬菜花卉研究所,北京 100081)
功能性育苗基质是在传统育苗基质基础上通过添加各种植物根际促生菌制备的一类对幼苗具有抗病促生功能的育苗基质。该类育苗基质中富含的植物根际促生菌可以在植物根际聚集并分解难溶的矿物质[1],可预防和控制植物病害,促进幼苗生长[2-3],减少农药和化肥的使用[4-5]。使用植物根际促生菌是一种提高蔬菜产量和质量的新型方法[6]。
芽孢杆菌是公认的植物根际促生菌,贝莱斯芽孢杆菌(Bacillusvelezensis)是芽孢杆菌属的一个新种[7],已报道有多株性能优良植物根际促生菌,如贝莱斯芽孢杆菌BAC03对甜菜、黄瓜、辣椒等蔬菜具有促进幼苗生长作用[8];贝莱斯芽孢杆菌BS89可促进植物生长,能够分泌植物激素、铁载体等[9];贝莱斯芽孢杆菌B006可提高茄子对氮、磷、钾的吸收并促进其生长[10]。目前多数研究仍集中在优良菌株筛选、鉴定、发酵工艺优化和小规模的苗期应用效果上,对其协同育苗基质的大规模应用和如何有效的与传统育苗基质复配来最大限度发挥其有益作用的研究较少。
芽孢杆菌促生菌菌剂主要有液体和固体2种剂型,液体菌剂和水溶性强的固体菌剂在实际生产中,可通过混合搅拌机中的湿润喷雾装置将其喷洒至育苗基质中,达到混合均匀的目的[11],该工艺操作相对简单方便,但存在芽孢易萌发,产品保质期短等问题;水溶性相对弱的固体菌剂则多采用固体混拌的方式进行混配。育苗基质中促生菌含量为107CFU/mL时,对蔬菜幼苗的生长有显著的促进作用[12],对于1011CFU/g的固体菌剂,通过和传统育苗基质直接混配达到基质含菌量为107CFU/mL时,因菌剂添加量少,稀释倍数高,易造成固体菌剂在育苗基质中的分布不均匀,在实际育苗过程中造成幼苗长势不一、形态差异大等育苗事故[13]。因此,对功能性育苗基质生产中固体促生菌剂与育苗基质的混配方式及影响因素开展研究具有重要意义[14]。
γ-聚谷氨酸是一种由α-胺基和γ-羧基经酰胺键连接构成的同型聚酰胺的聚合物[15-16],具有水溶性、粘着性、易被生物降解、不含毒性和对环境友好等特点[17-18]。γ-聚谷氨酸在育苗基质中能够通过整合作用和吸附作用减少矿质养分的冲淋率,提髙肥料的利用效率,起到肥料增效剂的作用[19-20]。γ-聚谷氨酸在小青菜、小白菜、草莓、油菜等[21-23]的应用上,表现出明显促进生长的效果,是现代农业生产中常用的肥料辅助剂。
本研究以育苗基质中贝莱斯芽孢杆菌的变异系数(Coefficient of variation,CV)为评价指标,拟通过单因素试验、Plackett-Burman试验和响应面优化试验,优化载体γ-聚谷氨酸添加量、育苗基质水分质量分数、混合转速和混合时间等参数,提升菌剂在育苗基质中的均匀性,并测定混配后育苗基质的理化性质,探究载体γ-聚谷氨酸添加量和混配方式对育苗基质品质的影响,为开发富含复合贝莱斯芽孢杆菌的功能性育苗基质及其工业化生产提供基础数据。
1 材料与方法
1.1 试验材料
1.1.1菌剂及试剂
供试复合贝莱斯芽孢杆菌菌剂含菌量为2.56×1011CFU/g,由贝莱斯芽孢杆菌L-S 60、L-H 15和LPL-117菌株(CGMCC No.10045、10044和7749)混合发酵制备,菌株来自中国农业大学食品科学与营养工程学院应用微生物实验室;γ-聚谷氨酸来自北京元嘉禾农业科技有限公司;LB肉汤、琼脂等购于北京奥博星生物技术有限责任公司。
1.1.2育苗基质原料及穴盘
草炭土购自黑龙江桦美泥炭有限公司,蛭石和珍珠岩购自河北省灵寿县京石矿产工厂,采用粒径为3~6 mm园艺级。草炭土、蛭石和珍珠岩在使用前经121 ℃灭菌60 min。
穴盘使用6×12(72孔)的塑料穴盘,单穴容积40 cm3,试验中每个穴盘加入约3 L育苗基质,穴盘购自浙江台州隆基塑业有限公司。
1.1.3仪器及设备
垂直流洁净工作台SCL-1300,北京赛伯乐实验仪器有限公司;电热恒温培养箱DNP-9162,上海精宏实验设备有限公司;微型漩涡混合仪WH-3,上海沪西分析仪器厂;组合摇床MQD-S3R,上海旻泉仪器有限公司;酸度计FE20,梅特勒-托利多仪器(上海)有限公司;混合搅拌机,郑州科勒机械设备有限公司。
1.2 试验方法
1.2.1根际促生菌变异系数的测定
试验采用的育苗基质按V(草炭土)∶V(蛭石)∶V(珍珠岩)=3∶1∶1复配制备,将育苗基质和携带菌剂的γ-聚谷氨酸载体填装至混合搅拌机中进行混配,混配后的育苗基质填装于72孔穴盘中,随机挑选5个穴孔取样,每个样品25 mL。将样品加入到含有225 mL灭菌的生理盐水的锥形瓶中,以200 r/min低温震荡20 min,进行梯度稀释,涂布,培养,对微生物菌落计数。每个梯度重复3次,计算微生物菌落数的平均值(M)和标准差(S),贝莱斯芽孢杆菌的变异系数(CV),计算公式为:
(1)
1.2.2育苗基质理化性质的测定
育苗基质的物理性质包括容重、总孔隙度、通气孔隙度、持水孔隙度和最大持水量等,测定方法参照NY/T 1121.4—2006《土壤容重的测定》[24];育苗基质pH测定采用1∶10稀释法。
1.2.3单因素试验
基于固体分步混配的相关研究[25-26]及本课题组前期研究发现,1011CFU/g的固体芽孢杆菌菌剂采用两步混配方式可达到混合均匀的效果。第1次混合,将菌粉与定量的γ-聚谷氨酸载体混合,这个过程菌粉和载体量相对较少,易混合均匀;第2次混合,将含有菌剂的γ-聚谷氨酸载体加入传统育苗基质中进行机械搅拌混合。
在两步混配的前提下,采用单因素试验,探究载体γ-聚谷氨酸添加量(X1)、育苗基质水分质量分数(X2)、混合转速(X3)和混合时间(X4)4个因素对贝莱斯芽孢杆菌变异系数的影响。γ-聚谷氨酸载体的添加量选取6个水平,分别为0、1、3、5、7、9 g/L;基质水分质量分数选取5个水平,分别为15%、20%、25%、30%、35%;混合转速选取5个水平,分别为25、30、35、40、45 r/min;混合时间选取5个水平,分别为3、4、5、6、7 min。进行每组试验时只改变1个因素的水平,其他因素保持不变,每组试验在前面因素最佳的情况下进行。
1.2.4Plackett-Burman试验
试验使用Design-Expert 13.0软件,选用N=12的Plackett-Burman试验设计。以育苗基质中贝莱斯芽孢杆菌的变异系数为响应值,因素和水平选取见表1。通过对4个因素效应值、方差和贡献率的分析,选出贡献率前3的因素进行最陡爬坡试验。
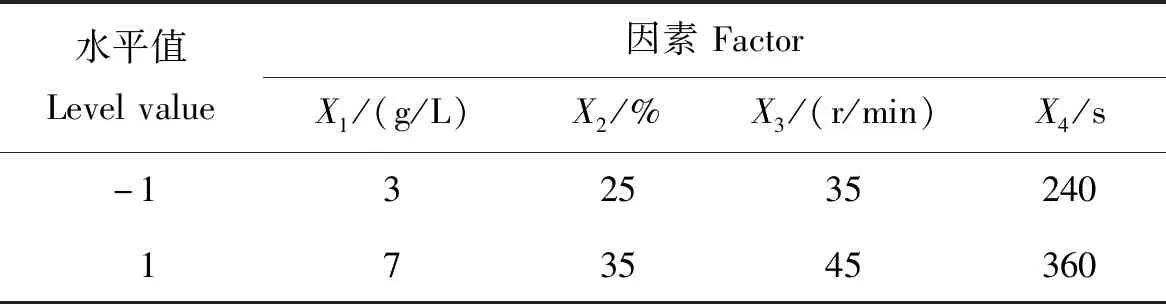
表1 贝莱斯芽孢杆菌变异系数PB试验因素和水平Table 1 Factors and levels of the PB test for the CV of Bacillus velezensis
1.2.5最陡爬坡试验
根据Plackett-Burman试验结果,对具有显著性载体γ-聚谷氨酸添加量(X1)、混合转速(X3)和混合时间(X4)的3因素进行最陡爬坡试验,使试验因素水平快速逼近最优范围,以进行Box-Behnken响应面试验。最陡爬坡试验设计见表2。
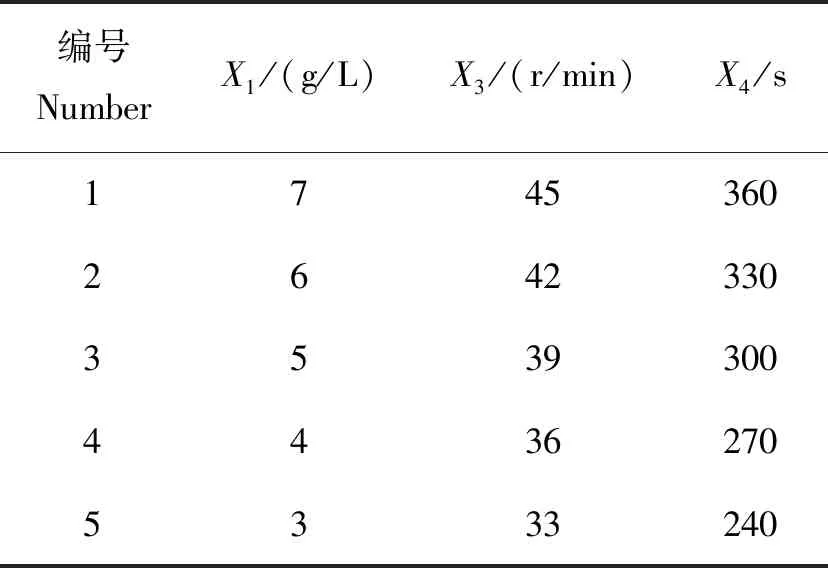
表2 贝莱斯芽孢杆菌变异系数最陡爬坡试验设计Table 2 Steepest climbing test design for the CV of Bacillus velezensis
1.2.6Box-Behnken响应面试验
根据最陡爬坡试验结果,以γ-聚谷氨酸添加量(X1)、混合转速(X3)和混合时间(X4)为自变量,贝莱斯芽孢杆菌的变异系数为响应值进行Box-Behnken响应面试验,探究变量对响应值的影响,试验因素和水平见表3。

表3 贝莱斯芽孢杆菌变异系数Box-Behnken试验因素和水平Table 3 Factors and levels of the Box-Behnken test for the CV of Bacillus velezensis
1.3 数据分析
试验数据采用SPSS(Statiatical product and service solution)软件进行分析,结果以“平均值±标准差”表示。
2 结果与分析
2.1 单因素试验
变异系数是指数据的离散程度,变异系数越低,表示数据离散程度越小[27]。就功能性育苗基质而言,传统育苗基质中添加植物根际促生菌剂后,基质中植物根际促生菌的变异系数越低,说明根际促生菌在育苗基质中分布越均匀。试验得到的4个的单因素试验结果见图1。
由图1(a)可知,当不使用载体,直接将菌粉与育苗基质混配时,变异系数为23.0%,贝莱斯芽孢杆菌在基质中分布极不均匀。将菌剂和载体γ-聚谷氨酸复配后再与基质混配,随着γ-聚谷氨酸添加量的增加,育苗基质的变异系数呈现先降低后又升高的趋势。当γ-聚谷氨酸载体添加量为5.0 g/L时变异系数达到最低,响应区间为3.0~7.0 g/L。
当育苗基质水分质量分数为15%~30%时,变异系数随水分质量分数的增加而降低,水分质量分数超过30%时,变异系数开始降低,响应区间为25%~35%(图1(b))。变异系数降低是因为γ-聚谷氨酸是由α-胺基和γ-羧基经酰胺键连接构成的同型聚酰胺,具有亲水性[16],易吸潮结块[28]。当育苗基质水分质量分数>30%时,含贝莱斯芽孢杆菌的γ-聚谷氨酸吸收育苗基质中的水分形成块状,使菌剂无法均匀分布在育苗基质中。

竖直线表示标准偏差,不同小写字母表示处理间差异显著(P<0.05),图2同。Vertical lines indicate standard deviation,different lowercase letters indicate significant differences between treatments (P<0.05).Same as Fig.2.图1 单因素对贝莱斯芽孢杆菌变异系数的影响Fig.1 Effects of single factors on the CV of Bacillus velezensis
在确定γ-聚谷氨酸添加量和育苗基质水分质量分数的条件下,贝莱斯芽孢杆菌的变异系数是随着混合转速的升高先降低再趋于不变,当转速为35、40和45 r/min时,变异系数没有显著性差异,响应区间为35~45 r/min(图1(c))。随着转速的升高,单位时间内搅拌次数提升,可加快不同物料间的相互渗透,有利于快速混合,此时物料混配为对流混合阶段,易达到宏观上的混配均匀[29];当转速达到35 r/min后,均匀性趋于稳定,物料的混配进入扩散混合阶段[30],变异系数在7%上下波动。
随着混合时间的延长,贝莱斯芽孢杆菌的变异系数同样表现为先降低后趋于稳定,在混合5 min时变异系数达到最低值5.97%,响应区间为4~6 min(图1(d))。随着混合时间的延长,变异系数不会显著下降,而是趋于稳定[31]。由单因素试验结果得到最适γ-聚谷氨酸添加量为5 g/L,育苗基质水分质量分数为30%,混合转速为40 r/min,混合时间为5 min。
2.2 Plackett-Burman试验
使用Design-Expert 13.0软件进行N=12的Plackett-Burman试验,各因素试验组合下贝莱斯芽孢杆菌的变异系数结果见表4。
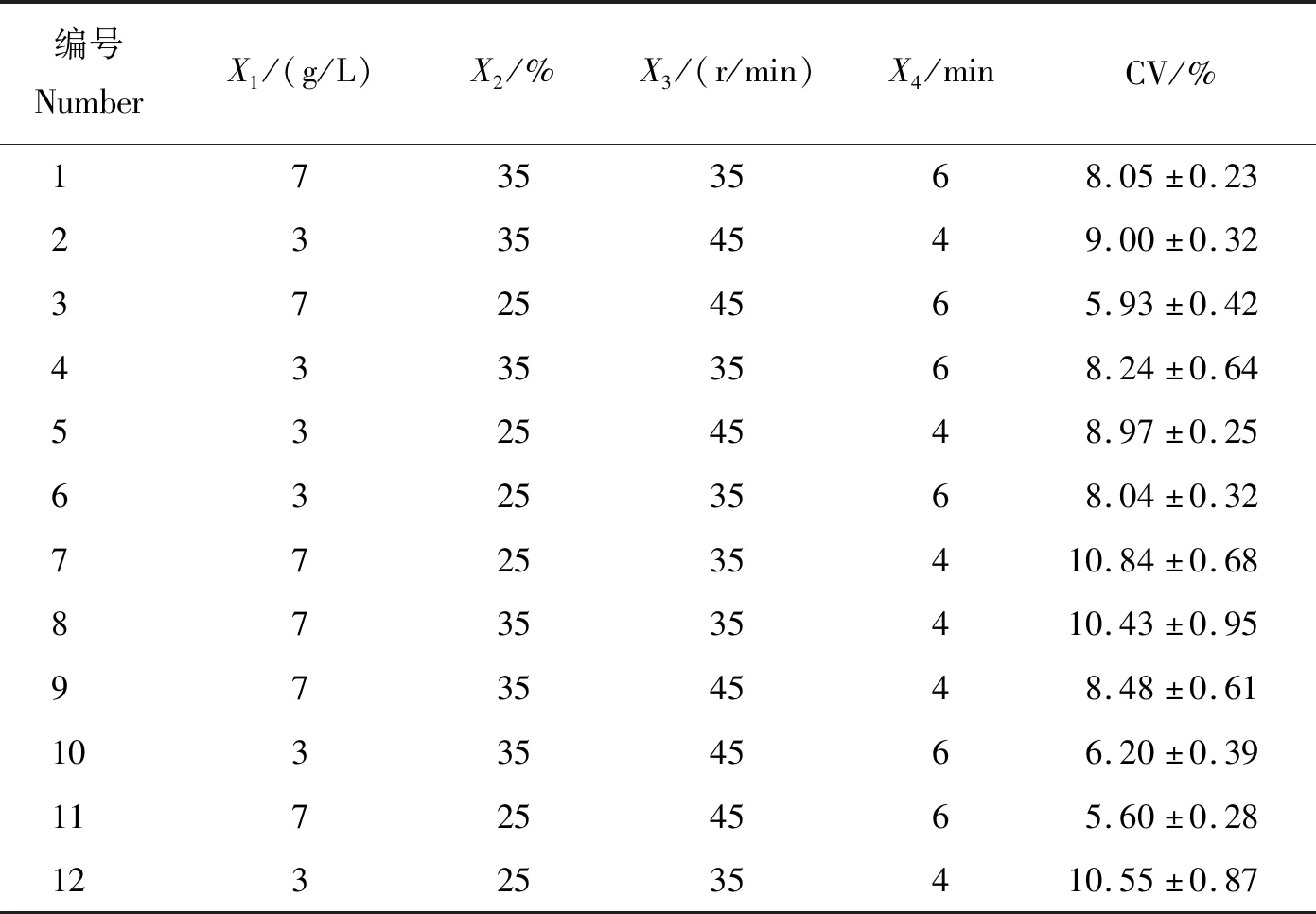
表4 贝莱斯芽孢杆菌变异系数Plackett-Burman试验结果Table 4 Results of Plackett-Burman test of the CV of Bacillus velezensis
对Plackett-Burman试验结果进行效应分析和方差分析,结果见表5和表6。

表6 贝莱斯芽孢杆菌变异系数 Plackett-Burman试验方差分析Table 6 CV of Bacillus velezensis Plackett-Burman test analysis of variance table
γ-聚谷氨酸添加量(X1)、混合转速(X3)和混合时间(X4)的效应为负;育苗基质水分质量分数(X2)的效应为正(表5)。效应值的大小表示该因素对试验结果影响的强弱。由此可得,4个因素对模型影响的贡献率依次为:X4>X3>X1>X2。对贡献率较大的3因素进行最陡爬坡试验,其他因素根据效应值取值,表现为正效应的因素取高水平,表现为负效应的因素取低水平。
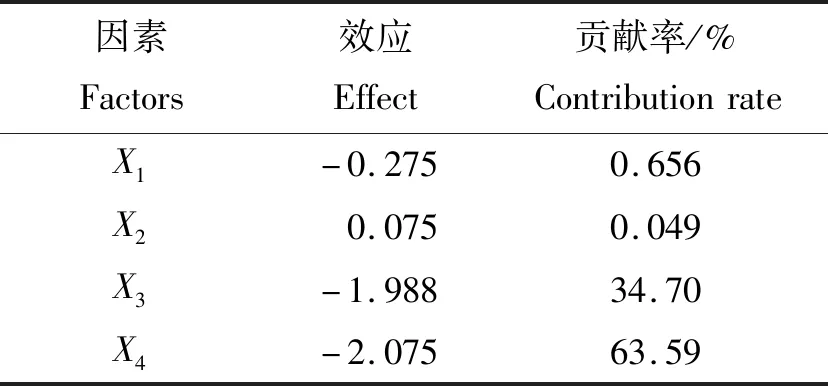
表5 贝莱斯芽孢杆菌变异系数Plackett-Burman试验效应分析Table 5 Plackett-Burman test effect analysis of CV of Bacillus velezensis
表6中,模型P<0.000 1,模型模拟结果极显著,说明模型选择合适。各因素P值大小反映该因素对试验结果影响的显著程度。因此,选用X1、X3和X43个因素进行最陡爬坡试验,X2的效应为正,选取其高水平,即35%。
2.3 最陡爬坡试验
贝莱斯芽孢杆菌变异系数最陡爬坡试验结果见图2。试验结果显示出理想的先降低后增高的趋势,在2号试验点出现最低点,对应的各因素参数取值为:γ-聚谷氨酸添加量6 g/L,混合转速42 r/min,混合时间330 s。对应的贝莱斯芽孢杆菌在育苗基质中的变异系数为5.12%,该点为最陡爬坡试验拐点,也是Box-Behnken试验的中心点。
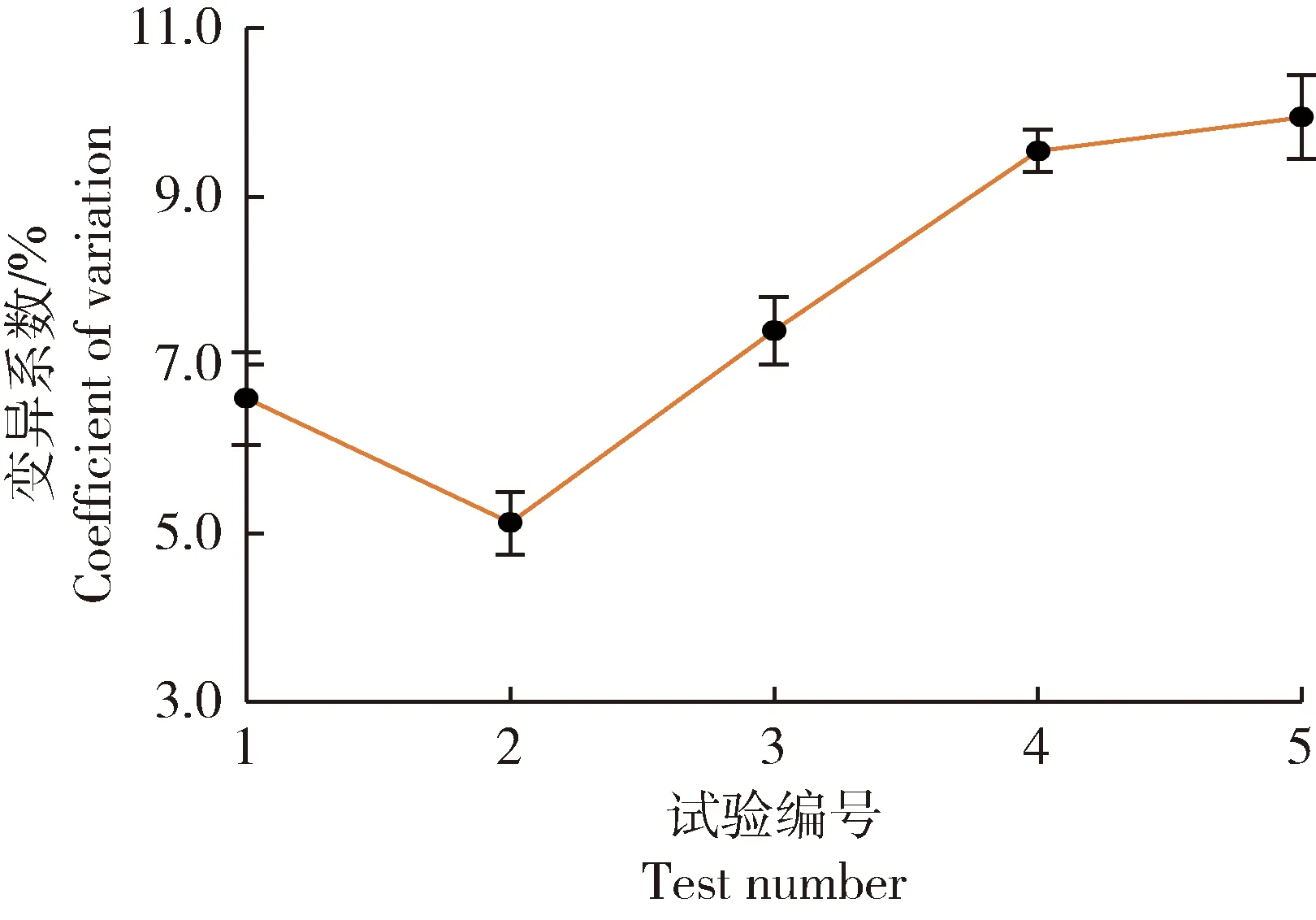
图2 贝莱斯芽孢杆菌变异系数最陡爬坡试验结果Fig.2 Results of the steepest climbing test of the CV of Bacillus velezensis
2.4 Box-Behnken响应面试验
为得到离散元模型参数的最优组合进行Box-Behnken试验,结果见表7。对试验结果进行回归拟合后,得到以贝莱斯芽孢杆菌在育苗基质中的变异系数(CV)为响应值,γ-聚谷氨酸添加量(X1)、混合转速(X3)和混合时间(X4)为变量的回归方程:
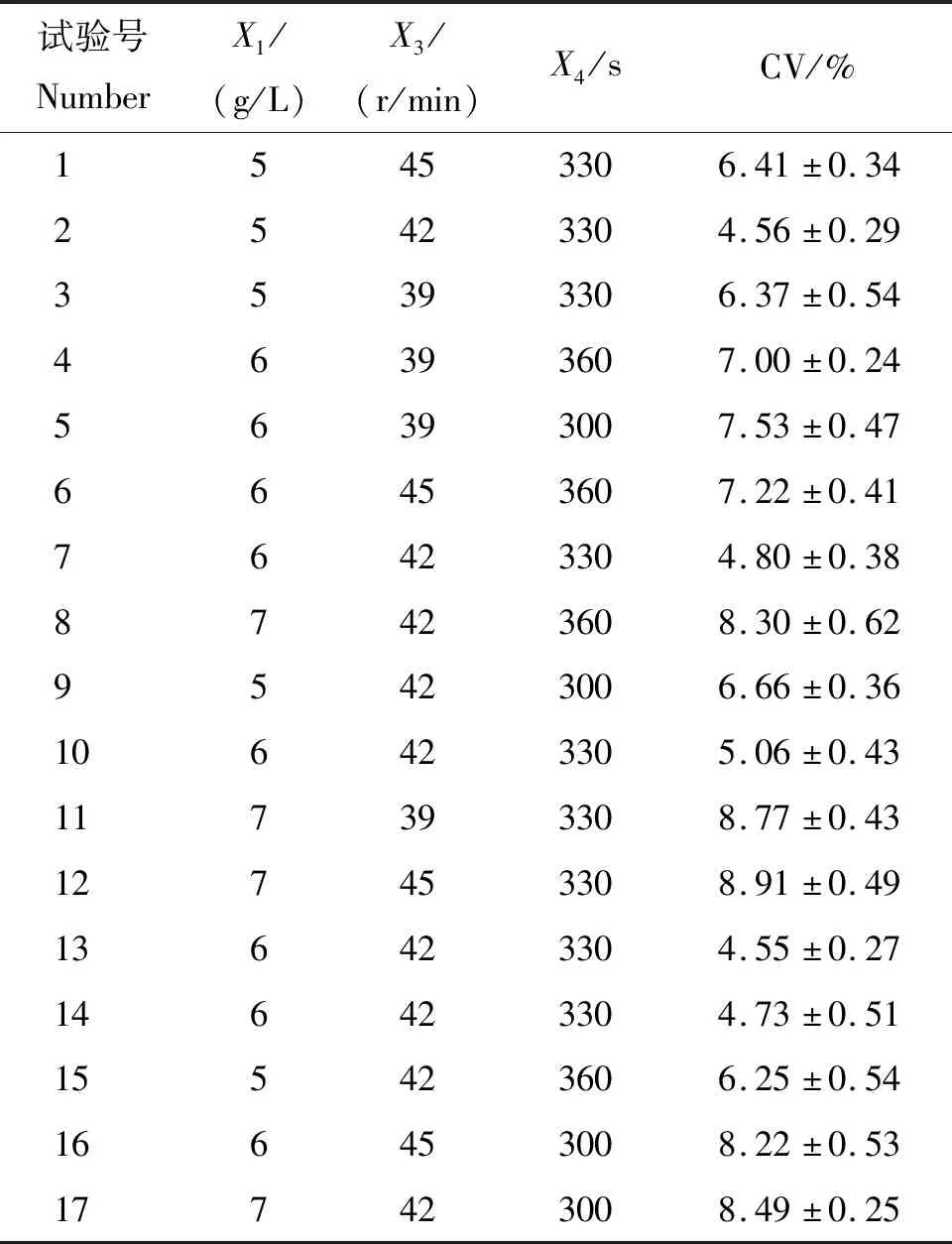
表7 贝莱斯芽孢杆菌变异系数(CV)Box-Behnken试验结果Table 7 Results of the Box-Behnken test of the CV of Bacillus velezensis

方程二次项系数为正值,表明回归方程结果具有最小值,对回归模型进行方差分析,结果见表8。回归方程的决定系数R2=0.987 4,表明方程拟合度较高;模型P<0.000 1,说明回归方程极显著,能够描述因素与响应值间的关系;模型失拟项P>0.05,失拟项不显著,说明不存在其他主要因素影响响应值。
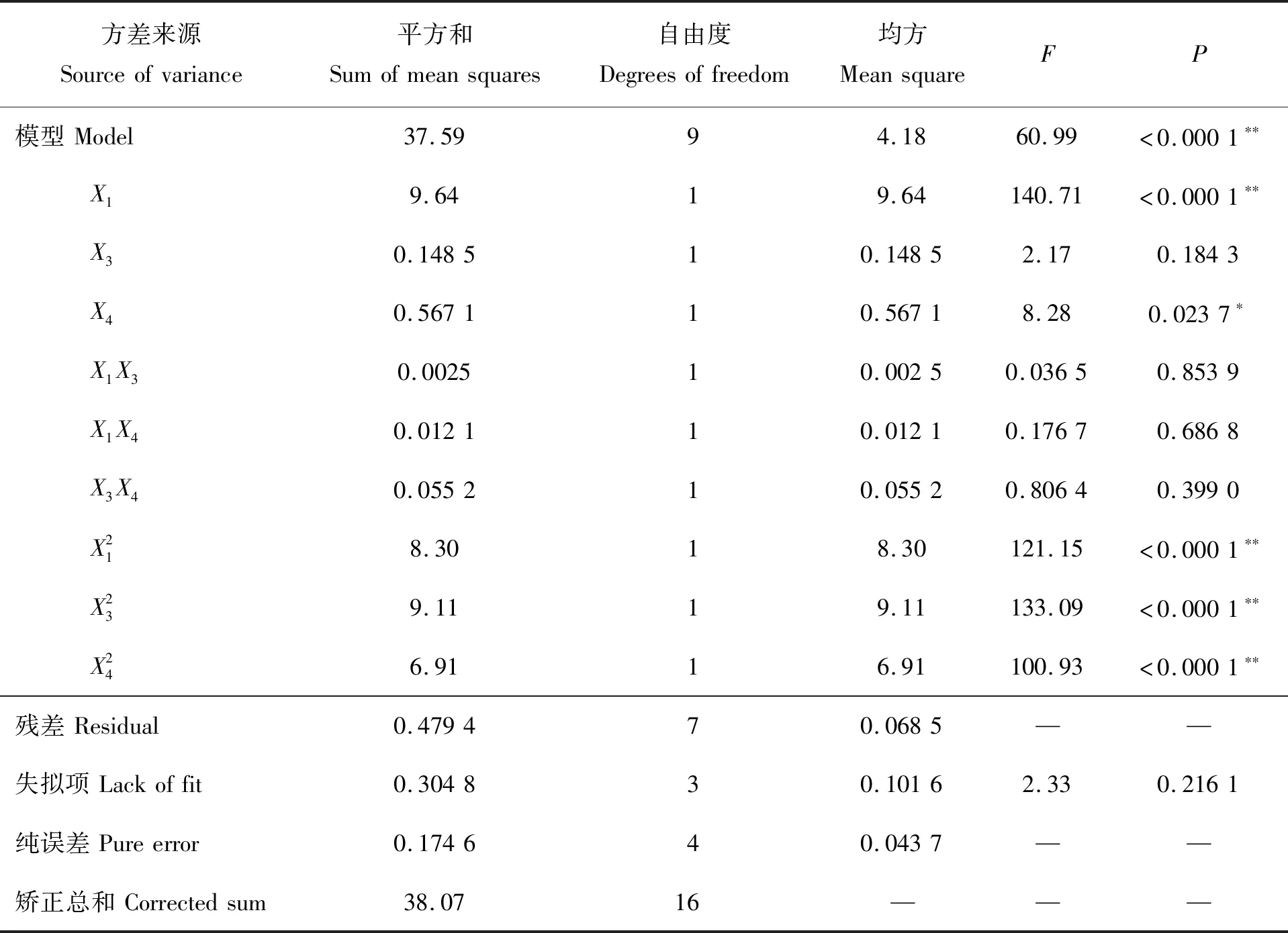
表8 贝莱斯芽孢杆菌变异系数(CV)Box-Behnken试验方差分析Table 8 Box-Behnken test of variance analysis of the CV of Bacillus velezensis
根据多元二次回归方程,利用 Design-Expert 13.0软件绘制响应面试验的等高线图和响应面图(图3),当3个因素中任何一个因素保持在中心水平时,剩余两个因素之间的相互作用对贝莱斯芽孢杆菌杆菌变异系数的影响呈现抛物面型,变化趋势都是先减小后增大,且响应面三维曲面图均具有极小值点。采用Design-Expert 13.0分析计算,含贝莱斯芽孢杆菌的功能性育苗基质最佳混配参数为:γ-聚谷氨酸添加量5.6 g/L,混合转速42 r/min,混合时间333 s,此时贝莱斯芽孢杆菌的变异系数为4.51%。按照该工艺参数进行验证试验,所贝莱斯芽孢杆菌的变异系数为4.59%,与预测值基本吻合,说明模型很好地预测了试验结果。
2.5 功能性育苗基质的理化性质
复合贝莱斯芽孢杆菌菌剂与传统育苗基质经混配后制备的功能性育苗基质的理化指标测定结果见表9。添加γ-聚谷氨酸载体和贝莱斯芽孢杆菌后,育苗基质的容重和总孔隙度没有显著变化,气孔隙度显著降低,持水孔隙和最大持水量显著提高,pH显著降低,其孔隙度和pH分别降低10.82%和8.29%,持水孔隙和最大持水量分别提高5.68%和7.92%。经优化后的功能性育苗基质各项理化指标均符合NY/T 2118—2012《蔬菜育苗基质》[32]规定。育苗基质理化性质的变化,是因为生产中将γ-聚谷氨酸作为复合贝莱斯芽孢菌菌剂的载体一同添加到育苗基质中,γ-聚谷氨酸具有提升育苗基质的持水性[33]、改善基质理化性质的作用[34]。

X1,γ-聚谷氨酸添加量,g/L;X3,混合转速,r/min;X4,混合时间,s;Y,贝莱斯芽孢杆菌在育苗基质中的变异系数,%。X1,the addition amount of γ-polyglutamic acid,g/L;X3,the mixing speed,r/min;X4,the factor value of the mixing time,s;Y,the CV of Bacillus velezensis in the seedling matrix,%.图3 部分交互因素影响贝莱斯芽孢杆菌变异系数的等高线图和响应面图Fig.3 Contour map and response surface map of some interaction factors affecting the CV of Bacillus velezensis

表9 功能性育苗基质理化性质Table 9 Physical and chemical properties of functional seedling matrix
3 结 论
本研究采用γ-聚谷氨酸作为复合贝莱斯芽孢杆菌菌剂的载体,以贝莱斯芽孢杆菌在育苗基质中的变异系数为指标,通过单因素试验、响应面优化试验确定了最佳功能性育苗基质的混配工艺参数:γ-聚谷氨酸添加量为5.6 g/L,混合转速42 r/min,混合时间333 s,此时,贝莱斯芽孢杆菌在育苗基质中的变异系数为4.59%,小于《蔬菜功能性育苗基质生产技术规范》[35]中的规定值,符合对功能性育苗基质生产中根际促生菌均匀性的要求。
经优化混配的功能性育苗基质在容重和孔隙度方面与传统基质无差异,而γ-聚谷氨酸的添加显著提升了基质的持水孔隙和最大持水量,有利于增强蔬菜育苗期的抗旱性。本研究结果也是对目前多数功能性育苗基质生产中采用先水溶固体促生菌菌剂后与传统基质混配工艺的补充,可有效降低功能性育苗基质中的水分质量分数,减少芽孢的萌发,提高芽孢杆菌的稳定性,延长功能性育苗基质的贮存时间。γ-聚谷氨酸载体的添加改善了传统育苗基质的理化性质,增强了其缓冲能力,研究结果对制备富含复合贝莱斯芽孢杆菌菌剂的功能性育苗基质生产具有指导意义。