低聚原花青素通过抑制TLR 4/NF-κB通路对糖尿病肾病大鼠的肾脏保护和炎症抑制作用
2023-05-09吕晓楠宗春辉宋光明
吕晓楠,宗春辉,宋光明
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病患者严重并发症之一,更是导致患者终末期肾病的重要原因,DKD的发生可直接影响糖尿病患者预后[1]。目前表明氧化应激、炎症和纤维化在DKD的进展中发挥了关键作用。其中,炎症不仅直接导致了DKD的发生和进展,还可加速这一过程[2]。包括肿瘤坏死因子-α、白细胞介素(interleukin, IL)-1β和IL-6等促炎细胞因子和趋化因子在DKD的发生发展过程中均显著增加[2]。尽管对DKD的发病机制已经有较多研究,但探索新的有效治疗策略仍具有挑战性[3]。低聚原花青素(oligomeric proanthocyanidi, OPC)是一种存在于有色植物花果中的水溶性物质,其具有抗氧化应激、抗炎、抗纤维化等多种药理活性,具有重要的临床和研究价值[4,5]。既往已经有多个研究证实OPC在DKD进展中发挥肾脏保护作用[6-8]。本课题组前期研究表明了OPC对DKD大鼠足细胞间质转化的抑制作用[9]。但OPC对DKD肾脏保护作用的机制和对肾脏炎症的抑制作用仍待进一步探索。
Toll样受体(toll-like receptors, TLRs)是非特异性免疫系统中的一个跨膜非催化性蛋白,可激活下游炎症信号通路,以应对外源性刺激。已经证实,TLRs信号、核因子κ B(NF-κB)的激活与细胞内的促炎细胞因子和趋化因子[如IL-6、单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)和IL-1β]释放增加相关。TLR4/NF-κB信号通路激活是导致局部炎症和白细胞蓄积的重要机制之一[10]。大量的研究表明TLR4、NF-κB激活在多种急慢性肾脏疾病、DKD炎症、纤维化中发挥关键作用[10,11]。基于此,本研究探讨了OPC对链脲佐菌素诱导的DKD大鼠的肾脏损伤和炎症反应的作用,以期为OPC的临床应用提供更多理论基础。
1 材料与方法
1.1 实验材料 OPC提取物(天津尖峰药业有限公司);链脲佐菌素(美国Sigma公司);细胞裂解缓冲液(P0013B)、蛋白酶抑制剂混合物(P1005)(上海碧云天公司);一抗抗体TLR 4、p-p65、p65、p-IκB α、IκB α和β-actin蛋白(美国Biotechnology公司);二抗(美国Invitrogen公司);葡萄糖、血尿素氮和肌酐酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(美国Abcam公司);尿微量白蛋白ELISA检测试剂盒 (美国Bethyl公司)。
代谢笼(韩国JeungdoBio&Plant公司);光学显微镜(日本奥林巴斯公司);超薄切片机(德国莱卡),透射电子显微镜(日本日立,H-7700)。
1.2 实验动物 选择5~6周龄雄性SD大鼠50只,体重(250±20)g,均购自中国人民解放军军事医学科学院实验动物研究所。全部大鼠在具有恒定12 h光照/黑暗循环的受控温度动物间中自由进食和饮水。进行适应性饲养1周后开始本研究。本研究开始前经天津市中西医结合医院研究所实验动物伦理委员会批准,按照《中国卫生研究院实验动物护理和使用指南》进行。
1.3 实验方法
1.3.1 DKD造模和干预 SD大鼠随机分为5组:对照组,模型组,OPC低、中、高剂量组,每组10只。
对照组给予正常饮食,其他组给予高脂高糖饮食。4周后,除对照组外给予腹腔注射50 mg/kg链脲佐菌素诱导糖尿病产生,对照组给予腹腔注射等量生理盐水。注射3 d后,大鼠尾静脉的空腹血糖高于16.7 mmol/L为糖尿病大鼠造模成功。
1周后,OPC低、中、高剂量组分别给予125、250或500 mg/kg的OPC灌胃处理,对照组、模型组大鼠灌胃等体积的生理盐水。在OPC治疗8周后测定各组大鼠的空腹血糖和体重。OPC治疗8周后处死大鼠。采集静脉血样,离心分离血清并储存于-80 ℃。快速切除右肾样本,称重后并储存于-80 ℃。计算大鼠肾重/体重比值作为肾脏指数。
1.3.2 生化指标检测分析 使用代谢笼饲养各组大鼠24 h,并收集大鼠尿液。使用ELISA试剂盒检测大鼠血清中血糖、血尿素氮、血清肌酐和24 h尿微量白蛋白水平。
取大鼠左肾皮质匀浆后,在4℃下以9000×g离心30 min。使用ELISA试剂盒分别检测大鼠血清、肾脏皮质匀浆液中的IL-1β、IL-6和MCP-1水平。
1.4 组织病理学检查 将大鼠右肾制作成2 mm的切片,并用4%多聚甲醛固定。石蜡包埋后,使用HE和Masson染色分析后显微镜观察和拍照大鼠肾小球的病理情况。
1.5 Western blot分析 取大鼠肾匀浆,并在含有蛋白酶抑制剂混合物和磷酸酶抑制剂的细胞裂解缓冲液中裂解,提取蛋白质。通过10%血清十二烷基硫酸钠聚丙烯酰胺凝胶分离等量蛋白裂解物(30 μg),并电转移至硝酸纤维素膜上。用含5%脱脂奶粉的PBS溶液封闭1 h后,加入稀释好的TLR 4、p-p65、p65、p-IκB α、IκB α和β-actin一抗在4 ℃下孵育过夜,然后用辣根过氧化物酶偶联的二抗室温下震荡孵育2 h,加入Millipore化学发光检测试剂,然后放入显影仪,使显影液曝光蛋白显影。对目标蛋白拍照后,使用Image-Pro Plus 6.0软件定量蛋白条带灰度值水平。
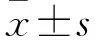
2 结 果
2.1 OPC对DKD大鼠肾病理影响 对照组大鼠HE染色显示肾小球结构完整,基底膜完整,间质无炎性细胞浸润;模型组肾小球硬化、萎缩显著,间质可见炎性细胞广泛浸润;OPC低、中、高剂量组大鼠肾小球病理状态较模型组改善显著,尤其OPC中、高剂量组的肾小球毛细血管腔均匀一致,无明显萎缩,间质炎症细胞较模型组浸润减轻。Masson染色显示,对照组肾间质偶有少量蓝色纤维着色,模型组肾脏内出现大量蓝色着色纤维,而OPC中、高剂量组的大鼠肾脏中蓝色着色纤维组织减少,肾小球、间质中仅少部分为蓝色着色区(图1)。

图1 OPC对DKD大鼠肾组织病理的影响(HE和Masson染色,×100)OPC.低聚原花青素;DKD.糖尿病肾病。
2.2 OPC对DKD大鼠肾损伤的保护作用 在8周时,模型组,OPC低、中、高剂量组大鼠的空腹血糖水平、肾脏指数、24 h尿微量蛋白、血清肌酐和血尿素氮水平均高于对照组(P均<0.05)。OPC中、高剂量组大鼠的空腹血糖、肾脏指数、微量白蛋白、血清肌酐和血尿素氮水平均低于模型组(P均<0.05),而OPC低剂量组大鼠上述参数与模型组差异无统计学意义(表1)。
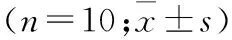
表1 不同组DKD大鼠8周时血糖、肾功能对比
2.3 OPC干预对DKD大鼠血清、肾皮质炎症因子作用 8周时模型组,OPC低、中、高剂量组大鼠血清和肾皮质中的IL-1β、IL-6和MCP-1水平均高于对照组(P均<0.05), OPC中、高剂量组大鼠的血清、肾脏中IL-1β、IL-6和MCP-1水平均低于模型组(P均<0.05),而OPC低剂量组大鼠上述参数与模型组比较,差异无统计学意义(表2)。
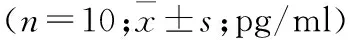
表2 不同组DKD大鼠8周时血清和肾皮质中炎症因子比较
2.4 OPC抑制DKD大鼠TLR 4/NF-κB通路的活化 使用Western blot法检测结果显示,模型组的TLR 4蛋白水平、p-IκBα/IκBα比值、p-p65/p65比值较对照组显著升高;而与模型组相比,OPC中、高剂量组大鼠的TLR 4蛋白水平、p-IκBα/IκBα比值、p-p65/p65比值显著降低(P均<0.05,图2,表3)。

图2 Western blot检测的OPC干预对DKD大鼠肾组织中TLR4、p65、lκBα蛋白表达影响OPC.低聚原花青素;DKD.糖尿病肾病;TLR. Toll样受体。
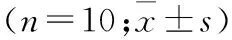
表3 不同组DKD大鼠TLR4、p65、lκBα蛋白相对表达量
3 讨 论
DKD是糖尿病患者常见且又严重的并发症之一,中医药治疗DKD近年来取得较多的实验研究进展[12]。OPC具有广泛的药理学活性,并已被证明可通过改善各种病理变化延缓DKD进展。研究表明OPC具有缓解DKD大鼠肾功能不全和肾脏炎症、改善糖脂代谢紊乱、降低空腹血糖的趋势[8,13]。此外,OPC可抑制肾纤维化,并抑制DKD的肾小管上皮细胞向间质细胞转化[9]。本研究以STZ诱导的DKD大鼠模型为研究对象,探讨OPC对DKD大鼠肾脏的保护作用及其分子机制。本研究证明,OPC不仅能减轻STZ诱导的DKD大鼠的肾功能损害和炎症反应,而且能抑制STZ诱导的DKD大鼠TLR 4/NF-κB通路,提示OPC可能通过抑制TLR 4/NF-κB通路而减轻DKD。
本研究证明250、500 mg/kg OPC治疗可明显减轻DKD大鼠模型的肾损伤,8周时大鼠肾脏病理情况得到改善,Masson染色显示OPC中、高剂量治疗组肾脏纤维化显著改善。表现为空腹血糖、肾脏指数、24 h尿微量蛋白、血清肌酐和血尿素氮的降低,而500 mg/kg的OPC可显著减轻DKD大鼠模型的肾损伤、抑制炎症因子IL-1β、IL-6和MCP-1水平。IL-1β和IL-6均具有广泛生物活性,IL-1β有较强的促炎活性,而IL-6则是较强的继发性炎症介质。而MCP-1也是一种对单核细胞具有激活和趋化作用的趋化因子,在DKD炎症过程中发挥着重要作用。越来越多的证据支持IL-1β、IL-6、MCP-1等炎症因子和炎症反应在DKD的发病机制中发挥重要作用[14,15]。在糖尿病患者中也证实了IL-1β、IL-6、MCP-1水平较高[16]。
TLR4/NF-κB通路已证实在多种炎症相关疾病的发生机制中发挥作用,其通路激活与IL-1β、IL-6、MCP-1表达存在关系。关于TLR4/NF-κB通路发挥促炎作用参与到糖尿病、糖尿病并发症的研究也有报道,TLR4通路激活后触发的NF-κB依赖性炎症反应,可加重急、慢性肾脏疾病[10,17,18]。足细胞、肾小管上皮细胞的TLR4可在高糖环境下被激活,进而活化NF-κB以及下游炎症和纤维化反应的相关分子。使用小干扰RNA沉默近曲小管上皮细胞中TLR4,可减弱高糖诱导的IκB/NF-κB活化,并抑制下游炎症细胞因子IL-6和趋化因子配体2(即MCP-1)[19]。在DKD患者的肾小管中也发现了TLR 4表达增加,且肾小管TLR4表达与间质巨噬细胞浸润相关,与估计肾小球滤过率呈负相关,而TLR 4介导的途径可能促进DKD的肾小管间质炎症[20]。本研究同样证明,OPC治疗可抑制DKD大鼠肾脏中TLR 4/NF-κB通路的激活。既往类似研究表明,OPC通过抑制db/db小鼠糖尿病NF-κB活化而实现肾小球基底膜增厚、系膜扩张和肾小球面积,抑制氧化应激,改善肾脏纤维化[7]。
综上所述,本研究发现OPC可通过减轻肾脏损伤、炎症反应凋亡而减轻DKD。OPC对DKD的肾脏保护作用可能与抑制TLR 4/NF-κB通路有关。本研究有助于更好地理解OPC参与DKD的机制,并为OPC在DKD治疗中的潜在应用提供新的证据。
