微小RNA-29b靶向卷曲蛋白6参与急性髓系白血病细胞柔红霉素耐药的分子机制
2023-05-09赖思含
赖思含,何 莹,易 海
急性髓系白血病(acute myeloid leukemia,AML)是最常见的急性白血病,占急性白血病的80%[1]。阿糖胞苷和柔红霉素(daunorubicin,DNR)组合是治疗AML的一线方案[2]。尽管大量的AML患者通过这种治疗实现了初始诱导缓解,但化疗耐药性仍然是治疗失败的关键因素[3]。因此,探索AML化疗耐药的潜在机制并开发有效的新策略至关重要。微小RNA(microRNAs,miRNAs)是一个高度保守的内源性非编码RNA,可通过与3′-非翻译区(3′-untranslated region,3′-UTR)结合降解或阻断靶基因mRNA翻译,从而负向调节靶基因的表达。越来越多的证据表明,miRNAs通过调节涉及细胞存活、增殖、分化和凋亡的多种靶基因的表达,在AML治疗中发挥关键作用[4,5]。有研究发现,微小RNA-29b(microRNA-29b,miR-29b)可通过负靶向调控信号转导和转录激活因子3抑制AML细胞增殖,诱导细胞凋亡[6],但miR-29b在AML化疗耐药中的机制尚不清楚。通过生物信息学分析发现,卷曲蛋白6(frizzled-6,FZD6)是miR-29b潜在靶标基因,且已有研究证实,FZD6参与调控AML的发病机制[7]。本研究旨在探讨miR-29b靶向FZD6参与AML细胞DNR耐药的分子机制。
1 材料与方法
1.1 细胞与主要试剂 AML细胞系HL-60、KG-1、THP-1和Kasumi-1购自中国上海科学院细胞库。
DNR(28008-55-1,纯度98%)购自上海Chemesky,RPMI-1640培养液(PM150110A,含青/链霉素)购自武汉Procell,miR-29b模拟物(miR-29b mimics)及其阴性对照(miR-NC mimics)、FZD6过表达载体(pcDNA-FZD6)及其空载体阴性对照(pcDNA)、3′-UTR FZD6野生型(FZD6-WT)和FZD6突变型(FZD6-MUT)均由上海生工设计并合成。Lipo 2000转染试剂(11668-019)、一抗FZD6(720414,79 kDa)和GAPDH(MA1-16757,36 kDa)购自美国Thermo Fisher,CCK-8细胞增殖检测试剂盒(BB-4202)购自上海BestBio,TRIzolTM试剂(CY80286)购自上海超研,反转录试剂盒(CD-102539GM)购自武汉纯度,SYBRTMPrimeScript RT-PCR试剂盒(RR064B-1)购自日本TAKARA,双分子荧光素酶报告基因检测试剂盒(DD1205-01)、BCA蛋白浓度测定试剂盒(E112-01)、Annexin V-FITC/PI凋亡检测试剂盒(A211-01)购自南京Vazyme,RIPA裂解液(JN0191-YJR)、Edu法细胞增殖检测试剂盒(KFS342)购自北京百奥莱博。
1.2 方法
1.2.1 细胞培养与分组 AML细胞系HL-60、KG-1、THP-1和Kasumi-1维持在RPMI-1640培养液中(含胎牛血清和青/链霉素),在37 ℃和5%CO2的湿润氛围中培养。DNR溶解在二甲亚砜(DMSO)中。对数期生长的HL-60、KG-1、THP-1和Kasumi-1使用不同浓度的(0、2、4、8、16 mM)[8]DNR处理培养24 h。
取对数期生长的THP-1细胞分为5组:Control组、miR-NC mimics组、miR-29b mimics组、miR-29b mimics+pcDNA组、miR-29b mimics+pcDNA-FZD6组。Control组细胞正常培养;miR-NC mimics组细胞转染miR-NC mimics;miR-29b mimics组细胞转染miR-29b mimics;miR-29b mimics+pcDNA组转染miR-29b mimics+pcDNA;miR-29b mimics+pcDNA-FZD6组细胞转染miR-29b mimics+pcDNA-FZD6。转染方法均按照试剂盒说明书操作转染24 h。以上5组细胞转染成功后均使用10 mM DNR处理培养24 h。
1.2.2 CCK-8检测AML细胞增殖活性 将按照上述培养的不同AML细胞及DNR处理的各组THP-1细胞以1×104个/孔的密度接种在96孔板中,培养48 h后,根据制造商说明书使用CCK-8细胞增殖检测试剂盒检测细胞活力。通过酶标仪检测各孔细胞在450 nm处的吸光度(absorbance,A值),同时计算DNR对不同AML细胞产生50%生长抑制的浓度(IC50)。细胞增殖率=A实验组/A对照组×100%。
1.2.3 实时定量聚合酶链反应(qRT-PCR)检测miR-29b和FZD6 mRNA 使用TRIzolTM试剂从按照上述方法培养的不同AML细胞及DNR处理的各组THP-1细胞中提取总RNA,使用反转录试剂盒制备cDNA,通过SYBRTMPrimeScript RT-PCR试剂盒检测miR-29b和FZD6 mRNA的相对表达水平。具体的qRT-PCR的反应体系及程序均按照试剂盒说明书操作。以2-ΔΔCt来表示目的基因的相对表达水平。
引物序列:miR-29b,上游引物5′-GGTACCGGTTGTCTTGGGTTTATTG-3′,下游引物5′-GAATTCAAATACTTCAGAGCTG-3′;U6,上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′;FZD6,上游引物5′-ATGGAAAGGTCCCCGTTTCTG-3′,下游引物5′-GGGAAGAACGTCATGTTGTAAGT-3′;GAPDH,上游引物5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物5′-TGTAGACCATGTAGTTGAGGTCA-3′。
1.2.4 双荧光素酶报告基因检测miR-29b与FZD6靶向关系 经ENCORI(http://starbase.sysu.edu.cn/)网站预测发现,FZD6 mRNA的3′-UTR与miR-29b存在相互结合位点。取按照正常方法培养的THP-1细胞,将FZD6-WT和FZD6-MUT分别连接到pGL3载体后分别与miR-NC mimics或miR-29b mimics转染,依次作为miR-NC mimics+FZD6-WT组、miR-29b mimics+FZD6-WT组、miR-NC mimics+FZD6-MUT组和miR-29b mimics+FZD6-MUT组,通过双荧光素酶报告基因检测各组细胞的荧光素酶活性。
1.2.5 免疫印迹(Western blot)检测THP-1细胞中FZD6水平 使用RIPA试剂从按照上述方法培养的DNR处理的各组THP-1细胞中提取总蛋白,通过BCA法对蛋白浓度进行定量。通过10% SDS-PAGE分离蛋白,使用湿转法将蛋白转移到PVDF膜上,添加5%脱脂牛奶室温孵育2 h,添加按照1∶1000比例稀释的FZD6和GAPDH一抗在4 ℃过夜孵育,隔天使用PBS冲洗膜后,添加按照1∶5000比例稀释的HRP标记二抗室温孵育2 h,采用ECL发光液显影后使用凝胶成像系统拍照,通过Image J软件分析各蛋白的灰度值,FZD6蛋白相对表达量=FZD6灰度值/GAPDH灰度值。
1.2.6 Edu法检测THP-1细胞增殖情况 将按照上述方法培养的DNR处理的各组THP-1细胞接种于6孔板中(2×105个/孔),培养48 h后,按照Edu法细胞增殖检测试剂盒中操作方法测定细胞增殖,细胞核使用5 mg/ml Hoeschst 3433染色30 min。Edu阳性细胞呈绿色,Hoeschst 3433细胞呈蓝色。Edu阳性细胞率=绿色细胞/蓝色细胞×100%。
1.2.7 流式细胞术检测THP-1细胞凋亡率 将按照上述方法培养的DNR处理的各组THP-1细胞接种于96孔细胞培养板中(2×105个/孔),培养48 h后,分别添加100 ml结合缓冲液和5 ml Annexin V-FITC室温避光孵育30 min后,加入10 ml碘化丙啶(PI)避光孵育5 min。使用流式细胞仪检测各孔细胞的凋亡率。
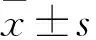
2 结 果
2.1 miR-29b表达与AML细胞中DNR耐药性的相关性 结果显示,不同AML细胞系对DNR的耐药性不同,其增殖率随着DNR浓度的增高而降低(表1),呈现浓度依赖性;且THP-1、KG-1、HL-60和Kasumi-1细胞的IC50分别为10.470、7.994、6.319和4.927 mM。qRT-PCR结果显示,miR-29b在AML细胞系THP-1(1.00±0.05)、KG-1(1.87±0.16)、HL-60(2.96±0.21)及Kasumi-1(3.73±0.29)中的表达逐渐增高(P<0.05)。后续研究选用AML细胞耐DNR更高的THP-1细胞为研究对象,选择药物处理浓度为10 mM。
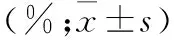
表1 CCK-8测定AML细胞在不同DNR浓度下的细胞增殖率
2.2 miR-29b与FZD6靶向关系验证 经生物信息学分析发现,FZD6 mRNA的3′-UTR存在miR-29b的互补结合位点(图1)。双荧光素酶报告基因检测结果显示,与miR-NCmimics+FZD6-WT组相比,miR-29b mimics+FZD6-WT组细胞中相对荧光素酶活性显著降低(1.01±0.02vs.0.32±0.04,P<0.05);与miR-NC mimics+FZD6-MUT组相比,miR-29b mimics+FZD6-MUT组细胞中相对荧光素酶活性无统计学差异(0.98±0.06vs.1.00±0.05)。

图1 miR-29b与FZD6靶向结合位点图
2.3 miR-29b和FZD6在DNR处理的各组THP-1细胞中的表达水平 与miR-NC mimics组相比,miR-29b mimics组THP-1细胞中miR-29b表达水平增高,FZD6 mRNA和蛋白水平降低(P<0.05);与miR-29b mimics+pcDNA组相比,miR-29b mimics+pcDNA-FZD6组THP-1细胞中miR-29b表达变化无差异,FZD6 mRNA和蛋白水平增高(P<0.05);而miR-NC mimics组与Control组、miR-29b mimics+pcDNA组与miR-29b mimics组miR-29b和FZD6表达水平变化无统计学差异(图2、表2)。

图2 Western blot检测各组THP-1细胞中FZD6蛋白水平A. Control;B. miR-NC mimics;C. miR-29b mimics;D. miR-29b mimics+pcDNA;E. miR-29b mimics+pcDNA-FZD6。
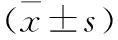
表2 miR-29b和FZD6在DNR处理的各组THP-1细胞中的表达水平
2.4 DNR处理的各组THP-1细胞增殖情况 与miR-NC mimics组相比,miR-29b mimics组THP-1细胞增殖率和Edu阳性细胞率降低(P<0.05);与miR-29b mimics+pcDNA组相比,miR-29b mimics+pcDNA-FZD6组THP-1细胞增殖率和Edu阳性细胞率增高(P<0.05);而miR-NC mimics组与Control组、miR-29b mimics+pcDNA组与miR-29b mimics组细胞增殖率和Edu阳性细胞率变化无统计学差异(图3、表3)。

图3 Edu测定DNR处理的各组THP-1细胞增殖变化A. Control;B. miR-NC mimics;C. miR-29b mimics;D. miR-29b mimics+pcDNA;E. miR-29b mimics+pcDNA-FZD6。
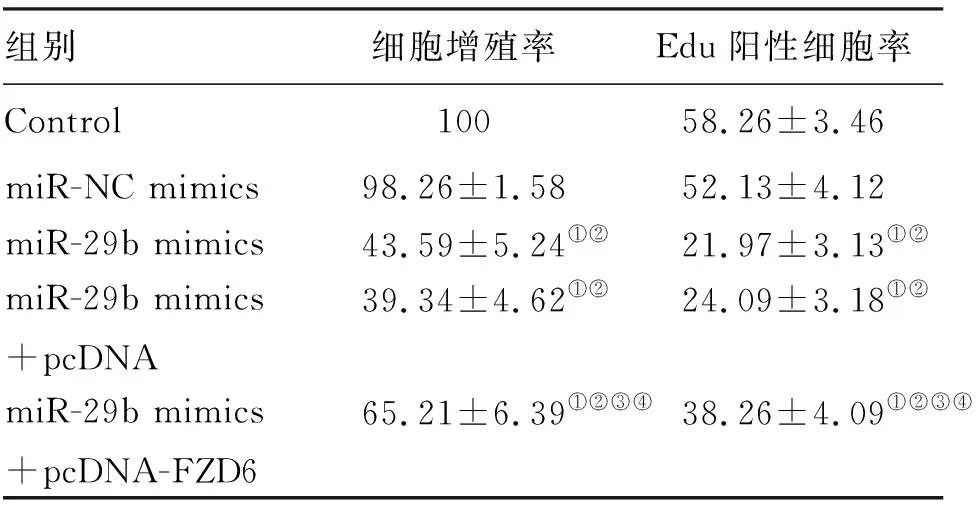
表3 CCK-8和Edu检测DNR处理的各组THP-1细胞增殖情况 (%)
2.5 DNR处理的各组THP-1细胞凋亡率分析 与miR-NC mimics组相比,miR-29b mimics组THP-1细胞凋亡率增高(42.65%±4.08%vs.10.04%±1.96%,P<0.05);与miR-29b mimics+pcDNA组相比,miR-29b mimics+pcDNA-FZD6组THP-1细胞凋亡率降低(19.62%±3.54%vs.45.09%±4.56%,P<0.05);而miR-NC mimics组与Control组、miR-29b mimics+pcDNA组与miR-29b mimics组细胞凋亡率变化无统计学差异(图4)。

图4 流式细胞术检测DNR处理的各组THP-1细胞凋亡状况A. Control;B. miR-NC mimics;C. miR-29b mimics;D. miR-29b mimics+pcDNA;E. miR-29b mimics+pcDNA-FZD6。
3 讨 论
由于对阿糖胞苷联合DNR的标准诱导化疗耐药,AML在大多数情况下仍具有较差的长期生存率和高复发风险[8,9]。因此,有必要对AML耐药机制进行研究,以期为提高DNR的治疗效果提供依据。
既往研究表明,miRNA异常表达参与包括血液恶性肿瘤在内的多种癌症发生发展过程。已有大量研究表明,miR-29b可作为肿瘤抑制因子参与多种肿瘤细胞的增殖、凋亡及耐药性等生物学过程,同时在机体的适应性免疫应答反应中也具有重要作用,有望成为癌症的新型诊断标志物和治疗靶点[10]。据报道,miR-29b在子宫颈癌细胞中通过直接调控磷酸酶和张力蛋白同源物抑制肿瘤细胞的增殖并减少迁移和侵袭,同时还通过调控Bax和Bcl-2来增强子宫内膜癌细胞对顺铂的敏感性并增强顺铂诱导的细胞凋亡[11]。miR-29b的表达在胶质瘤组织和细胞中下调[12],可通过直接靶向抑制信号转导和转录激活因子3抑制胶质瘤细胞生长,促进其凋亡,同时增强胶质瘤细胞对替莫唑胺的敏感性[12]。此外,miR-29b已被证实在AML及慢性淋巴细胞白血病中下调,且其表达水平的降低与AML进展相关,过表达miR-29b可增强AML细胞凋亡[13,14]。本研究首先通过对不同AML细胞系对DNR耐药性的研究发现,不同AML细胞系对DNR的敏感性不同;同时通过检测不同AML细胞系中的miR-29b表达发现,对DNR耐药性高的细胞系显示出较低的miR-29b表达,表明miR-29b表达与AML细胞中DNR耐药性呈现负相关,暗示了miR-29b过表达可作为提高AML对DNR敏感性的证据,因此推测,高表达miR-29b可以降低AML细胞中的DNR耐药性。为进一步证实AML细胞中miR-29b表达和DNR耐药性的关联,我们通过用miR-29b模拟物来过表达miR-29b,结果显示,miR-29b过表达可降低AML细胞的增殖能力,增强细胞的凋亡能力,这些结果表明,miR-29b表达的上调可以恢复AML细胞对DNR的敏感性,降低DNR耐药性。
虽然上调miR-29b可以部分缓解AML细胞中的DNR抗性,但此种现象的分子机制还未可知。本研究使用生物信息学方法来预测miR-29b的潜在靶标,结果显示,FZD6含有miR-29b的靶标结合位点,为进一步确认二者的关系,通过双荧光素酶报告基因检测、qRT-PCR及Western blot检测证明,FZD6确为AML细胞中miR-29b的直接靶标基因。FZD6属于卷曲家族,已被证明在癌细胞增殖、凋亡中具有重要的作用。如:非编码RNA可通过靶向调控FZD6激活Wnt/β-catenin信号通路,从而参与调控膀胱癌、结直肠癌等癌症恶性生物学行为[15,16]。且有研究表明,FZD6可触发激活Wnt信号参与调控T细胞急性淋巴细胞白血病和AML发病机制,可作为治疗的潜在靶点等[7, 17]。此外,已有研究证实,miR-29b可通过靶向下调FZD6表达来抑制成纤维细胞增殖、迁移和分化[18]。然而,FZD6在AML耐药机制中的作用以及miR-29b和FZD6在AML中的关系尚不清楚。本研究证明了在过表达miR-29b的AML细胞中上调FZD6表达,可显著降低AML细胞对DNR的敏感性,增强细胞增殖能力,抑制细胞凋亡能力,说明上调FZD6可逆转miR-29b对AML细胞耐药性的影响。
综上,miR-29b过表达可降低AML细胞对DNR的耐药性,此过程是通过负靶向调控FZD6实现的。总的来说,本研究提出并初步验证了miR-29b通过直接靶向FZD的3′-UTR区域来提高AML对DNR的敏感性,其在AML细胞中的耐药性关系,有助于理解AML治疗中涉及的潜在机制。然而,仍需更多的研究来确定miR-29b是否可以用于AML临床治疗。
