CDKL2甲基化调控恶性胶质瘤细胞生长的作用机制研究
2023-05-09汪玲果蔺鹏楨
陈 博,汪玲果,蔺鹏楨
胶质瘤是最常见的人类中枢神经系统原发恶性肿瘤之一,约占颅内原发肿瘤的65%[1]。近年来,世界范围内胶质瘤的发病率呈现急剧上升的趋势[2]。目前,手术依旧是最主要的治疗方法,其他治疗方法有放疗、化疗和免疫治疗[3-4]。但目前即使手术结合术后放疗、化疗,预后效果仍较差、复发率高[5-6]。因此,需要寻找新的潜在靶点和治疗手段来治疗胶质瘤。
细胞周期蛋白依赖性激酶2(CDKL2)位于染色体4q21,根据结构域的氨基酸分析,其结构域与激酶结构域具有一定的相似性,被归类于cdc2相关丝氨酸/苏氨酸激酶亚家族的成员[7]。CDKL2被认为与大脑的行为和神经系统疾病有关[8]。研究发现,CDKL2与某些肿瘤疾病的发生具有一定的相关性,例如前列腺癌、乳腺癌、肝癌以及胶质瘤[9-11]。此外,CDKL2表达降低与胶质瘤的进展及不良预后相关[12]。通过DNA甲基化分析结果表明,胶质瘤呈现异常CDKL2甲基化水平[11]。DNA甲基化是表观遗传修饰方法之一,可将甲基加在DNA分子中。DNA甲基化可以在不改变DNA序列的情况下改变DNA片段的活性。通常情况下,位于基因起始子位置的DNA甲基化会抑制基因的转录。然而,CDKL2甲基化水平与胶质瘤的生长以及临床作用的相关性仍待阐明。因此,本研究通过检测胶质瘤和正常组织中CDKL2的甲基化水平,探讨临床胶质瘤组织中CDKL2的甲基化水平及其和肿瘤生长的关系,评估甲基化抑制剂对胶质瘤生长的作用,并探讨其潜在的临床意义。
1 材料及方法
1.1 细胞系及主要试剂 人胶质母细胞瘤细胞A172、人脑星形胶质母细胞瘤细胞U87、人胶质瘤细胞U251系购自美国模式菌种库(ATCC)。
选取2015年—2018年陕西省人民医院神经外科进行胶质瘤手术病人的切除组织,其中瘤组织为癌症病人的肿瘤组织,癌旁组织为距离肿瘤区域1~3 cm的组织,正常组织为距离肿瘤区域>5 cm的区域,所有病人均知情同意并签署知情同意书。本研究经医院伦理委员会批准。
QIAamp DNA FFPE组织试剂盒购自Qiagen公司(美国),甲基化敏感性限制酶Hin6I购自Fermentas公司(美国),SYBR Green qPCR master mix购自Bio-rad公司(美国),PrimeScriptTMRT试剂盒购自Takara公司(中国),蛋白酶抑制剂cocktail购自Roche Applied Science公司(美国),二喹啉甲酸(BCA)试剂盒购自CWBIO公司(中国),CDKL2抗体和β-actin抗体购自Abcam公司(美国),蛋白免疫印迹法(Western Blot)化学发光液购自PierceBioscience公司(美国)。
1.2 DNA提取 严格按照说明书使用QIAamp DNA FFPE组织试剂盒提取组织样本中的DNA。通过标准蛋白酶K消化和苯酚/氯仿提取从冷冻组织中分离DNA。DNA浓度通过NanoDrop-2000c进行测量。所有DNA样品于-20 ℃保存使用。
1.3 甲基化分析 采用改良后的甲基化敏感性限制酶方法消化DNA。首先,使用40 U甲基化敏感性限制酶(MSRE)Hin6I在50 L反应体积中消化500 ng DNA 72 h,反应温度为37 ℃。未消化的对照组样品以相同的方式处理,加入不含DNase的水代替酶。为了确保酶可以被完全消化,同时消化未甲基化的对照和甲基化的样品。孵育完成后,在65 ℃将酶失活20 min。失活后,在Bio-Rad CFX96TM实时聚合酶链式反应(PCR)监测系统上进行定量PCR。每个反应体系体积为20 μL,其中包括SYBR Green qPCR master mix、0.5 μmol/L正向引物和反向引物和模板。通过熔解曲线分析验证PCR产物的特异性。在每次PCR中均使用未甲基化的对照,甲基化的对照和空白对照。使用公式100%×2△Cq(undigested-digested)计算特定基因的甲基化水平。未甲基化对照组的甲基化水平必须接近零,而甲基化组对照必须接近1,以确保100%的消化效率。CDKL2-MSRE正向引物为GCTCGGCCAATCAGAAGAAG,反向引物为CCACCTCCCAGCTCGTAA。
1.4 基因表达分析 使用PrimeScriptTMRT试剂盒,对mRNA逆转录获得cDNA。使用Bio-Rad CFX96TM进行实时定量聚合酶链式反应(qRT-PCR)系统来测量CDKL2的表达水平。CDKL2的相对表达水平通过内参基因(ACTB)进行分析,并使用相对表达量计算方法(2-△Cq)进行计算。CDKL2-qPCR正向引物为GATTTGCTGAGAGGTTTT,反向引物为CTATTTTGTTGTGGCTTG;ACTB-qPCR正向引物为CAGAGCCTCGCCTTTGCC,反向引物为CATGCCGGAGCCGTTGTC。
1.5 蛋白提取及表达分析 将细胞在裂解液中裂解,裂解液含137 mmol/L的NaCl、2 mmol/L的乙二胺四乙酸、1%Triton X,10%甘油、1 mmol/L的二硫苏糖醇(DTT)以及蛋白酶抑制剂混合物。使用BCA试剂盒对蛋白质浓度进行定量,然后通十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白裂解物,并使用恒定电流将蛋白转印到聚偏二氟乙烯膜(PVDF)上。使用Tris缓冲盐水(TBS)、5%脱脂牛奶和0.1%的Tween-20进行封闭。封闭1 h后将膜和CDKL2抗体4 ℃孵育过夜,β-actin抗体作为对照。使用TBS清洗PVDF膜后,于室温下孵育二抗1 h。使用化学发光液将印记可视化后于暗室曝光。
1.6 细胞增殖实验 将经DNA甲基化抑制剂处理(实验组)和磷酸缓冲盐溶液(PBS)处理(对照组)的U87细胞系以每孔200个细胞的密度接种到6孔板中。2周后,将细胞用75%乙醇固定30 min。然后用0.5%结晶紫溶液将菌落染色并计数。每个实验重复3遍。
1.7 免疫组化 将肿瘤组织固定在福尔马林中,包埋于石蜡中并切成4 μm厚切片。将切片脱蜡后,用3%双氧水处理10 min,并且与CDKL2抗体(1∶100稀释度)在4 ℃下孵育1 h,然后再与过氧化物酶孵育1 h。用TBS冲洗后,将切片与二氨基联苯胺(DAB)孵育5 min。在水中洗涤后使用苏木精复染。
1.8 体内移植瘤实验 选取4周大的雄性Balb/c裸鼠10只,分为实验组和对照组,每组5只。裸鼠购于西安交通大学实验动物中心,许可证号:SCXK(陕)2020-002。将4×106的未经DNA甲基化抑制剂处理或经甲基化抑制剂处理的U251细胞系注射至裸鼠皮下,从接种后的第7天开始,每隔7 d测量1次肿瘤体积。肿瘤体积的计算公式为:V=L×W2/2,其中V代表体积(mm3),L代表最大直径(mm),W代表最小直径(mm)。在第22天处死小鼠,并测量肿瘤重量。

2 结 果
2.1 胶质瘤中CDKL2的甲基化水平 采用MSRE-qPCR分别检测胶质瘤细胞系(A172、U87和U251)和正常脑胶质细胞中的CDKL2甲基化水平,结果表明,相较于正常脑胶质细胞[甲基化水平为(1.20±0.08)%],CDKL2在胶质瘤细胞A172中甲基化水平为(76.0±3.3)%,在U87中甲基化水平为(85.0±3.9)%,在U251中甲基化水平为(83.0±3.7)%,均呈现高甲基化水平。为了进一步验证胶质瘤中CDKL2的甲基化水平,本研究检测了178个胶质瘤组织样本,169个癌旁正常组织样本和30个正常脑组织样本中的CDKL2甲基化水平,结果显示,相较于癌旁正常组织和正常脑组织,胶质瘤组织中CDKL2甲基化水平明显升高(P<0.000 1),详见图1。为了探究CDKL2甲基化水平的临床诊断价值,本研究使用受试者工作特征曲线(ROC)分析评估了CDKL2作为胶质瘤潜在的生物标志物的水平。如图2、图3所示,CDKL2甲基化可区分胶质瘤和癌旁正常组织,且可以区分癌旁正常组织和正常脑组织,ROC曲线下面积(AUC)值分别为0.854(P<0.001)和0.797(P<0.001)。CDKL2甲基化水平在区分胶质瘤与癌旁正常组织的敏感度为0.721,特异度为0.782。

图1 MSRE-qPCR检测

图2 脑胶质瘤组织和癌旁正常组织中CDKL2甲基化水平ROC图

图3 癌旁正常组织和正常脑组织中CDKL2甲基化水平ROC图
2.2 CDKL2的高甲基化水平和表达水平之间的关系 本研究分别检测了30个胶质瘤组织样本和30个正常组织样本中CDKL2的表达水平。如图4所示,相较于正常组织,CDKL2在胶质瘤中表达水平较低(P<0.000 1)。结合图2、图3的甲基化水平结果,本研究对于胶质瘤样本中CDKL2的甲基化水平和mRNA水平进行分析,结果显示,CDKL2的甲基化水平和mRNA水平呈负相关(见图5)。采用Western Blot法进一步验证CDKL2在正常组织中和胶质瘤组织中的蛋白表达,结果显示胶质瘤相较正常组织,CDKL2蛋白表达水平较低(见图6)。免疫组化检测结果表明,胶质瘤中CDKL2的表达水平较低(见图7)。
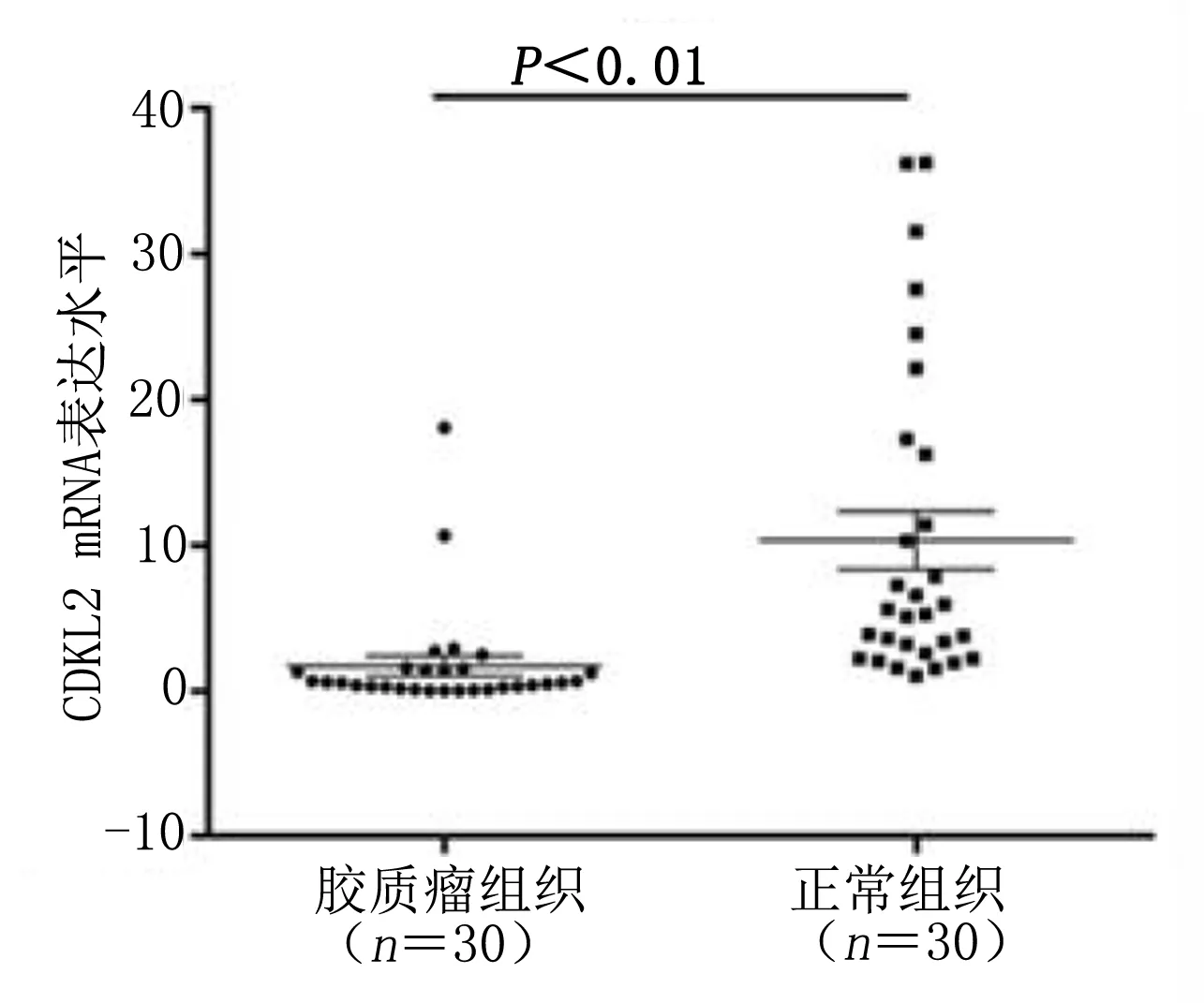
图4 qPCR检测CDKL2在胶质瘤组织和正常组织中的表达水平

图5 CDKL2的甲基化水平和表达水平之间的关系

图6 Western Blot法检测胶质瘤组织和正常组织中CDKL2蛋白表达水平条带图

图7 免疫组化分析正常组织和胶质瘤组织中CDKL2的表达水平
2.3 CDKL2甲基化与临床病理特征之间的相关性 入选胶质瘤病人的临床资料见表1。进一步分析表明,病理分级与CDKL2甲基化相关,胶质瘤Ⅳ级病人的肿瘤中CDKL2甲基化水平更高(P<0.01,见图8A)。在不同生存期病人的肿瘤中CDKL2甲基化差异无统计学意义(P>0.05,见图8B)。低表达CDKL2的肿瘤组织中CDKL2甲基化水平更高(P<0.05,见图8C、图8D)。

表1 胶质瘤病人的临床资料(n=137)

图8 CDKL2甲基化、胶质瘤病人临床病理特征、mRNA和蛋白表达水平的关系(A为不同分期肿瘤中CDKL12甲基化水平;B为不同生存年限病人肿瘤中CDKL12甲基化水平;C为不同CDKL12 mRNA表达水平肿瘤中甲基化水平;D为不同CDKL12蛋白表达水平肿瘤中甲基化水平)
2.4 CDKL2甲基化水平调控胶质瘤细胞的生长 为了研究CDKL2甲基化水平如何调控肿瘤细胞的生长,本研究使用了DNA甲基化抑制剂5-aza-2′-deoxycytidine对CDKL2甲基化进行抑制。qPCR结果表明,相较于对照组(甲基化水平为81%),DNA甲基化抑制剂可以较好地抑制CDKL2的甲基化(39.20±3.62)%,并且DNA甲基化抑制剂可以提高胶质瘤细胞中CDKL2的mRNA水平[甲基化组mRNA表达水平是对照组的(1.52±1.62)倍]和蛋白表达水平(见图9)。集落形成实验结果表明,相较于对照组,抑制剂组抑制胶质瘤细胞的增殖能力(见图10)。

图9 qPCR检测对照组和抑制剂组U87细胞CDKL2蛋白表达条带图

图10 集落形成实验检测对照组和抑制剂组U87细胞生长能力
2.5 体内实验验证CDKL2甲基化和胶质瘤生长的关系 为了进一步验证CDKL2高甲基化可促进胶质瘤细胞的生长,本研究将U87细胞接种在裸鼠皮下,建立移植瘤模型,抑制剂组注射5-aza-2′-deoxycytidine,对照组注射PBS(见图11)。肿瘤体积的变化显示,相较于对照组,抑制剂组的小鼠肿瘤生长速度相对缓慢(见图12)。3周后处死小鼠,将小鼠肿瘤组织取出并测量体积,结果表明,相较于对照组,抑制剂组肿瘤体积更小(P<0.01),见图13。MSRE-qPCR检测对照组和抑制剂组小鼠胶质瘤中CDKL2的甲基化水平,结果表明,相较于对照组甲基化水平的(61.80±2.37)%,抑制剂组小鼠的胶质瘤中CDKL2的甲基化水平降低为(37.80±1.35)%。免疫组化染色结果表明,抑制剂组胶质瘤组织中CDKL2的表达水平低于对照组(见图14)。提示抑制CDKL2的甲基化可抑制胶质瘤生长。

图11 对照组和抑制剂组的体内移植瘤模型

图12 3周后对照组和抑制剂组的肿瘤大小

与抑制剂组比较,* P<0.05;# P<0.01。图13 对照组和抑制剂组在接种肿瘤细胞1周后、2周后、3周后的移植瘤体积

图14 免疫组化染色检测对照组和抑制剂组小鼠胶质瘤组织CDKL2表达水平
3 讨 论
神经胶质瘤是中枢神经系统中最常见的原发性恶性肿瘤之一,其特征是发病率高和存活率低[13]。近年来,脑胶质瘤的发病率逐年升高,并呈现年轻化趋势[2]。因此,研究影响胶质瘤生长的潜在分子机制,寻找新的生物标志物十分关键。本研究结果表明,胶质瘤中CDKL2呈高甲基化状态,抑制CDKL2甲基化可明显抑制胶质瘤的生长。
DNA甲基化是重要的表观修饰之一,DNA甲基化状态的异常可能会抑制某些基因的转录,并且通常与癌症的发生和进展存在一定关联[14]。有研究报道,CDKL2的异常DNA甲基化状态可能与胶质瘤呈现一定的相关性。但是,由于样本量有限,该研究没有对临床数据进行深入的研究以及寻找临床数据和CDKL2甲基化的关联[11]。本研究对不同胶质瘤细胞系和大量胶质瘤样本组织的CDKL2甲基化水平进行研究,结果表明,胶质瘤细胞及组织中的CDKL2的甲基化水平高于正常细胞及组织,mRNA和蛋白表达水平低于正常细胞及组织。因此,CDKL2基因特异性的高甲基化可能通过介导转录沉默在胶质瘤进展中发挥一定的作用。DNA甲基化在癌变过程中易于检测,因此可以作为重要的潜在生物标志物之一[15-17]。已经有多项研究结果表明,DNA甲基化可以作为肿瘤诊断生物标志物[18-19]。本研究结果显示,胶质瘤中CDKL2的甲基化水平高,ROC分析表明CDKL2的甲基化水平作为生物标志物具有较高的特异度和敏感度。此外,5-aza-2′-deoxycytidine作为一种DNA甲基化抑制剂,被广泛应用于癌症的治疗中[20-21]。本研究结果表明,5-aza-2′-deoxycytidine可以有效抑制CDKL2的甲基化水平从而解除CDKL2高甲基化的转录沉默,使CDKL2表达水平增高,在体外和体内水平抑制胶质瘤细胞的增殖。
综上所述,胶质瘤中CDKL2呈高甲基化、低表达状态,使用甲基化抑制剂可以抑制CDKL2甲基化从而抑制胶质瘤的生长,不仅为临床中脑胶质瘤的诊断提供了一种检测标志物,还可能为脑胶质瘤的治疗提供一些思路。
