抑郁症的人格类型及其脑功能连接基础*
2023-05-08位东涛
李 彧 位东涛 邱 江
抑郁症的人格类型及其脑功能连接基础*
李 彧1,2,3位东涛1,2邱 江1,2
(1西南大学认知与人格教育部重点实验室;2西南大学心理学部;3西南大学教育学部, 重庆 400715)
本研究采用功能随机森林的方法, 将聚类过程与抑郁症诊断相结合, 分别在抑郁症和控制组中识别了人格类型(神经质和外向性的组合), 并进一步探究了不同人格类型的静息态功能连接差异。聚类分析结果显示, 抑郁症以高神经质和低外向性趋势的个体为主, 但同样有低神经质和高外向性趋势的个体。控制组样本则以低神经质和高外向性个体为主。静息态功能连接的结果显示:在不考虑人格亚型的情况下, 抑郁症和控制组在杏仁核/海马/脑岛−边缘网络/默认网络/控制网络的功能连接上均无显著差异。在纳入聚类分析所划分的亚型进行统计后, 多种人格类型在左侧杏仁核/脑岛−边缘网络(以眶额皮质区域为主)的功能连接强度上呈现出显著差异。本研究基于个人视角识别的抑郁症人格类型更符合现实情况与个体认知模式, 具有潜在的临床应用价值, 并且其功能连接的差异对理解抑郁症异质性提供了神经层面的参考。
神经质, 外向性, 静息态功能连接, 抑郁症, 以个体为中心
1 引言
近年来, 心理健康研究中的异质性问题备受重视。有研究者指出它限制了心理健康与认知神经方向的研究(Feczko et al., 2019), 需要进行一场异质性“革命” (Bryan et al., 2021)。与此同时, 强调样本异质性的以人为中心的人格研究路径(人格分类的角度)受到了更多的关注(尹奎等, 2021)。已有研究者结合人格类型学的优势, 发现不同类型的人与心理健康问题及其治疗效果有着明显不同的联系(Isler et al., 2017)。另一方面, 抑郁症病人的异质性一直是一个不可忽视的问题(多数研究忽略实际情况, 直接假定样本同质), 但大量实证研究聚焦于孤立的人格特质与抑郁症的关系(Klein et al., 2011), 鲜有研究从人格分类角度考虑个体差异的影响。
当代人格类型学的研究源于Jack Block。其后, Asendorpf, Robins和Caspi等人相继重复出了3种人格类型(RUO人格类型) (Asendorpf et al., 2001):弹性型(resilients)、控制不足型(undercontrollers)和过度控制型(overcontrollers)。在一定程度上, RUO人格类型在五因素模型上的趋势倾向于:弹性型个体表现为神经质低, 其他维度均高; 过度控制型个体表现为神经质高, 外向性低; 控制不足型个体表现为宜人性和开放性均低的特点(Bohane et al., 2017; Donnellan & Robins, 2010)。但是已有不少研究者指出, RUO分类在统计上受到了广泛的挑战(Altman & Krzywinski, 2017)。因为使用不同的方法和数据样本获得的结果通常不能完全重复或识别出三个以上的类型(Herzberg & Roth, 2006), 甚至发现即使是得到RUO分类的研究也显示出较大的差异(Gerlach et al., 2018), 这都表明在一定程度上, RUO三种人格类型缺乏共识和可复制性。
目前, 少量实证研究基于五因素模型在抑郁症病人中发现了2种和5种人格类型。例如, Wardenaar和同事对146名重度抑郁症患者使用潜在剖面分析, 确定了2种人格类型。分别是具有高神经质, 低外向性, 低责任心, 高宜人性趋势的易感型和具有中等神经质, 中等外向性, 高责任心, 高宜人性趋势的弹性型(Wardenaar et al., 2014)。另一项针对急性冠脉综合征的抑郁症患者的纵向研究, 采用非层次K-means聚类分析, 对685名抑郁症患者进行分类, 也发现了弹性型和易感型两种人格类型(Kim et al., 2016)。此外还有一项关于抑郁症−焦虑症共病患者的分类研究。该研究采用潜在类别分析定义了5种人格类型, 这5种类型归纳起来是弹性型的2个亚型和过度控制型的3个亚型(Spinhoven et al., 2012)。综上, 抑郁症人格类型研究同样缺乏一致性, 但大部分研究发现了弹性型和易感型两种类型。
其次, 以往研究基本采用无监督聚类的方法来识别人格亚型。对于仅仅探索所有人格特质可能形成哪些人格类型的研究而言, 无监督聚类的方法是合适的。但是对于探索结合特定问题或结果(比如抑郁症状严重程度, 是否诊断为抑郁症, 是否具有创造性)的人格类型而言, 无监督聚类不能完全满足需要。并且, 从认知功能到临床疾病, 不一定都与相同的人格特质有关; 相反, 它们可能对应于不同人格特质的输入组合。例如, 研究者预期寻找具有高创造性的个体, 那么在聚类过程中, 需要将开放性维度作为输入特征(研究表明开放性与创造性存在高度相关) (Dollinger et al., 2004), 而宜人性不一定需要加入其中。目前神经质, 外向性对抑郁症状中等到强的预测效力已被广泛证明(McDonnell & Semkovska, 2020), 此外也有研究提到责任心对预测抑郁存在微弱的效力(Miller et al., 2020), 个别研究也提到开放性和宜人性与抑郁症状的相关(Khoo & Simms, 2018), 但后三者的可重复性很低。因此, 本研究选取与抑郁症最相关的人格特质(神经质和外向性)进行后续的聚类分析。聚类分析则采用最近提出的应用于临床精神病学领域的功能随机森林(functional random forest)算法(Chand et al., 2020)算法。综上, 不同于以往抑郁症类型研究采用的预先设定类别数目的无监督聚类(非层次K-means聚类分析, 潜在类别分析等)方法, 该方法是一种整合了有监督(随机森林机器学习)和无监督(社区探测聚类算法)统计的新颖的混合方法, 更加契合本研究。
另一方面, 研究表明, 抑郁症患者的大脑功能与健康对照组存在显著差异。尤其是杏仁核、海马、脑岛(Milne et al., 2012; Tang et al., 2018; Yan et al., 2022)等皮层下区域和边缘网络、默认网络、控制网络等皮层上网络(Peters et al., 2016; Rai et al., 2021; Scalabrini et al., 2020)。如下以抑郁症被试为主的研究或综述表明, 杏仁核是感知和识别情绪的中枢(Peluso et al., 2009); 海马与情景记忆的检索有关(Lorenzetti et al., 2009); 脑岛与注意监测, 情绪感知, 奖赏系统和决策等功能有关(Menon & Uddin, 2010; Sprengelmeyer et al., 2011)。它们是感知, 传递和整合情绪的关键区域, 与边缘网络、默认网络、控制网络协同调节一系列复杂的情绪和生理反应(抑郁症患者在这些脑功能上表现出异常的激活或连接模式) (Alexopoulos, 2002; Scalabrini et al., 2020; Sridharan et al., 2008)。此外, 这些脑功能活动还与人格特质有关。例如, 抑郁症患者在负性情绪认知重评任务中, 情绪易感性(神经质子维度)越高, 背外侧前额叶和杏仁核之间连接越弱(Fournier et al., 2017)。然而, 少有研究者探索抑郁症患者人格类型的神经基础(Knyazev, 2006), 其神经机制尚不明确。但这方面的研究可从神经层面阐释抑郁症异质性。
综上, 本研究旨在揭示抑郁症不同的人格类型, 并从大脑功能连接的角度验证不同类型的差异。不仅可为人格分类的有效性提供证据, 也为未来的抑郁症异质性研究提供参考。如前所述, 我们选取神经质和外向性(与抑郁症最相关, 可重复性最高的人格特质)作为输入特征, 采用功能随机森林进行聚类分析。然后根据分类结果, 验证人格类型在关键(与抑郁症相关的)皮层下区域和皮层上网络(杏仁核/海马/脑岛−边缘网络/默认网络/控制网络)的静息态功能连接是否存在差异。抑郁症类型研究尚无一致结论, 但可在一定程度上假设抑郁症中可能包含两种类型, 一种是低神经质和高外向性的低风险型(与前人研究中弹性型的神经质外向性的趋势相同), 一种是高神经质和低外向性的高风险类型(与前人研究中易感型的神经质外向性的趋势相同)。并且假设, 各人格类型在关键的静息态功能连接上存在差异。相较于以往研究从统计上构建的, 不一定存在于现实情境中的人格特质的交互效应, 本研究识别的抑郁症人格类型更符合现实情况以及个体的认知模式。不仅可以更好地揭示高抑郁风险的人格类型, 其所体现出的和标签一样的便捷与系统性, 也更具有潜在的临床应用价值。而且, 对不同类型的大脑功能连接基础的探索, 不仅可以检验分类的有效性, 还有助于从神经层面更好地认识抑郁症病人的异质性, 更好地帮助未来抑郁症脑机制的研究。
2 方法
2.1 被试
抑郁症患者来自重庆医科大学附属医院精神科。本研究中抑郁症患者选取标准如下:符合精神疾病诊断与统计手册第4版(轴Ⅰ障碍)中抑郁症的诊断标准; 无严重躯体疾病; 无严重神经系统疾病; 过去2周, 无急性或慢性感染, 无创伤、炎症、发热和过敏史; 无酒精和药物滥用史。此外, 抑郁症状严重程度评估使用17题的汉密尔顿抑郁量表(Hamilton Depression Scale, HAMD) (Hamilton, 1960), 该量表得分小于7分, 便没有抑郁症状。一共选取了159名患者(平均年龄为38.9岁, 标准差为13.3岁, 其中有98名女性)。所有病人的汉密尔顿抑郁量表得分均大于等于7分。控制组被试则从大学以及周边社区招募, 其筛选标准如下; 无抑郁症发作以及抑郁症病史; 无其他精神疾病史; 一级亲属无精神类疾病; 无严重躯体疾病和神经系统疾病史; 过去2周, 无急性或慢性感染, 无创伤、炎症、发热和过敏史; 无酒精及药物滥用史; 一共选取了156人(平均年龄为41.7岁, 标准差为15.9岁, 其中有102名女性)。所有控制组的HAMD得分均小于7分。考虑到艾森克人格问卷中, 掩饰维度得分过高的被试会有掩饰倾向(问卷结果可能失真), 因此选取的所有被试得分均未高于18分。本研究开始前, 所有被试均被详细告知本研究的目的、具体施测方法以及潜在的风险和不适。所有程序均在被试自愿参与的原则下进行, 并且与被试签署了知情同意书。抑郁症和控制组在年龄, 性别和教育年限上无显著差异。详细的基本人口学信息见表1。
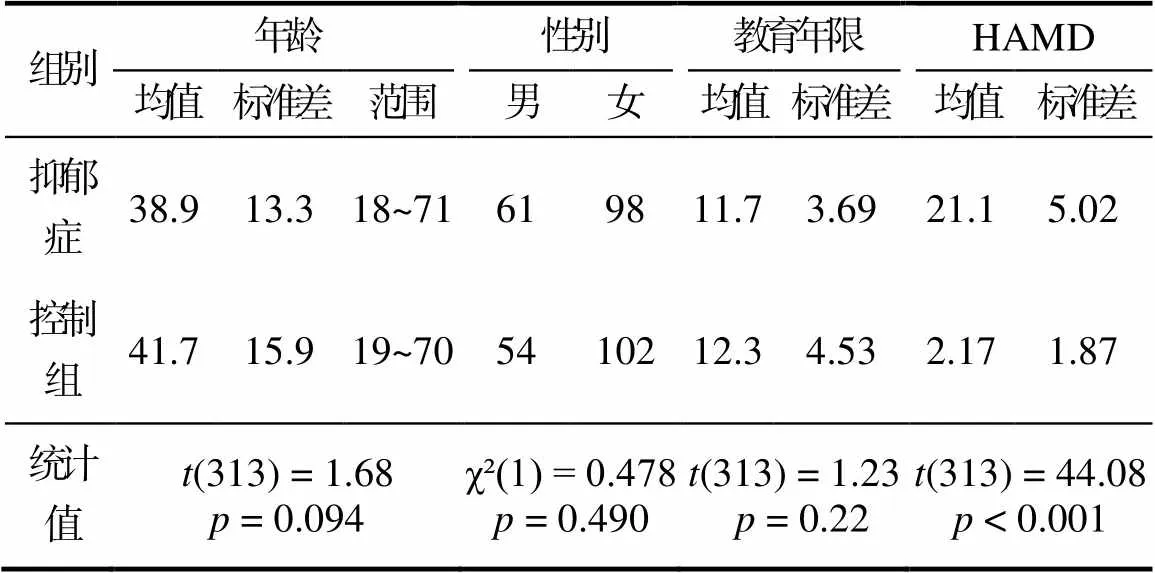
表1 基本人口学信息
注:HAMD:汉密尔顿抑郁量表。
2.2 数据采集
2.2.1 心理测量
人格特征的评估采用成人艾森克人格问卷的中文版(王洁等, 2013)。艾森克人格问卷最开始便是应用临床专业疾病测试领域(现今医院的精神科和心理科广泛使用艾森克问卷)。该问卷一共分为4个分维度:神经质(neuroticism), 外向性(extraversion), 精神质(psychoticism)和掩饰(lie) (陈仲庚, 1983)。较高的神经质分数反映出个体易体验到负面情绪, 情绪易变, 容易过度反应, 且在体验到一种情绪后不容易恢复到常态等。较高的外向性分数反映出个体是开朗的, 健谈的, 冲动的和非抑制的, 拥有广泛的社交接触等, 体验到的积极情绪高等。精神质与攻击性, 反社会行为, 冲动性等相关(Cale, 2006)。掩饰维度反应个体对真实情况的掩饰程度, 得分越高掩饰程度越高。这份问卷涵盖了本研究感兴趣的人格特质, 且艾森克人格问卷在各个国家和地区广受欢迎(Bowden et al., 2016), 自1983年被引入中国以来, 在中国也得到了广泛使用(陈仲庚, 1983)。
2.2.2 静息态数据采集与预处理
静息态功能性磁共振影像数据均采集于西门子扫描仪(3.0T Siemens Trio MRI)。扫描过程中, 所有被试被要求闭上眼睛, 平躺休息, 不做思考和回忆某些特定的事件, 但需要保持清醒。静息态扫描使用序列是全脑梯度平面回波成像序列。具体参数设置如下:回波时间 = 30ms; 重复时间 = 2000ms; 翻转角= 90°; 矩阵大小= 64×64; 视野大小= 192 mm × 192 mm; 层数(Slice) = 32; 厚度 = 3 mm; 层间距 = 1 mm; 体素大小 = 3.4 mm × 3.4 mm × 4 mm。整个扫描过程持续8分4秒。
预处理在中科院严超赣团队开发的DPARSF (Yan & Zang, 2010) (http:// restfmri.net)工具包中进行。首先检查所获被试图像的质量, 删除质量不佳的被试。然后按照如下步骤进行处理:删除影像的前10个时间点(磁共振触发进行扫描的初始信号不稳定); 时间层校正, 用于校正1个volume中层与层之间扫描时间的差异; 头动校正, 用于减弱被试头动的影响; 空间标准化, 将个体的大脑配准到标准的MNI模板上去, 同时将体素大小重采样为3 mm × 3 mm × 3 mm; 图像平滑(平滑核大小为8 mm);回归白质信号, 脑脊液信号和Friston提出的24个头动参数(Friston et al., 1996); 滤波(0.01~0.1 Hz); 最后, 使用DPARSF的scrubbing功能进一步降低头动的影响(Power et al., 2014)。预处理流程与已发表文章一致(Cheng, Rolls, Qiu, Xie, Wei et al., 2018), 详细信息可参考该文章。
2.3 数据分析
2.3.1 聚类分析
新近提出的应用于临床精神病学领域的功能随机森林算法越来越受到研究者青睐, 本研究将采用此方法划分抑郁症病人的人格亚型。该算法运用有监督的方法(自上而下的, 对亚群进行明确的假设, 然后强制数据符合这些假设)和无监督的方法(自下而上的, 根据数据本身的结构或形状来识别亚型, 不需要提前设定类别数目)将感兴趣的临床诊断与异质性结合起来, 克服了无监督聚类所得类别与研究者所感兴趣问题无关的缺陷(Chand et al., 2020)。
首先, 将神经质和外向性(即输入特征)通过随机森林模型与抑郁症诊断相拟合, 随机种子设置为1234, 拟合500棵决策树, 并使用十折交叉验证评估模型性能。随机森林单棵决策树的预测模型基于分类决策树(预测变量为二分变量即是否为抑郁症病人)。决策树以一个倒立的树形呈现, 树上的内部节点代表自变量(即输入特征), 节点之间的连接代表决策, 终端节点(叶节点)代表一个结果(预测变量)。随机森林分析基于Rstudio平台的CORElearn程序包, 采用其内置的Breiman的随机森林算法。该算法融合了bagging集成算法和CART决策树。计算的具体步骤如下:从样本中随机有放回地重采样个训练样本; 对个训练样本建立CART决策树模型; 重复前两个步骤500次, 即获得500棵决策树, 形成随机森林; 然后对来自每棵树的结果进行多数投票的方式输出预测结果。详细计算公式参见(Breiman, 2001)。其中, 一对被试被分配到CART决策树的同一终端节点中的比率代表两者的相似性。如图1中的相似性矩阵, 行和列代表被试, 每个单元格代表在所有树中成对被试落到相同终端节点的概率。其次, 使用Rstudio中ExplainPrediction软件包对生成的随机森林模型进行解释。该软件包可计算一系列的评价指标, 如通过生成误差矩阵(又名混淆矩阵)获得准确率, 特异性, 敏感度等评估指标。
然后, 基于相似性矩阵分别对抑郁症和控制组进行社区探测聚类分析, 最后得到与抑郁症诊断关联的人格类型。其中, 社区检测是一种图论方法, 迭代地用于识别子组。本研究使用的社区检测算法是广义Louvain算法(Generalized Louvain Method), 基于模块度Q最优化的概念(Blondel et al., 2008), 通过对社区结构反复迭代, 直至获得最大的模块度, 即最优的分类情况。该算法广泛应用于各种研究, 并提供了可靠的结果(Cole et al., 2014)。由于该算法涉及到零模型(Newman-Girvan零模型), 社区探测结果会受到一定程度的扰动, 并不唯一(具有一定的随机性), 因此在每个被试上该算法都将被执行100次。经过100次运行的模块化算法, 可获得100个模块度Q值。经过平均后的质量指标Q可作为评估所划分的社区团块之间的分离强度。本研究基于抑郁症病人和控制组被试的相似性矩阵, 分别对其进行社区探测分析, 以获得人格类型。社区探测的分析依赖于GenLouvain工具包(https://github. com/GenLouvain/GenLouvain)。参考前人研究(Mantini et al., 2013), 将其中两个重要参数gamma (可调整社区规模)和omega (影响探测到的社区的稳定性)设置为1。
2.3.1 静息态功能连接分析
为了探索不同分类在杏仁核, 海马, 脑岛与边缘网络, 默认网络, 控制网络的功能连接强度上是否在存在差异, 也进一步验证分类的有效性, 本研究接下来进行功能连接分析。首先, 定义感兴趣区。本研究采用400节点对应17个功能网络的Schaefer-Yeo脑功能模板(Schaefer et al., 2018)。该模板广泛应用于大脑功能网络的研究中, 具有高特异性和高网络同质性(Kong et al., 2019)。该模板不包含皮层下区域, 但详细划分了各功能网络, 例如2个边缘网络(LimbicA_TempPole, LimbicB_OFC), 3个控制网络(ContA_Cingm, ContB_PFCmp, ContC_ Cingp)和3个默认网络(DefaultA_PFCm, DefaultB_ PFCv, DefaultC_PHC)。本研究选取这8个网络涉及的所有节点作为感兴趣区, 具体节点详细信息见网络版附录表S3。其次, 基于AAL模板定义左、右侧杏仁核, 海马和脑岛, 共6个皮层下感兴趣区。然后, 将选取的皮层下感兴趣区与网络所有节点做皮尔逊相关, 即计算功能连接强度。再基于节点间的功能连接, 计算皮层下感兴趣区与8个网络间的功能连接强度。最后, 基于聚类分析得到的各组别, 对皮层下感兴趣区与8个网络的功能连接强度进行单因素方差分析。该分析使用Gretna工具包, 并采用FDR进行多重比较校正。由于有6个皮层下区域与皮层上网络做相关, 需分别做6次方差分析, 因此方差分析的FDR多重比较校正阈值设置为0.0083, 小于0.05/6。基于通过多重比较校正的皮层下区域−皮层上网络的功能连接, 再进行事后检验。方差分析和事后检验中, 均将性别, 年龄和教育年限作为协变量。
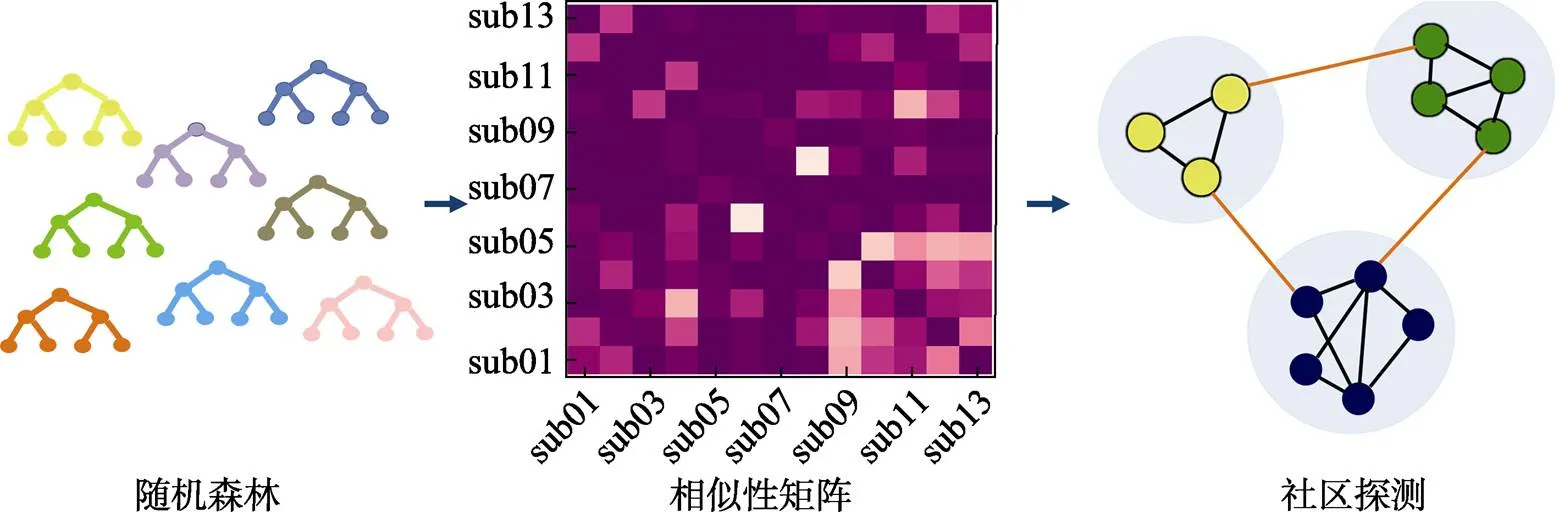
图1 聚类流程
注:随机森林:单颗决策树上的内部节点代表自变量(即输入特征), 节点之间的连接代表决策, 终端节点(叶节点)代表一个结果(即预测变量)。相似性矩阵:行和列代表被试, 每个单元格代表在所有树中成对被试落到相同终端节点的概率。
另外, 我们同样对抑郁症和控制组在6个皮层下感兴趣区与8个网络的功能连接强度上进行了双样本检验。以考察在未进行聚类分析, 没有划分亚型的情况下, 抑郁症和控制组是否在这些功能连接上存在显著差异。并且, 我们还检验了神经质、外向性是否与我们感兴趣的功能连接存在相关。双样本检验和相关分析均采用FDR进行多重比较校正, 阈值设置为0.0083, 小于0.05/6。
3 研究结果
3.1 聚类分析结果
十折交叉验证分析显示, 随机森林预测模型的平均准确性(被正确分类为抑郁症或控制组的所占比率)为77.50%、特异性(控制组被试被成功预测的概率)为74.96%, 灵敏度(抑郁症被试被成功预测的概率)为80.04%。据此可以看出模型拟合良好, 能够较为准确地区分抑郁症病人和控制组被试。接下来, 将广义Louvain社区探测分析应用于通过随机森林建模生成的相似性矩阵。抑郁症病人的社区探测分析结果显示有4种人格类型, 平均质量指标Q为0.19 (表示网络具有模块性)。其中类型1有41人, 占总人数的25.79%; 类型2有44人, 占总人数的27.67%; 类型3有42人, 占总人数的26.42%; 类型4有32人, 占总人数的20.13%。类型1呈现低神经质和中等偏高的外向性水平; 类型2和4呈现出高神经质和低外向性水平, 类型3呈现出高神经质和中等偏高的外向性水平, 详见图2和图S1 (https://chart-studio.plotly.com/~liliyuyu/1/#/)。不同类型的占比相对均衡, 其中高神经质和低外向性水平的类型占比最高。控制组样本的社区探测分析结果显示有5种人格类型, 平均质量指标Q为0.31 (表示网络具有模块性)。其中类型1有47人, 占总人数的30.13%; 类型2有39人, 占总人数的25%; 类型3有44人, 占总人数的28.21%; 类型4有15人, 占总人数的9.62%; 类型5有11人, 占总人数的7.05%。类型1与类型3呈现低神经质, 高或者中等偏高的外向性水平, 与前人研究中弹性型的低神经质高外向性的趋势相同(Kim et al., 2016); 类型2的神经质和外向性都处于中等偏低的程度, 与前人研究中平均型的神经质和外向性水平相似(Leikas & Salmela-Aro, 2014); 类型4呈现中等神经质和高外向性的趋势; 类型5则呈现高神经质和中等外向性的趋势, 详见图2和图S1 (https://chart- studio.plotly.com/~liliyuyu/1/#/)。类型4和5占比较少, 类型1, 2, 3占比较高且相对均衡。整体而言, 抑郁症以高神经质和低外向性趋势的个体为主, 但也有低神经质和高外向性的个体。控制组则以低神经质和高外向性个体为主。
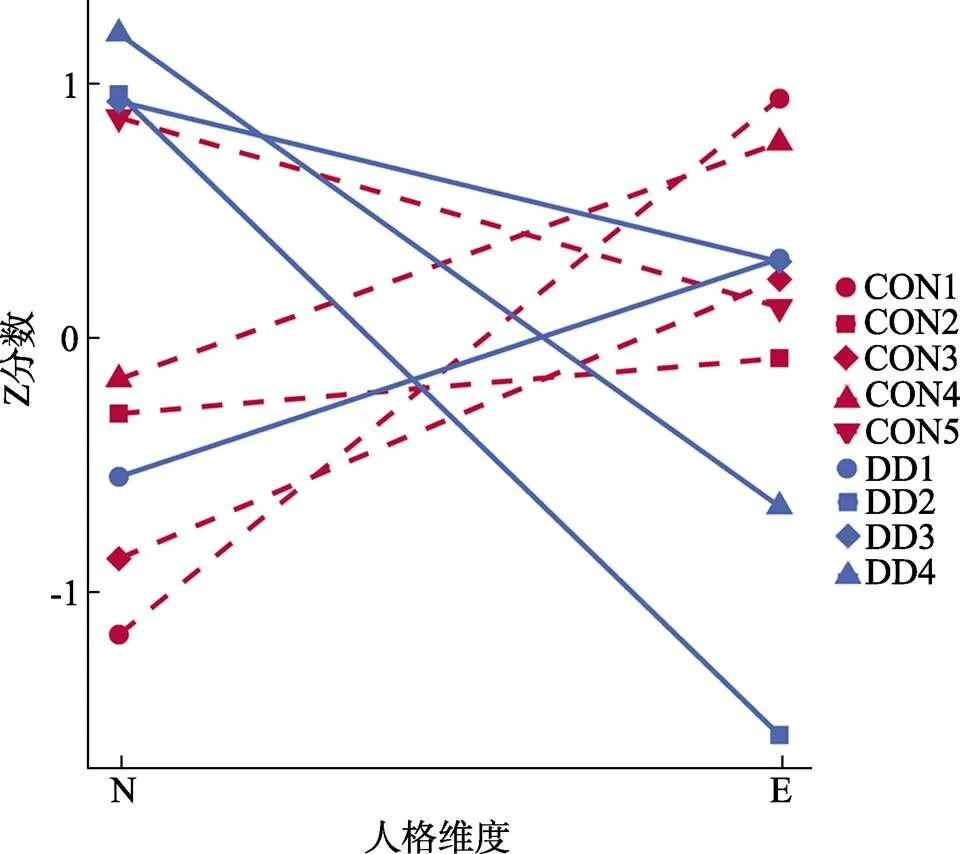
图2 抑郁症与控制组人格类型的神经质和外向性的Z分数
注:抑郁症类型1呈现低神经质和中等偏高的外向性水平; 类型2和4呈现出高神经质和低外向性水平, 类型3呈现出高神经质和中等偏高的外向性水平。控制组类型1与类型3呈现低神经质, 高或者中等偏高的外向性水平; 类型2的神经质和外向性都处于中等偏低的程度; 类型4呈现中等神经质和高外向性的趋势; 类型5则呈现高神经质和中等外向性的趋势。N: 神经质(neuroticism); E: 外向性(extraversion) ; CON: control控制组; DD: depressive disorder 抑郁症。DD1: 抑郁症类型1; CON1: 控制组类型1。
同时, 本研究通过独立样本检验, 考察了抑郁症和控制组在神经质和外向性上是否存在差异。结果显示, 抑郁症的神经质水平显著高于控制组(Mean difference = 7.77,(313) = 13.98,< 0.001, Cohen’s= 1.575), 外向性显著低于控制组(Mean difference = −4.09,(313) = −7.94,< 0.001, Cohen’s= −0.895)。基于聚类分析所划分的9个组, 本研究进一步通过单因素方差分析(性别、年龄和教育年限作为协变量), 检验了神经质和外向性的组间差异。结果表明, 神经质((8, 303)= 131.62,< 0.001, η2= 0.771)和外向性((8, 303)= 51.79,< 0.001, η2= 0.575)均存在组间差异。事后检验详细结果见网络版附录表S1。
3.2 静息态功能连接分析结果
经过预处理, 抑郁症样本有125名被试的数据可用, 其中类型1有32人, 类型2有32人, 类型3有33人, 类型4有28人。控制组样本有122名被试的数据可用, 其中类型1有34人, 类型2有28人, 类型3有37人, 类型4有12人, 类型5有11人。控制组类型4和5人数过少, 因此未纳入后续的统计分析。首先, 在所有组别(7种类型)上的单因素方差分析(性别, 年龄和教育年限作为协变量)的结果显示:经过FDR多重比较校正(阈值为0.05/6), 左侧杏仁核与边缘网络(LimbicB_OFC,(6, 214) = 4.273,= 0.0004), 左侧脑岛与边缘网络(LimbicB_ OFC,(6, 214) = 4.177,= 0.0005)的功能连接强度存在组间差异; 杏仁核, 海马, 脑岛与默认网络, 控制网络的功能连接均不存在显著差异。然后, 对经过多重比较校正的左侧杏仁核−边缘网络(LimbicB_OFC)进行事后检验(两两比较采用“Holm”法校正)的结果显示, 抑郁症类型1 (= −3.47,= 214,= 0.013, Cohen’s= −0.977)和类型2 (= −3.34,= 214,= 0.018, Cohen’s= −0.851)的左侧杏仁核−边缘网络(LimbicB_OFC)功能连接强度显著低于控制组类型3; 控制组类型2的左侧杏仁核−边缘网络(LimbicB_OFC)功能连接强度显著低于类型1 (= −3.38,= 214,= 0.016, Cohen’s= −0.893)和类型3 (= −3.49,= 214,= 0.013, Cohen’s= −1.180), 详见表2和图3。同样地, 对经过多重比较校正的左侧脑岛与边缘网络(LimbicB_OFC)的事后检验结果显示, 抑郁症类型2的左侧脑岛与边缘网络(LimbicB_OFC)的功能连接强度显著低于控制组类型3 (= −4.06,= 214,= 0.001, Cohen’s= −1.034); 抑郁症类型3的左侧脑岛与边缘网络(LimbicB_OFC)的功能连接强度高于类型2 (边缘显著,= 3.04,= 214,= 0.053, Cohen’s= 0.757); 控制组类型2和类型3连接强度差异也呈边缘显著(= −2.94,= 214,= 0.070, Cohen’s= −0.995), 详见表2和图4。上述差异显著的功能连接强度的效应量绝对值均大于0.8, 属于较大的效应量。
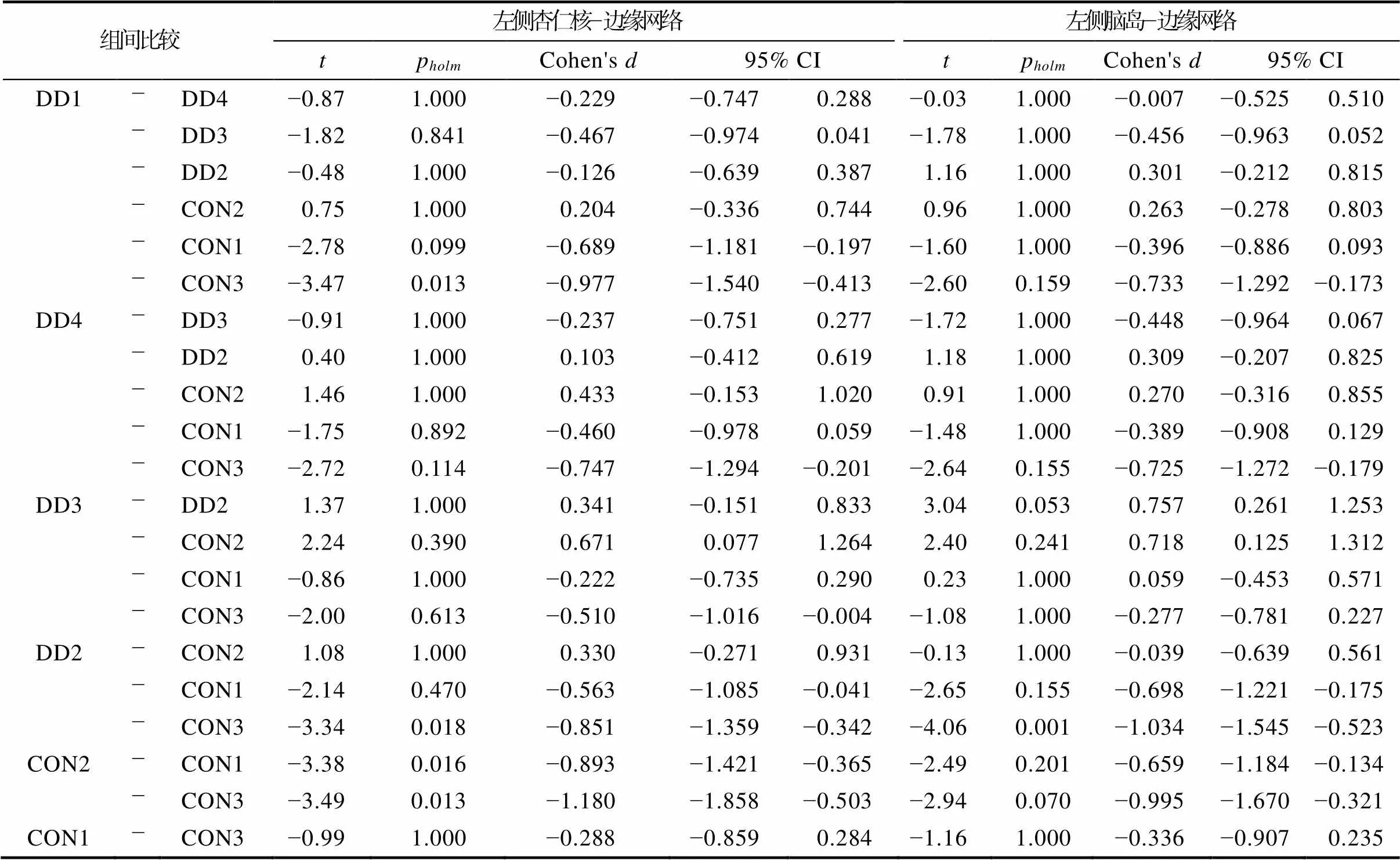
表2 左侧杏仁核/脑岛−边缘网络功能连接强度的事后检验结果
注:CON: control控制组; DD: depressive disorder 抑郁症。DD1: 抑郁症类型1; CON1: 控制组类型1。
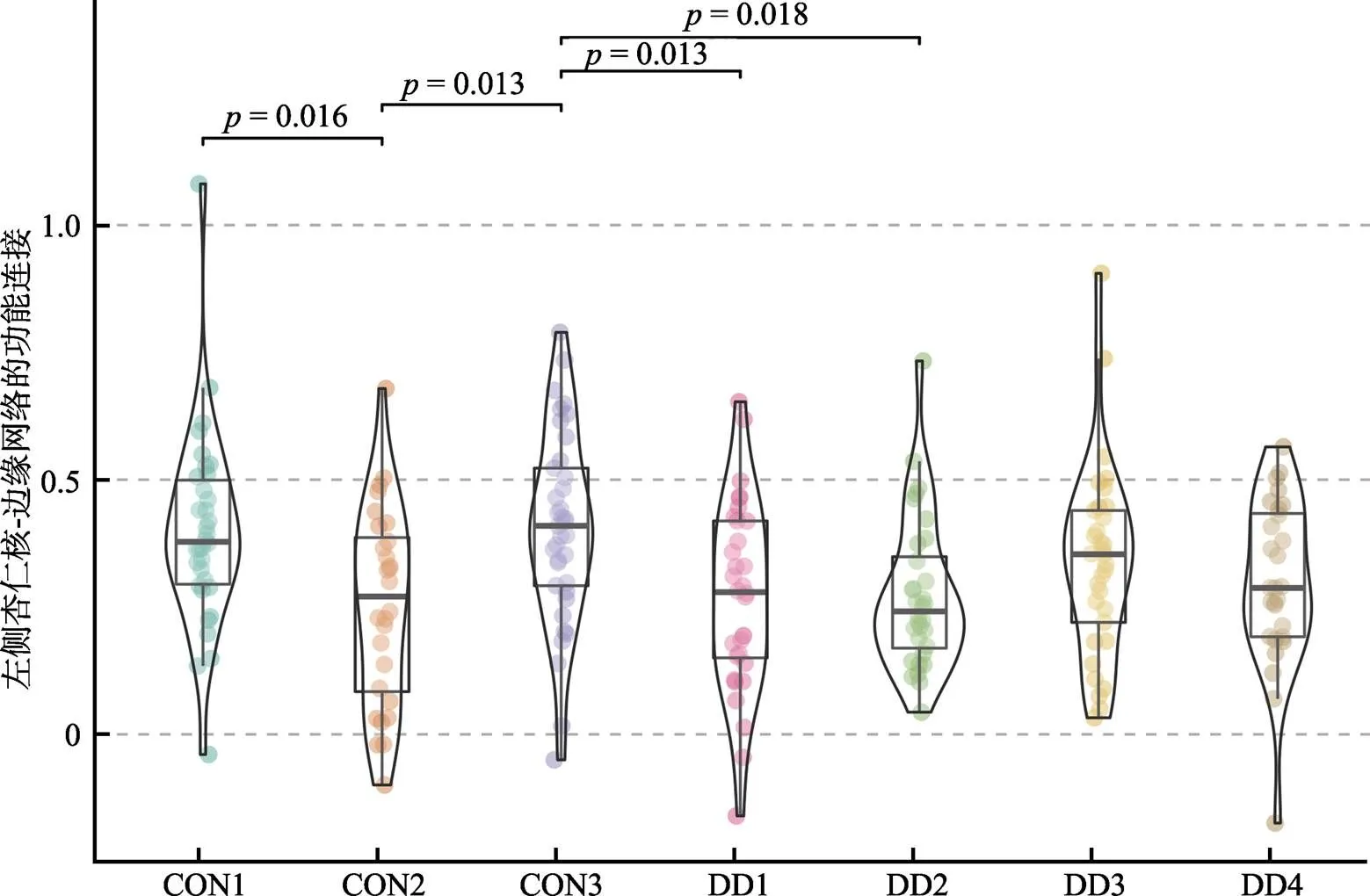
图3 左侧杏仁核与边缘网络的功能连接强度的组间差异
注:CON: control控制组; DD: depressive disorder 抑郁症。DD1: 抑郁症类型1; CON1: 控制组类型1。
此外, 抑郁症和控制组的双样本检验显示, 经过FDR多重比较校正, 抑郁症和控制组在6个皮层下感兴趣区与8个网络的功能连接强度上不存在显著差异。但相关分析显示, 外向性与左/右侧脑岛−边缘网络(LimbicB_OFC), 左/右侧脑岛−默认网络(DefaultA_PFCm), 左/右侧脑岛−默认网络(DefaultB_PFCv)功能连接强度显著相关, 详细信息见网络版附录表S2。

图4 左侧脑岛与边缘网络的功能连接强度的组间差异
注:CON: control控制组; DD: depressive disorder 抑郁症。DD1: 抑郁症类型1; CON1: 控制组类型1。
4 讨论
本研究从个人中心视角出发, 借助功能随机森林, 将人格类型的分类过程与抑郁症的诊断相结合, 分别在抑郁症和控制组中识别出了与抑郁诊断关联的人格类型, 并基于此探索了人格类型的静息态功能连接基础。聚类分析结果显示, 抑郁症以高神经质和低外向性趋势的个体为主, 但同样有低神经质和高外向性趋势的个体。控制组样本则以低神经质和高外向性个体为主。静息态功能连接的结果显示:在不考虑人格亚型的情况下, 抑郁症和控制组在杏仁核/海马/脑岛−边缘网络/默认网络/控制网络的功能连接上均无显著差异。在纳入聚类分析所划分的亚型进行统计后, 多种人格类型在左侧杏仁核/脑岛−边缘网络(LimbicB_OFC)的功能连接强度上呈现出显著差异。
人格特质常与抑郁症的易感性联系在一起(Jones et al., 2010; Ormel et al., 2013; Zuroff et al., 2004), 其中神经质与抑郁易感性的研究尤为丰富(Duggan et al., 1995; 庞雅静, 2020)。研究表明, 个体神经质越高, 其抑郁情绪调节能力、心理复原力越弱, 负性思维和生活压力程度越高, 其抑郁症状严重程度也更高(Kendler et al., 2004; Kercher et al., 2009; McDonnell & Semkovska, 2020; Yoon et al., 2013)。外向性同样与情绪调节和复原力等特质相关, 其与抑郁的相关也可被这些特质影响(Kokkonen & Pulkkinen, 2001; McDonnell & Semkovska, 2020)。众多直接考察人格特质与抑郁关系的研究也证实高神经质、低外向性是抑郁症的“风险因素” (Abbasi et al., 2018; Banjongrewadee et al., 2020; McDonnell & Semkovska, 2020; Murray & O'Neill, 2019)。并且, 研究者在考察人格特质对抑郁的影响时, 还发现了神经质和外向性存在交互作用(Allen et al., 2018)。本研究中识别的抑郁症人格类型以高神经质和低外向性趋势的个体为主, 控制组则以低神经质和高外向性的个体为主, 这侧面体现了高神经质和低外向性的“高抑郁风险”。此外, 抑郁症中低神经质和高外向性的类型, 与Kim在抑郁症中发现的弹性型的神经质外向性趋势相同(Kim et al., 2016)。这表明抑郁症中存在神经质和外向性处于低风险水平的个体, 而他们可能表现出更好的临床治疗效果(Wardenaar et al., 2014)。控制组其他人格类型倾向于至少有一个人格特质处于中/低风险的水平, 体现出健康人群大部分处于中低抑郁风险的特点。
本研究结果中, 边缘网络的主要节点位于眶额皮质(orbitofrontal cortex, OFC), 其位置在解剖学上与腹内侧前额叶皮质一致。杏仁核是感知和识别情绪的中枢, 与自然的情绪和生理唤醒有关(Peluso et al., 2009)。眶额皮质是情绪处理(整合, 评估, 奖赏和决策)的核心区域(Rolls, 2015), 自上而下调控杏仁核等其他区域的活动(Spielberg et al., 2015)。杏仁核-OFC的功能连接在众多研究中被讨论, 其功能主要涉及情绪加工, 恐惧消退(Etkin et al., 2011; Kim et al., 2011), 以及抑制/控制杏仁核在面对负性刺激时的过度激活(Quirk et al., 2000)。研究显示, 面对情绪刺激时, 个体的神经质程度与杏仁核激活强度呈正相关(Haas et al., 2007), 但与OFC激活强度呈负相关(Kehoe et al., 2012)。而在情绪加工任务中, 杏仁核激活(积极情绪−消极情绪)与外向性水平正相关(Canli, 2004); 在奖赏相关任务(获得奖赏−未获得奖赏)中, 杏仁核和OFC的激活都与外向性正相关(Cohen et al., 2005)。
由上可知, 低神经质、高外向性可能与杏仁 核-OFC的高功能连接强度(两者激活的高同步性)有关, 可能对应着更强的调节控制能力, 与我们的结果相呼应。例如, 控制组类型2的左侧杏仁核−边缘网络(LimbicB_OFC)的功能连接强度低于控制组类型1和3。控制组类型2的神经质和外向性处于中等水平, 而控制组类型1和3处于低神经质和偏高的外向性水平。其次, 研究表明静息态下, 抑郁症状越严重, OFC的激活越弱(Rocca et al., 2015), 杏仁核-OFC功能连接也越弱(Cheng, Rolls, Qiu, Xie, Lyu et al., 2018)。侧面支持我们在控制组类型3与抑郁症类型1上发现的差异:即使两者都属于低神经质、高外向性的类型, 抑郁症的患者的杏仁核-OFC连接强度确更低。此外, 我们还发现抑郁症类型2的杏仁核−边缘网络(LimbicB_OFC)的功能连接强度显著低于控制组类型3。结合上述内容, 这种差异可能是相反趋势的神经质和外向性的体现, 也可能是样本差异(是否为抑郁症)的体现。
脑岛是个体注意监测, 情绪感知, 奖赏系统和决策等功能有关(Menon & Uddin, 2010; Sprengelmeyer et al., 2011)。研究显示, 面对情绪刺激时, 个体神经质越高, 脑岛激活越强(Paulus et al., 2003); 面对负性刺激时, 抑郁症患者脑岛的激活也比控制组更高(Surguladze et al., 2010; Suslow et al., 2010); 而OFC在情绪加工中的激活与神经质和抑郁症状严重程度负相关(Kehoe et al., 2012; Rocca et al., 2015)。面对愉悦物体时, 脑岛和OFC的激活均与外向性负相关(Hooker et al., 2008); 面对幽默材料时, 脑岛和OFC的激活均与外向性正相关(Mobbs et al., 2005)。可看出, 神经质与脑岛-OFC的功能协同性可能负相关, 外向性可能与其正相关。此外静息态下, 抑郁症患者的脑岛-OFC的功能连接强度比控制组弱, 且其功能连接强度与抑郁症状严重程度负相关(Zhang et al., 2021)。我们的研究结果也支持以上观点:抑郁症类型2 (高神经质低外向性)的脑岛-OFC功能连接强度低于控制组类型3 (低神经质高外向性)和抑郁症类型3 (高神经质高外向性, 边缘显著); 控制组类型2 (中等神经质和外向性)低于控制组类型3 (边缘显著)。这可能也是不同的神经质和外向性组合或者样本在脑功能连接上差异的体现。
本研究在纳入人格亚型进行统计后发现了以上功能连接的差异, 但在不考虑人格亚型的情况下, 抑郁症和控制组在选取的功能连接上均无显著差异。不仅从侧面说明了分类的有效性, 还有助于从神经层面更好地认识抑郁症的异质性, 更好地帮助未来抑郁症脑机制与分类干预治疗的研究。此外, 本研究仍存在以下三点局限性:第一, 本研究的聚类分析倾向于数据驱动, 未来有待挖掘更加有实质意义的科学问题, 提升创新性。第二, 影像数据的分析只进行了基于种子点的功能连接分析, 未来研究可以尝试进行全脑层面的分析, 并结合多种脑结构和功能的指标, 深入考察不同人格类型的神经基础。第三, 本研究并没有考虑抑郁症患者的其他症状(如焦虑症状)和共病情况(如共病焦虑障碍)对人格分类及其脑功能的影响。未来研究可考虑在数据采集和分析过程中, 对其他症状和共病情况进行详细探讨。
5 结论
本研究将聚类过程与抑郁症诊断相关联, 分别在抑郁症和控制组中识别出了人格类型, 并探讨了不同类型静息态功能连接差异, 加深了对抑郁症异质性的认知。具体发现:抑郁症以高神经质和低外向性趋势的类型为主, 但同样有低神经质和高外向性趋势的类型。控制组则以低神经质和高外向性的类型为主。多种人格类型在左侧杏仁核/脑岛−边缘网络的功能连接强度上存在差异显著:高神经质和低外向性的类型功能连接可能更弱; 同为低神经质和高外向性趋势的类型, 抑郁症的功能连接强度仍然更弱。
Abbasi, M., Mirderikvand, F., Adavi, H., & Hojati, M. (2018). The relationship between personality traits (neuroticism and extraversion) and self-efficacy with aging depression.,(4), 458–466.
Alexopoulos, G. S. (2002). Frontostriatal and limbic dysfunction in late-life depression.,(6), 687–695.
Allen, T. A., Carey, B. E., McBride, C., Bagby, R. M., deYoung,C. G., & Quilty, L. C. (2018). Big Five aspects of personality interact to predict depression.,(4), 714–725.
Altman, N., & Krzywinski, M. (2017). Points of significance: Clustering.,(6), 545–547.
Asendorpf, J. B., Borkenau, P., Ostendorf, F., & van Aken, M. A. (2001). Carving personality description at its joints: Confirmation of three replicable personality prototypes for both children and adults.,(3), 169–198.
Banjongrewadee, M., Wongpakaran, N., Wongpakaran, T., Pipanmekaporn, T., Punjasawadwong, Y., & Mueankwan, S. (2020). The role of perceived stress and cognitive function on the relationship between neuroticism and depression among the elderly: A structural equation model approach.,(1), 1–8.
Blondel, V. D., Guillaume, J. -L., Lambiotte, R., & Lefebvre, E. (2008). Fast unfolding of communities in large networks.,(10), P10008.
Bohane, L., Maguire, N., & Richardson, T. (2017). Resilients, overcontrollers and undercontrollers: A systematic review of the utility of a personality typology method in understanding adult mental health problems.,, 75–92.
Bowden, S., Saklofske, D., van de Vijver, F., Sudarshan, N., & Eysenck, S. (2016). Cross-cultural measurement invariance of the Eysenck Personality Questionnaire across 33 countries.,, 53–60.
Breiman, L. (2001). Random forests.,(1), 5–32.
Bryan, C. J., Tipton, E., & Yeager, D. S. (2021). Behavioural science is unlikely to change the world without a heterogeneity revolution.,(8), 980–989.
Cale, E. M. (2006). A quantitative review of the relations between the “Big 3” higher order personality dimensions and antisocial behavior.,(3), 250–284.
Canli, T. (2004). Functional brain mapping of extraversion and neuroticism: :Learning from individual differences in emotion processing.,(6), 1105–1132.
Chand, G. B., Dwyer, D. B., Erus, G., Sotiras, A., Varol, E., Srinivasan, D., ... Dazzan, P. (2020). Two distinct neuroanatomical subtypes of schizophrenia revealed using machine learning.,(3), 1027–1038.
Chen, Z. -G. (1983). Item analysis of Eysenck Personality Questionnaire tested in Beijing-district.,(2), 85–92.
[陈仲庚. (1983). 艾森克人格问卷的项目分析.,(2), 85–92.]
Cheng, W., Rolls, E. T., Qiu, J., Xie, X., Lyu, W., Li, Y., ... Feng, J. F. (2018). Functional connectivity of the human amygdala in health and in depression.,(6), 557–568.
Cheng, W., Rolls, E. T., Qiu, J., Xie, X., Wei, D., Huang, C. -C., ... Feng, J. F. (2018). Increased functional connectivity of the posterior cingulate cortex with the lateral orbitofrontal cortex in depression.,(1), 1–10.
Cohen, M. X., Young, J., Baek, J. -M., Kessler, C., & Ranganath, C. (2005). Individual differences in extraversion and dopamine genetics predict neural reward responses.,(3), 851–861.
Cole, M. W., Bassett, D. S., Power, J. D., Braver, T. S., & Petersen, S. E. (2014). Intrinsic and task-evoked network architectures of the human brain.,(1), 238–251.
Dollinger, S. J., Urban, K. K., & James, T. A. (2004). Creativity and openness: Further validation of two creative product measures.,(1), 35–47.
Donnellan, M. B., & Robins, R. W. (2010). Resilient, overcontrolled, and undercontrolled personality types: Issues and controversies.,(11), 1070–1083.
Duggan, C., Sham, P., Lee, A., Minne, C., & Murray, R. (1995). Neuroticism: A vulnerability marker for depression evidence from a family study.,(3), 139–143.
Etkin, A., Egner, T., & Kalisch, R. (2011). Emotional processing in anterior cingulate and medial prefrontal cortex.,(2), 85–93.
Feczko, E., Miranda-Dominguez, O., Marr, M., Graham, A. M., Nigg, J. T., & Fair, D. A. (2019). The heterogeneity problem: Approaches to identify psychiatric subtypes.,(7), 584–601.
Fournier, J., Jones, N., Chase, H., Cummings, L., Graur, S., & Phillips, M. (2017). Personality dysfunction in depression and individual differences in effortful emotion regulation.,(10), S336–S337.
Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., & Turner, R. (1996). Movement-related effects in fMRI time-series.,(3), 346– 355.
Gerlach, M., Farb, B., Revelle, W., & Amaral, L. A. N. (2018). A robust data-driven approach identifies four personality types across four large data sets.,(10), 735–742.
Haas, B. W., Omura, K., Constable, R. T., & Canli, T. (2007). Emotional conflict and neuroticism: Personality-dependent activation in the amygdala and subgenual anterior cingulate.,(2), 249–256.
Hamilton, M. (1960). A rating scale for depression.,(1), 56–62.
Herzberg, P. Y., & Roth, M. (2006). Beyond resilients, undercontrollers, and overcontrollers? An extension of personality prototype research.,(1), 5–28.
Hooker, C. I., Verosky, S. C., Miyakawa, A., Knight, R. T., & D’Esposito, M. (2008). The influence of personality on neural mechanisms of observational fear and reward learning.,(11), 2709–2724.
Isler, L., Fletcher, G. J., Liu, J. H., & Sibley, C. G. (2017). Validation of the four-profile configuration of personality types within the Five-Factor Model.,, 257–262.
Jones, L., Scott, J., Cooper, C., Forty, L., Smith, K. G., Sham, P., ... Jones, I. (2010). Cognitive style, personality and vulnerability to postnatal depression.,(3), 200–205.
Kehoe, E. G., Toomey, J. M., Balsters, J. H., & Bokde, A. L. (2012). Personality modulates the effects of emotional arousal and valence on brain activation.,(7), 858–870.
Kendler, K. S., Kuhn, J., & Prescott, C. A. (2004). The interrelationship of neuroticism, sex, and stressful life events in the prediction of episodes of major depression.,(4), 631–636.
Kercher, A. J., Rapee, R. M., & Schniering, C. A. (2009). Neuroticism, life events and negative thoughts in the development of depression in adolescent girls.,(7), 903–915.
Khoo, S., & Simms, L. J. (2018). Links between depression and openness and its facets.,(3), 203–215.
Kim, M. J., Loucks, R. A., Palmer, A. L., Brown, A. C., Solomon, K. M., Marchante, A. N., & Whalen, P. J. (2011). The structural and functional connectivity of the amygdala: From normal emotion to pathological anxiety.,(2), 403–410.
Kim, S. Y., Stewart, R., Bae, K. Y., Kim, S. W., Shin, I. S., Hong, Y. J., ... Kim, J. M. (2016). Influences of the Big Five personality traits on the treatment response and longitudinal course of depression in patients with acute coronary syndrome: A randomised controlled trial.,, 38–45.
Klein, D. N., Kotov, R., & Bufferd, S. J. (2011). Personality and depression: Explanatory models and review of the evidence.,, 269–295.
Knyazev, G. G. (2006). EEG correlates of personality types.,(2), 78–87.
Kokkonen, M., & Pulkkinen, L. (2001). Extraversion and neuroticism as antecedents of emotion regulation and dysregulation in adulthood.,(6), 407–424.
Kong, R., Li, J., Orban, C., Sabuncu, M. R., Liu, H., Schaefer, A., ... Eickhoff, S. B. (2019). Spatial topography of individual- specific cortical networks predicts human cognition, personality, and emotion.,(6), 2533– 2551.
Leikas, S., & Salmela-Aro, K. (2014). Personality types during transition to young adulthood: How are they related to life situation and well-being?,(5), 753–762.
Lorenzetti, V., Allen, N. B., Fornito, A., & Yücel, M. (2009). Structural brain abnormalities in major depressive disorder: a selective review of recent MRI studies.,(1-2), 1–17.
Mantini, D., Corbetta, M., Romani, G. L., Orban, G. A., & Vanduffel, W. (2013). Evolutionarily novel functional networks in the human brain?,(8), 3259–3275.
McDonnell, S., & Semkovska, M. (2020). Resilience as mediator between extraversion, neuroticism, and depressive symptoms in university students.,(1), 26–40.
Menon, V., & Uddin, L. Q. (2010). Saliency, switching, attention and control: A network model of insula function.,(5-6), 655–667.
Miller, C., Brady, M., & Dean, S. (2020). Is Conscientiousness a proxy for Depression? A study of Big Five Con-scientiousness predictive power above depression.,(1), 112.
Milne, A. M., MacQueen, G. M., & Hall, G. B. (2012). Abnormal hippocampal activation in patients with extensive history of major depression: An fMRI study.,(1), 28–36.
Mobbs, D., Hagan, C. C., Azim, E., Menon, V., & Reiss, A. L. (2005). Personality predicts activity in reward and emotional regions associated with humor.,(45), 16502–16506.
Murray, L. E., & O'Neill, L. (2019). Neuroticism and extraversion mediate the relationship between having a sibling with developmental disabilities and anxiety and depression symptoms.,, 232–240.
Ormel, J., Bastiaansen, A., Riese, H., Bos, E. H., Servaas, M., Ellenbogen, M., ... Aleman, A. (2013). The biological and psychological basis of neuroticism: Current status and future directions.,(1), 59–72.
Pang, Y. J. (2020).(Unpublished doctorial dissertation). University of Electronic Science and Technology of China.
[庞雅静. (2020).(博士学位论文). 电子科技大学, 成都.]
Paulus, M. P., Rogalsky, C., Simmons, A., Feinstein, J. S., & Stein, M. B. (2003). Increased activation in the right insula during risk-taking decision making is related to harm avoidance and neuroticism.,(4), 1439–1448.
Peluso, M. A., Glahn, D. C., Matsuo, K., Monkul, E. S., Najt, P., Zamarripa, F., ... Soaress, J. C. (2009). Amygdala hyperactivation in untreated depressed individuals.,(2), 158–161.
Peters, A. T., Burkhouse, K., Feldhaus, C. C., Langenecker, S. A., & Jacobs, R. H. (2016). Aberrant resting-state functional connectivity in limbic and cognitive control networks relates to depressive rumination and mindfulness: A pilot study among adolescents with a history of depression.,, 178–181.
Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., & Petersen, S. E. (2014). Methods to detect, characterize, and remove motion artifact in resting state fMRI.,, 320–341.
Quirk, G. J., Russo, G. K., Barron, J. L., & Lebron, K. (2000). The role of ventromedial prefrontal cortex in the recovery of extinguished fear.,(16), 6225–6231.
Rai, S., Griffiths, K. R., Breukelaar, I. A., Barreiros, A. R., Chen, W., Boyce, P., ... Korgaonkar, M. S. (2021). Default- mode and fronto-parietal network connectivity during rest distinguishes asymptomatic patients with bipolar disorder and major depressive disorder.,(1), 547.
Rocca, M. A., Pravata, E., Valsasina, P., Radaelli, M., Colombo, B., Vacchi, L., ... Filippi, M. (2015). Hippocampal- DMN disconnectivity in MS is related to WM lesions and depression.,(12), 5051–5063.
Rolls, E. T. (2015). Limbic systems for emotion and for memory, but no single limbic system.,, 119–157.
Scalabrini, A., Vai, B., Poletti, S., Damiani, S., Mucci, C., Colombo, C., ... Northoff, G. (2020). All roads lead to the default-mode network-global source of DMN abnormalities in major depressive disorder.,(12), 2058–2069.
Schaefer, A., Kong, R., Gordon, E. M., Laumann, T. O., Zuo, X. -N., Holmes, A. J., ... Yeo, B. T. (2018). Local-global parcellation of the human cerebral cortex from intrinsic functional connectivity MRI.,(9), 3095–3114.
Spielberg, J. M., Forbes, E. E., Ladouceur, C. D., Worthman, C. M., Olino, T. M., Ryan, N. D., & Dahl, R. E. (2015). Pubertal testosterone influences threat-related amygdala- orbitofrontal cortex coupling.,(3), 408–415.
Spinhoven, P., de Rooij, M., Heiser, W., Smit, J. H., & Penninx, B. W. (2012). Personality and changes in comorbidity patterns among anxiety and depressive disorders.,(4), 874–884.
Sprengelmeyer, R., Steele, J. D., Mwangi, B., Kumar, P., Christmas, D., Milders, M., & Matthews, K. (2011). The insular cortex and the neuroanatomy of major depression.,(1-2), 120–127.
Sridharan, D., Levitin, D. J., & Menon, V. (2008). A critical role for the right fronto-insular cortex in switching between central-executive and default-mode networks.,(34), 12569– 12574.
Surguladze, S. A., El-Hage, W., Dalgleish, T., Radua, J., Gohier, B., & Phillips, M. L. (2010). Depression is associated with increased sensitivity to signals of disgust: A functional magnetic resonance imaging study.,(14), 894–902.
Suslow, T., Konrad, C., Kugel, H., Rumstadt, D., Zwitserlood, P., Schöning, S., ... Dannlowski, U. (2010). Automatic mood- congruent amygdala responses to masked facial expressions in major depression.,(2), 155–160.
Tang, S., Lu, L., Zhang, L., Hu, X., Bu, X., Li, H., ... Huang, X. (2018). Abnormal amygdala resting-state functional connectivity in adults and adolescents with major depressive disorder: A comparative meta-analysis.,, 436–445.
Wardenaar, K. J., Conradi, H. J., Bos, E. H., & de Jonge, P. (2014). Personality modulates the efficacy of treatment in patients with major depressive disorder.,(9), e916–923.
Wang, J., Wang, N. N., & Zhang, Y. (Eds). (2013).. Beijing Normal University Press.
[王洁, 王宁宁, 张艳. (主编). (2013).. 北京:北京师范大学出版社.]
Yan, C., & Zang, Y. (2010). DPARSF: A MATLAB toolbox for "pipeline" data analysis of resting-state fMRI.,, 13.
Yan, R., Geng, J. T., Huang, Y. H., Zou, H. W., Wang, X. M., Xia, Y., ... Lu, Q. (2022). Aberrant functional connectivity in insular subregions in somatic depression: A resting-state fMRI study.,(1), 146.
Yin, K., Zhao, J., Zhou, J., & Nie, Q. (2021). The big-five personality profiles: A person-centered approach.,(10), 1866–1877.
[尹奎, 赵景, 周静, 聂琦. (2021). “大五”人格剖面: 以个体为中心的研究路径.(10), 1866–1877.]
Yoon, K. L., Maltby, J., & Joormann, J. (2013). A pathway from neuroticism to depression: Examining the role of emotion regulation.,(5), 558–572.
Zhang, T., Bai, T., Xie, W., Wei, Q., Lv, H., Wang, A., ... Wang, K. (2021). Abnormal connectivity of anterior-insular subdivisions and relationship with somatic symptom in depressive patients.,(4), 1760–1768.
Zuroff, D. C., Mongrain, M., & Santor, D. A. (2004). Conceptualizing and measuring personality vulnerability to depression: Comment on Coyne and Whiffen (1995).,(3), 489–511.
Personality subtypes of depressive disorders and their functional connectivity basis
LI Yu1,2,3, WEI Dongtao1,2, QIU Jiang1,2
(1Key Laboratory of Cognition and Personality, Ministry of Education, Southwest University;2Department of Psychology, Southwest University;3Faculty of Education, Southwest University, Chongqing 400715, China)
Heterogeneity among mental health issues has always attracted considerable attention, thereby restricting research on mental health and cognitive neuroscience. Additionally, the person-centred approach to personality research, which emphasizes population heterogeneity, has received more attention. On the other hand, the heterogeneity among depressive patients has been a problem that cannot be ignored (most studies ignored the actual situation and directly assumed sample homogeneity). A large number of empirical studies have provided evidence that isolated personality traits are often associated with depression. Only a few studies have considered the probable effect from a taxonomy perspective. Moreover, the neural mechanisms of personality types in depression remain unclear. This study aimed to reveal different personality subtypes of depressive disorders and elucidate subtypes from the perspective of resting-state functional connectivity.
Personality and resting-state functional imaging data of 135 depressive patients and 133 controls were collected. First, combined with “depression diagnosis”, the personality types in depressive patients and controls were identified through functional random forest. Specifically, neuroticism and extraversion (input features) were fitted with the diagnosis of depression by a random forest model. The random seeds were set to 1234, and 500 decision trees were fitted. The performance of the model was evaluated by tenfold cross-validation. Subsequently, the random forest algorithm generated a proximity matrix that represented the similarity between paired participants. Then, based on the proximity matrix, community detection clustering analysis was conducted on depressive patients and controls, and personality types associated with depression diagnosis were obtained. Finally, we selected nodes of the subcortical network as regions of interest according to the power-264 template and calculated the functional connectivity map of the region of interest to the whole brain. Based on the functional connectivity map, the differences in resting-state functional connectivity between the main types were compared.
Personality and resting-state functional imaging data of 159 depressive patients and 156 controls were collected. First, combined with “depression diagnosis”, the personality types in depressive patients and controls were identified through functional random forest. Specifically, neuroticism and extraversion (input features) were fitted with the diagnosis of depression by a random forest model. The random seeds were set to 1234, and 500 decision trees were fitted. The performance of the model was evaluated by tenfold cross-validation. Subsequently, the random forest algorithm generated a proximity matrix that represented the similarity between paired participants. Then, based on the proximity matrix, community detection clustering analysis was conducted on depressive patients and controls, and personality types associated with depression diagnosis were obtained. Finally, we selected the amygdala, hippocampus, insula (AAL atlas) and limbic network, default network, and control network (Schaefer-Yeo template) as regions of interest and calculated the functional connectivity of the subcortical regions to the networks. ANOVA was used to compare resting-state functional connectivity between the personality types.
The results showed the following. (1) Depression was more common among individuals with high neuroticism and low extraversion tendencies, but there were also individuals with low neuroticism and high extraversion tendencies. The controls were more likely to be individuals with low neuroticism and high extraversion. (2) The results of resting-state functional connectivity showed no significant difference between depression and controls. (3) The functional connectivity strength of the left amygdala/insula-limbic network was significantly different across personality subtypes.
In summary, the personality subtypes of depression identified by person-centred perspectives are more in line with reality and individual cognitive patterns, and they have potential clinical adaptive value. The findings of this study enhance the understanding of heterogeneity among depressive disorders.
neuroticism, extraversion, resting-state functional connectivity, depressive disorders, person-centred
B845; R395
2022-01-28
*重庆市自然科学基金(cstc2015jcyjA10106); 中国博士后科学基金面上资助(2021M702705); 重庆市博士后创新人才支持计划(A33600125)。
邱江, E-mail: qiuj318@swu.edu.cn
