紫花地丁总黄酮对单纯疱疹病毒性脑炎小鼠的作用
2023-05-07赵丽静郜风清
赵丽静,郜风清,韩 冰
1.邢台医学高等专科学校第二附属医院神经内科,邢台 054000;2.邢台市人民医院儿三科,邢台 054000
单纯疱疹病毒(herpes simplex virus,HSV)感染可引起单纯疱疹病毒性脑炎(herpes simplex virus en-cephalitis,HSE),临床表现为发热、意识障碍、精神异常及癫痫等[1]。研究发现,HSV不仅可以直接侵袭神经系统,还可以释放大量干扰素α(interferonα,INF-α)、白介素6(interleukin 6,IL-6)等炎性细胞因子,是导致脑损伤的重要原因之一[2]。中药紫花地丁主要含有黄酮类、香豆素、有机酸以及挥发油等活性成分,具有清热解毒、凉血消肿、清热利湿的作用,其提取物紫花地丁总黄酮(total flavones fromViolayedoensisMakino,TFV)具有良好的抗炎活性[3-4]。研究表明[5-6],治疗HSE主要通过调控Toll受体3(toll-like receptor 3,TLR3)、β干扰素TRI结构域衔接蛋白(TIR-domain containing adaptor inducing interferon-β,TRIF)通路及炎症因子分泌。本研究旨在探讨TFV是否可以通过调控TLR3/TRIF通路减轻HSE小鼠的炎症反应。
1 仪器与材料
1.1 仪器
SMZ745型光学显微镜(日本Nikon公司);CFX96型PCR仪(美国Bio-Rad公司);ELx800型光吸收酶标仪(美国Bio-Tek公司);E-Gel Imager凝胶成像仪(美国Thermo Fisher Scientific公司)。
1.2 试药
紫花地丁(张仲景大药房);阿昔洛韦(acyclovir,ACV,北京康瑞纳生物科技有限公司);RIPA裂解液(北京伊塔生物科技有限公司);TLR3、TRIF引物由武汉擎科创新科技有限公司合成;小鼠INF-αELISA试剂盒(上海广锐生物科技有限公司);小鼠IL-6 ELISA试剂盒(上海酶研生物科技有限公司);RNA提取试剂盒(美国Mobio公司);逆转录试剂盒(美国Genecopoeia公司)。
1.3 动物与病毒
5周龄新西兰雄性健康(SPF级)小鼠80只,体质量12~15 g,购自中国医学科学院医学实验动物研究所,生产许可证号:SCXK(京)2018-0002。HSV1病毒购自中国医学科学院医学实验动物研究所。
2 方法
2.1 TFV的提取
参照文献[6]方法:将紫花地丁粉碎后放置于60 ℃恒温干燥箱中干燥24 h,用体积分数为70%的乙醇溶液浸泡,加质量浓度为40 g·L-1的氢氧化钠提取液进行萃取,加体积分数为18%的氯化氢溶液酸化,乙酸乙酯萃取,蒸干,乙醇溶解,制成质量浓度为1 g·mL-1的TFV溶液。计算总黄酮得率。总黄酮得率=(提取液质量浓度×稀释倍数×体积)/称取样品的干质量。计算得总黄酮的得率为0.9%。
2.2 测定LD50
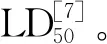
2.3 建立HSE小鼠模型
以质量浓度10 g·L-1戊巴比妥钠按照30 mg·kg-1给小鼠腹腔注射使其麻醉,按照2.2项下方法,将HSV1(LD50,50×10-4·mL-1)细胞悬液20 μL注入小鼠颅内,建立HSE模型。观察小鼠出现精神倦怠、食欲不振、共济失调、肢体活动不灵等反应则为建模成功。
2.4 实验分组与干预
取50只小鼠按照随机数字表法分为空白对照组、TFV组、HSV1+NS(normal saline)组、HSV1+ACV组和HSV1+TFV组,每组10只。除空白组和TFV组外,其余各组注射HSV1(LD50,50×10-4·mL-1)建立HSE小鼠模型。建模成功后,空白对照组不做处理,TFV组灌胃TFV 0.15 mL(质量浓度50 μg·mL-1),HSV1+NS组灌胃NS 0.15 mL,HSV1+ACV组灌胃ACV 0.15 mL(质量浓度60 μg·mL-1),HSV1+TFV组灌胃TFV 0.15 mL(质量浓度50 μg·mL-1),以上均参考文献用量[8]。为保证药物被充分吸收,灌胃前12 h禁食不禁水。造模后第5天脱颈处死取左、右两侧颞叶脑组织,左侧颞叶脑组织用于HE染色以观察脑组织的病理变化,右侧颞叶脑组织用于TLR3、TRIF mRNA和蛋白含量的检测。
2.5 小鼠脑组织的病理学变化
取左侧颞叶脑组织用质量浓度40 g·L-1的多聚甲醛溶液固定24 h后,经包埋、切片、二甲苯固定及乙醇脱水后,用蒸馏水冲洗,用苏木素染色10 min,用质量浓度10 g·L-1的盐酸乙醇分化5 s,伊红染液复染5 min,乙醇脱水,二甲苯透明,滴加中性树脂封片,置于光学显微镜下进行观察。
2.6 ELISA法检测脑组织INF-α和IL-6的含量
取绿豆大小的右侧颞叶脑组织,转移至含蛋白酶抑制剂的PBS 1 mL中,用匀浆机充分研磨后充分匀浆,以12 000 r·min-1离心20 min,收集上清液,冻存于-20 ℃冰箱中。测定INF-α、IL-6前20 min将其从冰箱中取出,按照ELISA试剂盒说明书进行操作,测定标本450 nm处的吸光度值(A),绘制标准曲线,根据标准曲线计算样品中INF-α、IL-6的含量,实验重复3次。
2.7 检测脑组织TLR3和TRIF mRNA的含量
取右侧颞叶脑组织研磨,加入Trizol裂解液提取组织的RNA,用逆转录试剂盒合成cDNA,按照说明书进行PCR扩增。反应体系(20 μL):上、下游引物各0.5 μL,2×SYBR Green PCR Mastermix 10 μL,10×cDNA模板1 μL,双蒸水8 μL。反应条件:95 ℃ 2 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 2 min,40个循环。扩增所用引物的序列见表1。以GADPH为内参基因,用2-ΔΔCt法进行定量分析。

表1 引物序列
2.8 Western blot法检测脑组织TLR3和TRIF蛋白的表达水平
取右侧颞叶脑组织研磨,加入裂解液提取脑组织蛋白,离心后收集上清液,用BCA试剂盒测定蛋白浓度,制备SDS-PAGE凝胶,蛋白变性,等量上样进行电泳后转膜,用质量浓度为50 g·L-1的脱脂奶粉封闭1 h。加入TLR3、TRIF和GAPDH一抗(均1∶500)4 ℃下孵育过夜,TBST洗膜;加入二抗室温孵育2 h,TBST洗膜。以ECL法显影,用Image J软件进行灰度分析。
2.9 统计学方法
3 结果
3.1 小鼠感染HSV1的LD50
小鼠感染HSV1病毒后第1天出现精神倦怠、食欲下降、耸毛颤抖等症状,感染第2天起出现死亡,第4天后死亡小鼠的数量增多。不同病毒滴度下小鼠的存活率见表2。LD50值为50×10-4·mL-1。
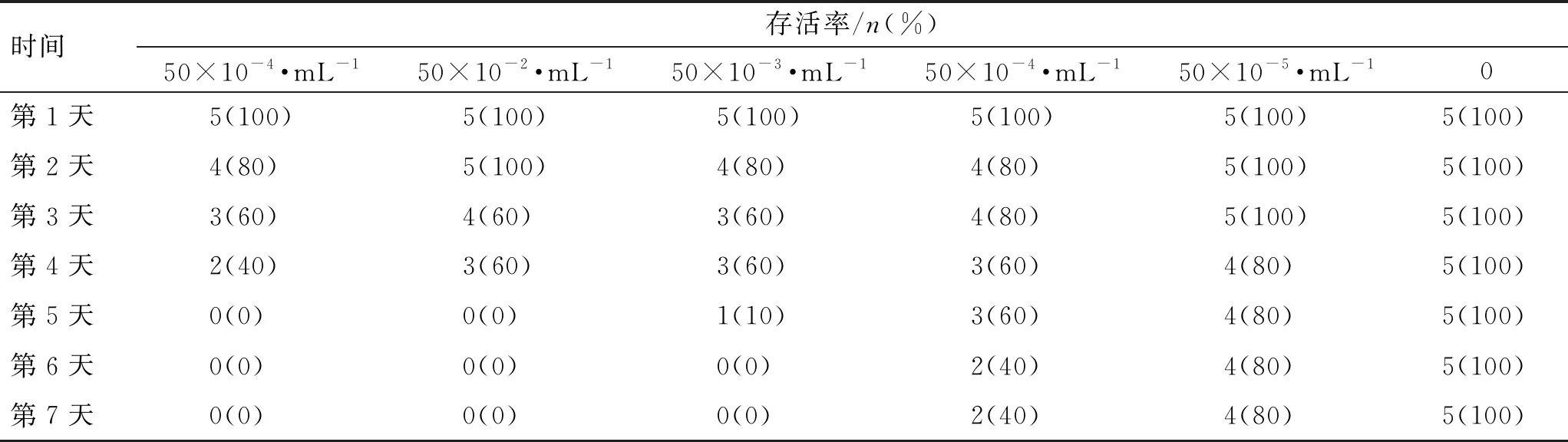
表2 不同病毒滴度下小鼠的存活率
3.2 各组小鼠脑组织的病理变化
HSV1+NS组脑组织可见炎性细胞浸润,淋巴细胞、巨噬细胞增多,脑组织大面积水肿、出血,神经细胞变性严重;HSV1+ACV组和HSV1+TFV组小鼠脑组织水肿减轻,神经细胞变性减轻,轻微出血,炎性细胞明显减少。空白对照组、TFV组无明显炎性细胞浸润,脑组织完整,未见出血。结果见图1。
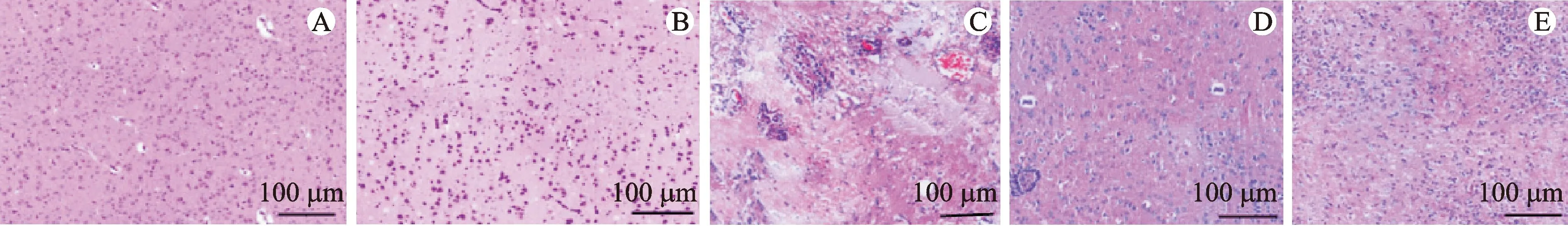
注:A.空白对照组;B.TFV组;C.HSV1+NS组;D.HSV1+ACV组;E.HSV1+TFV组。
3.3 各组小鼠脑组织INF-α和IL-6的含量
与空白对照组比较,HSV1+NS组、HSV1+ACV组和HSV1+TFV组INF-α、IL-6的含量显著增加(P<0.05),TFV组无明显变化(P>0.05);与HSV1+NS组比较,HSV1+ACV组和HSV1+TFV组INF-α、IL-6的含量显著减少(P<0.05)。而HSV1+ACV组与HSV1+TFV组INF-α、IL-6的含量比较,差异无统计学意义(P>0.05)。结果见表3。
表3 各组脑组织INF-α和IL-6含量的比较
3.4 脑组织TLR3、TRIF mRNA的表达水平
与空白对照组比较,HSV1+NS组、HSV1+ACV组和HSV1+TFV组TLR3、TRIF mRNA的表达水平显著升高(P<0.05),TFV组无明显变化(P>0.05);与HSV1+NS组比较,HSV1+ACV组和HSV1+TFV组TLR3、TRIF mRNA的表达水平显著降低(P<0.05)。而HSV1+ACV组与HSV1+TFV组TLR3、TRIF mRNA的表达水平无明显差异(P>0.05)。结果见表4。
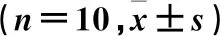
表4 各组脑组织TLR3和TRIF mRNA表达水平的比较
3.5 小鼠脑组织TLR3和TRIF蛋白的表达水平
与空白对照组比较,HSV1+NS组、HSV1+ACV组和HSV1+TFV组TLR3、TRIF蛋白的表达水平显著上升(P<0.05),TFV组无明显变化(P>0.05);与HSV1+NS组比较,HSV1+ACV组和HSV1+TFV组TLR3、TRIF蛋白的表达水平显著降低(P<0.05)。而HSV1+ACV组与HSV1+TFV组相比,TLR3、TRIF蛋白表达水平的差异无统计学意义(P>0.05)。结果见表5、图2。
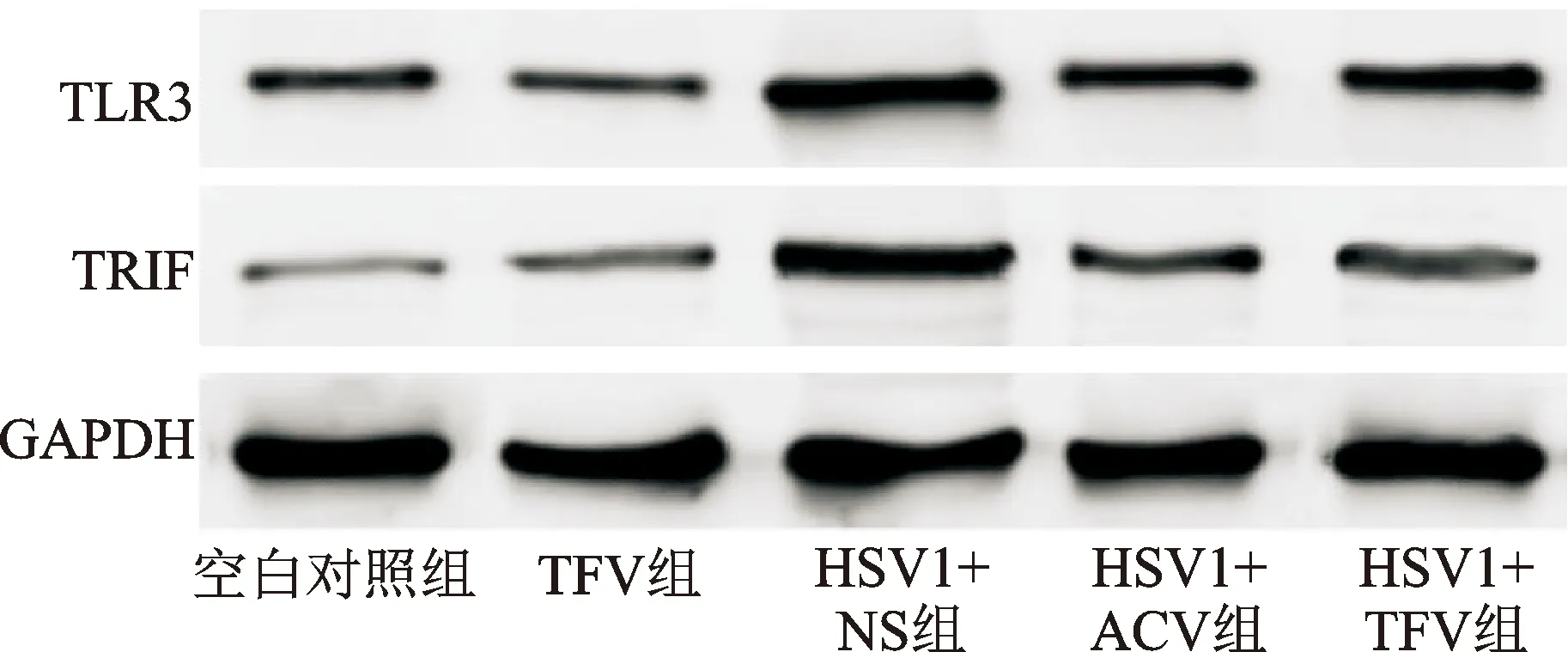
图2 各组脑组织TLR3和TRIF蛋白的表达水平
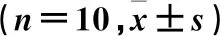
表5 各组脑组织TLR3和TRIF蛋白表达水平的比较
4 讨论
HSE是一种由HSV引起的中枢神经感染性疾病,HSV是一种嗜神经病毒,分为HSV1和HSV2 2个亚型,大部分的HSE由HSV1引起,该病毒可进入轴突神经末梢,直接损伤神经元和神经细胞,在周围神经系统或交感神经细胞核中引发持续感染[9-10]。本研究中,梯度稀释HSV1病毒,用寇式计算法计算出其LD50为50×10-4·mL-1。将20 μL HSV1细胞悬液注射入小鼠颅内,成功建立HSE小鼠模型。
张静等[11]研究表明,TFV可以显著下调小鼠巨噬细胞IL-1β、IL-6和INF-α等细胞因子的释放并抑制其mRNA的表达,具有良好的抗炎活性。李海涛等[12]体外实验研究结果表明,TFV可下调IL-2等细胞因子的分泌,参与调控体液免疫和细胞免疫应答,改善机体的免疫功能。本研究的结果显示,感染1 d后,小鼠出现食欲不振、精神倦怠、皮毛耸立等症状;脑组织病理形态观察发现大量炎性细胞浸润,大面积水肿,出血,神经变性严重;治疗后,小鼠脑组织水肿和神经细胞变性减轻,INF-α、IL-6的含量显著降低,与前者的研究结果一致,表明TFV可抑制炎性因子的分泌,减轻HSE对脑组织造成的炎性损伤。
TLR是HSE发病过程中诱导宿主抗病毒免疫反应和组织损伤的主要分子,通过病毒识别、传导及抗病毒效应,在病毒感染过程中发挥重要作用[13-14]。其中TLR3受体可识别双链RNA,是病毒侵袭的关键免疫分子[15],TLR3只接受TRIF信号通路的信号并向下游传递[16],收到刺激信号后TRIF依赖途径被激活,诱导IFN-α和IL-6等炎性细胞因子的产生[17],并发生免疫应答。如果活化该通路,将会导致炎性细胞因子大量释放,对机体各组织造成损伤[18]。因此,以TLR为靶点,激活或者抑制TLR通路,可能是治疗病毒性感染的新策略。王晓容等[19]研究发现,绿原酸可以抑制小鼠小胶质细胞内的TLR3/TRIF通路,进而减轻由HSV1型引起的小胶质细胞的炎性反应。此外,HUANG Y等[20]报道,在治疗疱疹病毒性脑炎小鼠时,TLR3/TRIF通路的抑制在其中发挥重要作用。之前的研究均提示,TLR3/TRIF通路可能与疱疹性病毒感染密切相关,本研究以TFV为治疗药物,发现感染HSV1后小鼠脑组织中TLR3、TRIF mRNA和蛋白的表达水平显著升高,表明HSV1可以激活TLR3-TRIF信号通路;治疗后,HSV1+ACV组和HSV1+TFV组TLR3、TRIF mRNA和蛋白的表达水平显著降低,表明TFV的抗炎作用可能与抑制TLR3/TRIF信号通路有关。
总之,TFV可能通过调控TLR3/TRIF通路,减轻炎性细胞因子对HSE小鼠脑组织的损伤,抑制由HSV1引起的炎症反应。本研究为临床治疗HSE提供了实验依据,具体作用机制尚需进一步实验研究。
