柚皮素基于Th1/Th2轴对妊娠高血压大鼠症状的改善
2023-05-07臧密密付雪莲李格琳
臧密密,付雪莲,李格琳
1.沧州市人民医院妊娠糖尿病科,沧州 061000;2.沧州市人民医院妇产科,沧州 061000;3.沧州市人民医院产科,沧州 061000
妊娠期高血压疾病是妊娠晚期的一种并发症,也是一种常见妊娠相关疾病,包括妊娠高血压(pregnancy induced hypertension,PIH)、慢性高血压、子痫和先兆子痫[1]。PIH是孕妇、胎儿以及新生儿发病和死亡的主要原因之一,PIH发病率为7%~12%,高于世界平均发病率,严重影响临床环境中母体和胎儿的预期寿命[2]。已有研究证实,PIH可改变胎儿脉管系统和心脏结构发育,并在后续生活中诱导后代血压升高[3]。柚皮素是4′,5,7-三羟基黄烷酮,为一种天然黄烷酮,广泛存在于柚子、橙子等柑橘类水果中,因其广泛的生物活性备受关注[4]。研究表明,柚皮素具有多种显著药理特性,如抗癌、抗糖尿病及对肝肾胃、心脏和神经的保护和免疫调节作用[5]。柚皮素的多类有效活性含多种基本分子机制,涉及不同疾病多个水平细胞信号通路融合,因此,柚皮素在治疗不同疾病方面具有巨大潜力[6]。本研究通过建立PIH模型,研究柚皮素对PIH大鼠及子代生长的影响,为柚皮素有关药物开发和临床应用提供新方向。
1 仪器与材料
1.1 仪器
多功能酶标仪购自美国Thermo Fisher Scientific有限公司;化学发光凝胶成像系统(Fluor Chem FC3)购自美国Protein Simple公司。
1.2 试药
柚皮素(质量分数≥98%,货号480-41-1)购自武汉恒和达生物医药有限公司;硝苯地平片(国药准字H44023986)购自广东华南药业集团有限公司;干扰素γ(interferon-γ,IFN-γ,货号SBJ-R0041)、白细胞介素12(interleukin-12,IL-12,货号SBJ-R0658)及白细胞介素10(interleukin-10,IL-10,货号SBJ-R0095)ELISA试剂盒,均购自南京森贝伽生物科技有限公司;白细胞介素33(interleukin-33,IL-33,货号ab236714))ELISA试剂盒、兔抗鼠Th1淋巴细胞趋化因子C-X-C-基元受体3(Chemokine C-X-C-primitive receptor 3,CXCR3,货号ab288437)、C-C趋化因子受体5(CC-chemokine receptor 5,CCR5)多抗(货号ab65850)、Th2淋巴细胞C-趋化因子C受体类型3(C-chemokine C receptor type 3,CCR3)多抗(货号ab32512),均购自美国Abcam公司。
1.3 实验动物
80只SPF级SD雌性大鼠和40只雄性大鼠,体质量为180~220 g,8周龄,购自南通药明康德医药科技有限公司,许可证号为SCXK(苏)2019-0008,室内温度24 ℃±1 ℃,空气相对湿度为55%±5%,光照昼夜交替循环12 h,饲养1周。
2 方法
2.1 建模与分组
60只雌性大鼠经高脂高糖饮食喂养4周后,与雄性大鼠合笼过夜(雌雄比例2∶1),次日,显微镜观察雌性大鼠阴道处出现精子或黏液栓现象,即妊娠成功,记为妊娠第1天,取妊娠成功51只雌性大鼠,妊娠15 d后开始静脉注射亚硝基左旋精氨酸甲酯(80 mg·kg-1·d-1),持续15 d,诱导建立妊娠期高血压PIH模型[7-8]。妊娠30 d后用无创尾动脉血压监测器测量血压,其收缩压超过原基础血压30 mmHg、舒张压超过原基础血压15 mmHg,即造模成功[9]。取建模成功的43只大鼠,随机剔除3只后分为模型组、柚皮素低剂量组、柚皮素高剂量组和阳性药物组,每组各10只。剩余雌性大鼠正常饮食和妊娠,成功妊娠13只,随机剔除3只后为对照组,于妊娠15 d后静脉注射等体积生理盐水,每日1次,持续15 d。
2.2 干预方法
建模成功后,依据参考文献[10]用量,柚皮素低、高剂量组和阳性药物组灌胃给药分别为50 、100 mg·kg-1柚皮素溶液及50 mg·kg-1硝苯地平溶液,对照组和模型组灌胃等体积生理盐水0.5 mL,每日1次,共计6周。
2.3 常规指标检测
末次给药后24 h,通过代谢笼收集大鼠次日8点至第2天8点24 h尿液,量杯计算总尿量,混匀后离心(4 000 r·min-1,10 min,4 ℃),取上清10 mL,用全自动生化分析仪测定24 h尿蛋白(24 h UTP),留尿结束2 h后,无创尾动脉血压监测器测定大鼠尾动脉静息血压值。
2.4 血清炎性因子检测
常规指标检测结束后,取大鼠腹部主动脉血,离心取上清(3 000 r·min-1,10 min),ELISA法检测血清IFN-γ、IL-12、IL-10及IL-33含量。设置对照品孔和样本孔,对照品孔加不同质量浓度对照品100 μL,样本孔先加5倍稀释的上清液100 μL,后于各孔加入HRP标记的抗体,37 ℃温育1 h,洗板,加入底物A、B避光孵育15 min,50 μL终止液终止反应,酶标仪测定450 nm处吸光度值,根据标准曲线计算大鼠血清IFN-γ、IL-12、IL-10及IL-33含量。
2.5 观测仔鼠体质量、产仔数量及死亡率
大鼠妊娠期结束后,记录生产的仔鼠数量和体质量,并计算其死亡率。
2.6 肾组织CXCR3等指数水平检测
处死大鼠,无菌摘取肾组织,匀浆,Trizol法提RNA,测定质量分数、质量浓度,逆转录得cDNA,实时荧光定量PCR反应。反应体系:Taq聚合酶1.6 μL ,上下游引物各0.6 μL,模板cDNA 1 μL, 双蒸水16.2 μL,扩增条件为预变性(95 ℃,30 s)、变性(95 ℃,5 s)、退火(59 ℃,30 s),共40个循环,加熔解曲线,降温(50 ℃,30 s)。以GAPDH为内参对照,检测CXCR3、CCR5、CCR3 mRNA水平,数据分析用2-△△Ct法,重复多次,取Ct均值。引物序列见表1。

表1 引物序列
2.7 肾组织CXCR3等蛋白水平检测
处死大鼠,取肾组织,加RIPA裂解缓冲液,离心取上清(7 000 r·min-1,10 min,离心半径为20 cm),蛋白BCA试剂盒测定总蛋白质量浓度,加热变性蛋白,统一蛋白上样量,用SDS-PAGE凝胶电泳将待测蛋白样品电泳分离(100 V,80 min),转至PVDF(250 mA),用体积分数为5%的脱脂牛奶磷酸盐缓冲液封闭(2 h),将样品与CXCR3(1∶250)、CCR5(1∶250)、CCR3(1∶250)一抗4 ℃过夜孵育,TBST缓冲液洗膜,加二抗HRP标记IgG室温孵育(1∶2 000,2 h),洗膜,曝光,显影。Image J软件测样品与GAPDH条带灰度值。计算目标(CXCR3、CCR5及CCR3)蛋白相对表达水平,即目标条带与GAPDH条带灰度比值。
2.8 统计学方法
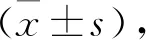
3 结果
3.1 常规指标水平
雌性大鼠24 h UTP、收缩压及舒张压组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组24 h UTP、收缩压及舒张压升高(P<0.05);与模型组比较,柚皮素低、高剂量组、阳性药物组24 h UTP、收缩压及舒张压降低(P<0.05);与柚皮素低剂量组比较,柚皮素高剂量组、阳性药物组24 h UTP、收缩压及舒张压降低,且阳性药物组低于柚皮素高剂量组(P<0.05)。见表2。
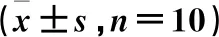
表2 常规指标水平比较
3.2 血清相关炎性因子水平
血清IFN-γ、IL-12、IL-10及IL-33水平组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组血清IFN-γ、IL-12升高,IL-10、IL-33水平降低(P<0.05);与模型组比较,柚皮素低剂量、高剂量组、阳性药物组血清IL-10、IL-33水平升高,IFN-γ、IL-12水平降低(P<0.05);与柚皮素低剂量组比较,柚皮素高剂量组、阳性药物组血清IL-10、IL-33水平升高,IFN-γ、IL-12水平降低(P<0.05);与柚皮素高剂量组比较,阳性药物组血清IL-10、IL-33水平升高,IFN-γ、IL-12水平降低(P<0.05)。见表3。
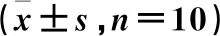
表3 血清IFN-γ、IL-12、IL-10及IL-33水平比较
3.3 仔鼠出生数量和体质量及死亡率
仔鼠出生数量和体质量及死亡率组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组仔鼠出生数量和体质量增加、死亡率升高(P<0.05);与模型组比较,柚皮素低剂量、高剂量组及阳性药物组仔鼠出生数量和体质量减少、死亡率降低(P<0.05);与柚皮素低剂量组比较,柚皮素高剂量组、阳性药物组血清仔鼠出生数量和体质量减少、死亡率降低,且阳性药物组低于柚皮素高剂量组(P<0.05)。见表4。
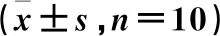
表4 仔鼠出生数量、体质量及死亡率比较
3.4 肾组织相关因子mRNA水平
肾组织CXCR3、CCR5及CCR3 mRNA水平组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组CXCR3、CCR5 mRNA水平升高,CCR3 mRNA水平降低(P<0.05);与模型组比较,柚皮素低剂量、高剂量组及阳性药物组CCR3 mRNA水平升高,CXCR3、CCR5 mRNA水平降低(P<0.05);与柚皮素低剂量组比较,柚皮素高剂量组、阳性药物组CCR3 mRNA水平升高,CXCR3、CCR5 mRNA水平降低(P<0.05);与柚皮素高剂量组比较,阳性药物组CCR3 mRNA水平升高,CXCR3、CCR5 mRNA水平降低(P<0.05)。见表5。
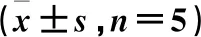
表5 肾组织CXCR3、CCR5、CCR3 mRNA水平比较
3.5 肾组织相关蛋白水平
肾组织CXCR3、CCR5及CCR3蛋白水平组间比较,差异有统计学意义(P<0.05)。与对照组比较,模型组CXCR3、CCR5蛋白水平升高,CCR3蛋白水平降低(P<0.05);与模型组比较,柚皮素低、高剂量组、阳性药物组CCR3蛋白水平升高,CXCR3、CCR5蛋白水平降低(P<0.05);与柚皮素低剂量组比较,柚皮素高剂量组、阳性药物组CCR3蛋白水平升高,CXCR3、CCR5蛋白水平降低(P<0.05);与柚皮素高剂量组比较,阳性药物组CCR3蛋白水平升高,CXCR3、CCR5蛋白水平降低(P<0.05)。见表6、图1。
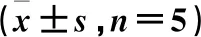
表6 肾组织CXCR3、CCR5及CCR3蛋白水平比较
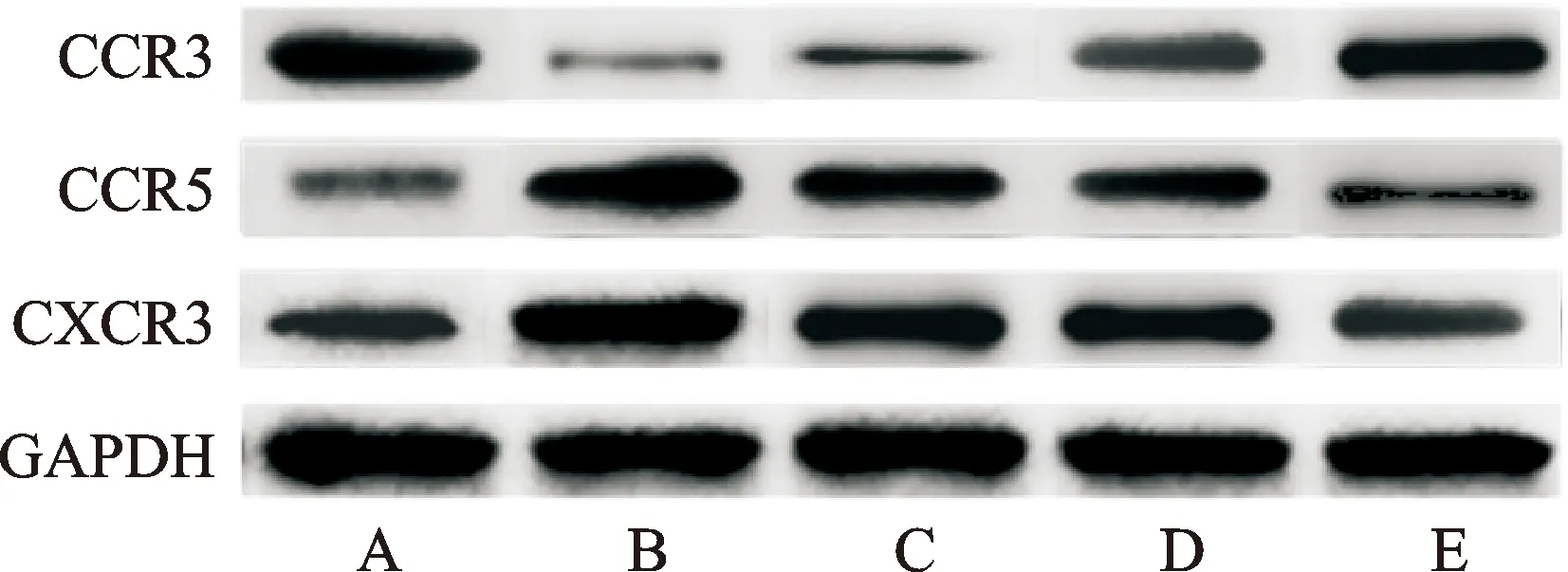
注:A.对照组;B.模型组;C.柚皮素低剂量组;D.柚皮素高剂量组;E.阳性药物组。
4 讨论
PIH是一种典型的以妊娠后半期新发高血压为特征的疾病,是各种生理病理变化中最常见的不利于子宫环境的疾病之一[11]。目前,胰岛素抵抗、肾素-血管紧张素-醛固酮系统功能障碍、炎症、肥胖引起神经体液和肾脏机制相互作用已被认为是PIH的促成因素,但其机制尚不明确[2]。
妊娠期的正常细胞环境包括来自先天免疫和适应性免疫的促炎和抗炎成分[12],与以Th2和Treg细胞反应和细胞因子谱占主导地位的Th2型免疫状态为特征的正常妊娠相反,PIH由于Th1型免疫和促炎细胞因子而占优势[13],当机体免疫功能受损、Th1/Th2平衡状态被打破时,会导致Th1/Th2细胞失衡引起妊娠期相关疾病发生[14-15]。Th1驱动反应由Th1淋巴细胞产生促炎细胞因子介导,如IL-12、IFN-γ和肿瘤坏死因子-α;而Th2驱动反应由抗炎细胞因子介导,如IL-4、1L-10和1L-33等,可用于评估机体免疫状态[16-17]。本研究结果表明,与模型组比较,柚皮素各剂量组血清IL-10、IL-33水平升高,24 h UTP、收缩压、舒张压指标、血清IFN-γ、IL-12水平、仔鼠死亡率降低,仔鼠出生数量和体质量减少,表明用柚皮素进行干预后,可有效调节PIH大鼠血压,减轻炎性反应,缓解对子代生长影响,修复Th1/Th2细胞免疫平衡。
Th1/Th2失衡已被认为是自身免疫性疾病的发病机制之一[18]。研究发现,趋化因子受体CXCR3和CCR5主要在Th1型淋巴细胞上表达,而CCR3受体则在Th2型淋巴细胞上表达,且CXCR3、CCR5和CCR3已作为区分Th1/Th2型淋巴细胞标记,这些受体与趋化细胞因子相结合,在许多生理病理过程中发挥着至关重要的作用[19]。已有研究表明,由T细胞亚群功能失调性失衡介导的免疫疾病可能与免疫血小板减少症改变有关,此外,Th1/Th2趋化因子受体异常表达可能在肝硬化和脾功能亢进的脾免疫疾病中发挥作用,这反过来又可以解释外周血细胞减少症,因此,Th1/Th2趋化因子受体的异常表达可能在自身免疫疾病中发挥作用[20]。本研究结果显示,与模型组比较,柚皮素低剂量组、柚皮素高剂量组肾组织CCR3 mRNA和蛋白水平升高,CXCR3、CCR5 mRNA和蛋白水平降低,表明柚皮素可能通过调节Th1/Th2轴关键分子表达减轻PIH疾病,降低机体自身免疫功能损伤。
综上所述,柚皮素能够调节血压,改善PIH大鼠炎性反应和机体免疫功能损伤,调控Th1/Th2细胞免疫平衡,其作用机制可能与Th1/Th2轴激活有关,可为临床治疗PIH提供参考。
