葡萄VvJAZ9蛋白原核表达与多克隆抗体制备
2023-05-06刘德帅樊姗姗姚文孔
刘德帅 冯 美,2 姚 磊 王 烨 樊姗姗 姚文孔,2,3,*
(1宁夏大学农学院,宁夏 银川 750021;2宁夏现代设施园艺工程技术研究中心,宁夏 银川 750021;3宁夏优势特色作物现代分子育种重点实验室,宁夏 银川 750021)
葡萄(Vitisspp.)为葡萄科葡萄属多年生落叶藤本植物,是世界上广泛栽培的果树之一。目前,用于栽培生产的葡萄品种多数为欧亚种葡萄(Vitis viniferaL.),其产量高、品质优,但普遍抗逆性较差。葡萄作为一种低温敏感作物,在栽培生产过程中常遭受不同程度的低温伤害,限制了其在我国冷凉地区的发展,严重影响了葡萄经济产量和产业发展[1-3]。茉莉酸(jasmonic acid,JA)作为一种重要的植物内源生长调节物质,在植物生长发育过程中发挥着重要调节作用,也作为内源信号分子参与病原菌和植食性昆虫的防御过程[4]和低温、高温、干旱、盐碱、重金属及紫外线(ultraviolet-B,UV-B)胁迫的抗性反应过程[5]。前人研究发现,外源施用JA 可通过提高抗氧化酶活性,增加抗氧化剂、防御化合物合成以及诱导冷响应基因表达来增强番茄(Solanum lycopersicum)[6]、葡萄(Vitis vinifera)[7]、西瓜(Citrullus lanatus)[8]等植物的抗寒性。
JAZ(jasmonate ZIM-domain)蛋白不仅是JA 信号调控途径中的重要负调控因子,也是调节JA 信号通路中参与植物抵御非生物和生物逆境胁迫应答的关键因子[9]。JAZ蛋白是植物中特有的一类蛋白,定位于细胞核中,属于TIFY 蛋白家族,由ZIM(zinc-finger protein expressed in inflorescence meristem)、Jas(jasmonates)和NT(N terminal domain)3 个结构域组成[10-11]。JAZ 蛋白主要包含ZIM 和Jas两个保守结构域,存在于N 端的ZIM(又称TIFY)结构域,包含一个TIFY基序(TIF[F/Y]XG)。ZIM结构域介导JAZ蛋白同源或异源二聚体的形成以及与NINJA(novel interactor of JAZ)和TPL(topless)等抑制子的相互作用[12];存在于C端的Jas(又称CCT _2)结构域,可以与MYC(myelocytomatosis proteins)、ICE(inducer of CBF expression)蛋白的ACT和TAD 区域广泛互作,也是JA-Ile(jasmonic acidisoleucine)与COI1(coronatine insensitive 1)相互作用的关键[13-14];NT 是JAZ 蛋白N 端的一个弱保守区,该结构域可以与DELLA 蛋白互作抑制JA 信号[15]。有研究表明,OsJAZ9过表达可降低水稻(Oryza sativa)叶片宽度和气孔密度,减小叶片蒸腾速率,从而提高植物抗旱性[16]。在拟南芥(Arabidopsis thaliana)中过表达AtJAZ7可通过调节光合作用、氧化还原、植物激素和防御代谢产物来增强拟南芥的耐旱性[17]。在受到12 h低温胁迫的黄花苜蓿(Medicago falcata)地上和地下组织中JAZs均上调表达,表明JAZs在调节植物低温耐受性的茉莉素信号中起着重要作用[18]。
低温冷害和冻害是葡萄栽培生产中普遍存在的问题[19]。在我国北方葡萄栽培地区多采用埋土防寒措施来减少冬季寒冷、春季霜冻对葡萄造成的伤害[20]。埋土防寒不但会增加生产成本,而且对树体会产生损伤,影响产量,还不利于环境保护[19-20]。挖掘葡萄中与抗寒相关的基因并研究其功能和作用机理,对亟待解决葡萄冷害和冻害问题有着重要的理论意义和实际应用价值。因此,本试验以酿酒葡萄霞多丽为研究材料,克隆JAZ9基因,探究VvJAZ9基因在低温条件下的表达模式,进行拟南芥原生质体亚细胞定位分析,并通过原核蛋白表达获得JAZ9 蛋白,制备多克隆抗体,检测葡萄内源JAZ9 蛋白的表达特点,旨在深入分析JAZ9蛋白在葡萄抗寒反应中的调控功能,为合理利用外源JA处理提高葡萄抗寒性提供理论依据。
1 材料与方法
1.1 材料与试剂
植物材料为两年生盆栽扦插苗霞多丽(V.viniferacv.Chardonnay)植株,于日光温室中,在自然光照条件下进行培养。选择生长状况良好且长势一致的幼苗,移至LT-BIX120L 低温培养箱(上海立德泰勀科学仪器有限公司)内,经4 ℃处理0、3、6、9、12及24 h后采集叶片组织,以室温条件下的叶片组织作为对照(CK),将采集到的叶片组织迅速放入液氮中冷冻后置于-80 ℃冰箱保存,用于后续试验。
试验所用反转录试剂盒、高保真酶、DNA Marker、限制性内切酶PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒、SYBR®Premix Ex TaqTM(Perfect Real Time)试剂盒均购自大连宝生物工程有限公司;植物总RNA 提取试剂盒、胶回收试剂盒和质粒提取试剂盒均购于北京天根生化科技有限公司;无缝克隆试剂盒购于南京诺唯赞生物科技有限公司;其余试剂均为化学分析纯。
1.2 试验方法
1.2.1 基因克隆 使用植物RNA 提取试剂盒,按照标准流程提取葡萄叶片总RNA,随后用试反转录剂盒合成第一链cDNA,用于目的基因的克隆。以NCBI 数据库(https://www.ncbi.nlm.nih.gov/orffinder/)中的VvJAZ9基因序列(GenBank No.XM_002277121.3)为参考序列,使用Primer Premier 6.0 软件设计同源克隆所用引物(表1)。参考俞沁含等[1]的PCR 反应体系与程序进行PCR 扩增,获得目的片段。扩增产物经琼脂糖凝胶电泳检测、胶回收后连接至克隆载体pMD19-T,转化至大肠杆菌(E.coli)Top10 感受态细胞,经阳性克隆筛选后,送单克隆至北京奥科鼎盛生物科技有限公司测序确认,以获得含目的基因的重组载体pMD19-T-VvJAZ9。
1.2.2 生物信息学分析 采用MEGA 7.0 软件中的邻接法(neighbor-joining,NJ)构建蛋白系统进化树(bootstrap 设为1 000);通过NCBI 在线分析工具CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守结构域;采用在线软件ExPASy ProtParam(https://web.expasy.org/protparam/)分析VvJAZ9 蛋白的基本理化性质;运用在线网站Grape Genome Browser(http://genoscope.cns.fr/externe/Genome Browser/Vitis/)分析VvJAZ9基因的染色体定位、内含子及外显子区域。使用在线软件MG2C(http://mg2c.iask.in/mg2c_v2.1/)对基因在染色体上的位置进行可视化。
1.2.3VvJAZ9基因表达分析 利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术检测葡萄VvJAZ9基因在低温胁迫下的表达情况。qRTPCR所用引物使用 Primer Premier 6.0 软件设计(表1)。按照植物总RNA 提取试剂盒说明书分别提取CK 和低温处理0、3、6、9、12、24 h 的叶片样品总RNA,各取1 µg 通过PrimeScriptTMRT reagent Kit with gDNA Eraser 试剂盒将RNA 反转录为cDNA,稀释10 倍后用于qRT-PCR 分析。qRT-PCR 反应用SYBR®Premix Ex TaqTM(Perfect Real Time)试剂盒进行,其反应体系为20 µL:上下游引物各0.8 µL,模板1 µL,SYBR 试剂10 µL,ddH2O 补齐至20 µL。反应程序:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸 30 s,循环40 次,每次循环第2 步进行荧光采集,用qTOWER 2.0仪器(Analytik Jena,德国)进行qRT-PCR检测,结果采用2-△△CT法分析计算,使用IBM SPSS 25.0 中独立样本t测验比较差异显著性(P<0.05),并采用Origin Pro 2021 软件作图,试验进行3 次生物学重复。
1.2.4 原核表达载体构建 对于原核表达载体的构建,选择VvJAZ9基因片段的开放阅读框(open reading frame,ORF)全长,设计相应的引物(表1)。以pMD19-T-VvJAZ9质粒为模板,通过PCR 扩增获得目的片段。采用无缝克隆法,将其克隆至经限制性内切酶NdeI/XhoI 双酶切原核表达载体pET28b-His 的相应位点,构建原核表达载体pET28b-VvJAZ9,转化E.coliTop10感受态细胞,进行菌液PCR 与酶切鉴定。对鉴定正确的重组质粒进行测序,经测序公司测序后获得正确质粒pET28b-VvJAZ9。为最终检测多克隆抗体在葡萄中的应用效果,参照上述载体构建的方法,设计相应的扩增引物(表1),以测序正确的pMD19-T-VvJAZ9质粒为模板,进行PCR反应,采用同源重组反应的方法,构建植物表达重组载体pC1307-VvJAZ9和pC2300-VvJAZ9。

表1 引物列表Table 1 List of primers
1.2.5 VvJAZ9 亚细胞定位观察 根据VvJAZ9基因片段的ORF 序列设计植物表达载体的特异性引物(表1),将其构建至植物表达载体pBI221-GFP 形成pBI221-VvJAZ9-GFP 融合表达载体。以霞多丽葡萄的愈伤组织为材料,参考Bertini 等[21]的方法制备葡萄原生质体。采用聚乙二醇(polyethylene glycol,PEG)介导法分别将 pBI221-VvJAZ9-GFP 和pBI221-GFP 质粒转化至葡萄愈伤组织原生质体中,转化后的原生质体在22 ℃弱光照条件下培养20 h,然后使用TCS SP8 X激光共聚焦显微镜(Leica,德国)观察VvJAZ9 蛋白的亚细胞定位情况并拍照记录。
1.2.6 重组蛋白的表达与纯化 将测序正确的pET28b-VvJAZ9重组质粒转化至E.coliBL21 感受态细胞,加入1.0 mmol·L-1异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG),37 ℃诱导表达16 h 后收集200 mL 菌体,经过超声破碎后于4 ℃、10 000×g条件下离心20 min,收集菌体蛋白的上清液与沉淀。然后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离,随后进行考马斯亮蓝染色、脱色和拍照。将收集到的上清液与沉淀加入Ni-NTA 树脂层析柱(翌圣生物科技股份有限公司,上海)中,流速控制在0.5 mL·min-1,收集穿柱液体。分别用10 倍柱床体积的NTA-0、NTA-20、NTA-60、NTA-200 和NTA-500 Buffer 进行洗脱,流速控制在1 mL·min-1,收集各洗脱峰。在4 ℃下SDS-PAGE 电泳检测收集的洗脱液,纯度达到要求的组分,置于透析袋中,在4 ℃下以1×磷酸盐缓冲液(phosphate buffered saline,PBS)透析的甘油中透析浓缩,并超滤浓缩透析产物,最后采用SDSPAGE定性,Bradford法定量。
1.2.7 抗体的制备与亲和性检测 参考吴楠等[22]的方法进行多克隆抗体制备及亲和性检测。将符合免疫要求浓度的重组蛋白乳化后,按照1 mg·kg-1的剂量,对2 只新西兰大白兔进行多点皮下注射,间隔7 d 注射一次。每只兔子免疫4~5 次后采集少量血样,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测血清抗体效价,经检测合格后,于第1次免疫52 d后一次性采血获得抗血清。将获得的兔抗血清加入1/20 4 mol·L-1NaCl 溶液,过层析柱(翌圣生物科技股份有限公司,上海),加入40 mL 洗脱缓冲液进行洗脱,再加入1×甘氨酸(glycine,Gly)收集样品,向样品中加入过量Gly 洗脱抗体,并用1×PBS 平衡。取少量抗体进行浓度检测,剩余抗体置于透析袋中,在4 ℃下以1×PBS 的甘油中透析浓缩过夜,-20 ℃保存。将不同剂量重组菌诱导表达的蛋白经SDS-PAGE 电泳分析,并采用湿转法将凝胶转至硝酸纤维素膜上,以纯化的兔血清为一抗(1∶1 000),再以荧光标记的山羊抗兔抗体为二抗,进行蛋白免疫印迹(Western Blot)检测,使用C400 蛋白成像系统(Azure Biosystems,美国)扫描硝酸纤维素膜,进行增强化学发光法(enhanced chemiluminescence,ECL)染色,采用电泳系统对电泳图像分析。
1.2.8 Western Blot 分析检测抗体特异性 为确定制备出的anti-VvJAZ9 抗体是否能够检测到葡萄中的VvJAZ9蛋白,参考Bertini等[21]的方法制备葡萄愈伤组织葡萄原生质体。将制备的葡萄原生质体在细胞培养板上按照1 mL/组进行分组试验,然后使用10 µmol·L-1茉莉酸甲酯(methyl jasmonate,MeJA)进行处理,分别在0、0.5、1 和2 h 时收集原生质体,提取蛋白。参考Yao等[23]的方法进行Western Blot 分析,使用anti-VvJAZ9抗体对葡萄中的JAZ9 蛋白进行检测。为进一步验证anti-VvJAZ9 抗体的特异性,将前期浓缩好的pC1307-VvJAZ9与pC2300-VvJAZ9载体提取质粒后,通过PEG介导法分别转入制备的葡萄原生质体中,24 h 后收集原生质体,提取蛋白,进行Western Blot分析。
2 结果与分析
2.1 葡萄JAZ蛋白家族序列分析
HMMER 3.0(http://hmmer.org/)分析结果发现,欧洲葡萄霞多丽中共有11个JAZs蛋白,根据参考序列在染色体上的分布将得到的11 个JAZs基因分别命名为JAZ1、JAZ2、JAZ3、JAZ4、JAZ5、JAZ6、JAZ7、JAZ8、JAZ9、JAZ10、JAZ11,其中JAZ1和JAZ2共存于第1 条染色体上,JAZ5、JAZ6、JAZ7、JAZ8位于第10 条染色体上,其余JAZs分别位于第4、第9、第11、第12、第17条染色体上(图1)。将所获得的11 个JAZs基因编码蛋白与拟南芥的JAZ家族成员构建进化树,结果显示,葡萄中JAZs 蛋白可分为4 个亚族,其中JAZ3、JAZ5、JAZ6、JAZ7、JAZ8 与拟南芥中AtJAZ7 和AtJAZ8 亲缘关系最近;JAZ2 与拟南芥中AtJAZ10 进化距离最近;JAZ4、JAZ9、JAZ10 与拟南芥中AtJAZ1 和AtJAZ2 相似度最高,而JAZ1与JAZ11同源关系最近(图2)。

图1 葡萄JAZ基因家族染色体定位Fig.1 The chromosome location of JAZ gene family in grape

图2 葡萄JAZs蛋白与拟南芥JAZ家族成员进化树分析Fig.2 Phylogenetic analysis of grape JAZs protein and Arabidopsis JAZ family members
2.2 VvJAZ9基因克隆
采用同源克隆的方式,从霞多丽葡萄cDNA 中克隆到VvJAZ9的ORF 序列,条带为807 bp,单一明亮(图3)。通过胶回收纯化VvJAZ9基因PCR 将其连接至pMD19-T 克隆载体上,挑选阳性克隆进行测序。将克隆到的VvJAZ9基因提交至葡萄基因组网(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)进行比对分析后发现,VvJAZ9基因定位于第11 条染色体,共有5 个外显子和4 个内含子,ORF共807 bp,编码268个氨基酸(图4-A)。VvJAZ9蛋白分子量约为28.58 kDa,等电点pI为9.82,不稳定系数为47.51,总平均亲水性(grand average of hydropathicity,GRAVY)值为-0.404,属于碱性不稳定亲水蛋白。经NCBI 在线CDD 分析工具对VvJAZ9蛋白保守结构域进行预测,结果表明该蛋白在132~165 和217~241氨基酸处分别含有TIFY 和CCT_2两个保守结构域(图4-B),这两个结构域是JAZ蛋白家族特有的结构,因此该基因属于JAZ基因家族。
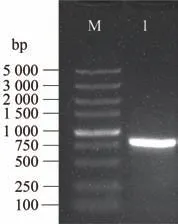
图3 VvJAZ9基因PCR扩增产物Fig.3 The PCR amplification of VvJAZ9 gene

图4 VvJAZ9蛋白序列和保守结构域预测Fig.4 VvJAZ9 protein sequence and conserved domain prediction
2.3 VvJAZ9基因受低温诱导表达分析
为进一步研究VvJAZ9基因对低温的响应,采用qRT-PCR 对VvJAZ9在低温处理后的葡萄叶片中的表达模式进行分析,结果如图5所示。葡萄植株在4 ℃低温处理0 和3 h 后叶片中VvJAZ9的表达量相较于室温处理(CK)略有上升但无显著差异。而低温处理6 h 以后葡萄叶片中VvJAZ9的表达量显著高于对照,且随着低温处理时间的延长,VvJAZ9呈上升表达趋势,在24 h达到最高值,约为对照的8 倍。表明VvJAZ9基因对低温的表现敏感且响应低温诱导表达,可能参与葡萄低温胁迫防御反应。

图5 葡萄VvJAZ9基因响应低温胁迫表达分析Fig.5 Expression analysis of grape VvJAZ9 gene in response to low temperature stress
2.4 植物表达载体构建
为研究VvJAZ9基因的功能,首先成功构建VvJAZ9基因的过量表达载体。按照前期克隆到的VvJAZ9基因序列设计引物(表1),将VvJAZ9基因的ORF 序列分别构建至植物表达载体pC1307-MYC(携带MYC 标签蛋白,为植物稳定整合表达载体)、pBI221-GFP[携带绿色荧光蛋白(green fluorescent protein,GFP)标签蛋白,为植物瞬时表达载体]和pC2300-GFP(携带GFP标签蛋白,为植物稳定整合表达载体),分别表达pC1307-VvJAZ9-MYC、pBI221-VvJAZ9-GFP和pC2300-VvJAZ9-GFP融合蛋白(图6)。

图6 JAZ9植物过量表达载体构建Fig.6 Construction of JAZ9 plant overexpression vector
2.5 VvJAZ9亚细胞定位分析
为探究VvJAZ9蛋白的亚细胞定位情况,将空载质粒pBI221-GFP 和重组质粒pBI221-VvJAZ9-GFP 通过PEG介导法分别转化葡萄愈伤组织原生质体使融合蛋白在原生质体中进行瞬时表达,22 ℃弱光培养20 h后,在激光共聚焦显微镜下观察荧光分布情况,结果如图7所示。pBI221-GFP 和pBI221-VvJAZ9-GFP 在原生质体中表达蛋白后均能检测到绿色荧光,其中空载体对照pBI221-GFP的绿色荧光在整个细胞均有分布;而pBI221-VvJAZ9-GFP 融合蛋白的荧光信号只分布于细胞核,说明VvJAZ9在细胞核中表达并发挥功能。
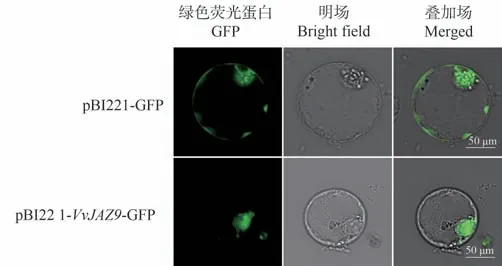
图7 VvJAZ9亚细胞定位Fig.7 Subcellular localization of VvJAZ9
2.6 抗体制备
为进一步探究葡萄中JAZ9内源蛋白表达情况,制备了VvJAZ9 蛋白的多克隆抗体。以前期所获得的VvJAZ9基因的片段为模板,设计同源重组引物(表1),将VvJAZ9基因ORF 分别构建至带有His 标签蛋白的原核表达载体pET28b 上形成融合表达载体pET28b-VvJAZ9-His(图8)。

图8 JAZ9构建至原核表达载体pET28b载体菌液PCR检测Fig.8 PCR detection of prokaryotic expression vector pET28b constructed from JAZ9
将构建成功的pET28b-VvJAZ9-His载体质粒转入原核蛋白表达菌株E.coliBL21 后经IPTG 诱导后以获得最佳表达条件。结果表明,菌株1 在37 ℃条件下经IPTG 诱导可以达到纯化目的蛋白的需求(图9-A)。随后经Ni-NTA 亲和层析获得纯化的JAZ9-His融合蛋白后,再经SDS-PAGE凝胶电泳后,考马斯亮蓝染色鉴定所提取的蛋白大小为34.77 kDa(图9-B),确定无误后经免疫挑选健康的6 周大小的新西兰大白兔两只(约2 kg),制备多克隆抗体,结果显示anti-VvJAZ9 多克隆抗体制备良好可用于下一步试验(图9-C)。
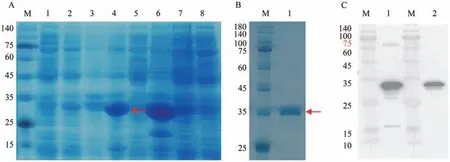
图9 JAZ9蛋白多克隆抗体制备Fig.9 Preparation of polyclonal antibody JAZ9 protein
2.7 JZA9抗体在葡萄体内检测
为确定所制备的anti-VvJAZ9 抗体是否能够检测到葡萄中的JAZ9蛋白,利用霞多丽葡萄愈伤组织提取原生质体后进行10 µmol·L-1MeJA 处理,在0、0.5、1和2 h 时收集原生质体,提取蛋白后,分别用anti-VvJAZ9 抗体检测葡萄原生质体在MeJA 处理后VvJAZ9 表达情况(图10)。结果表明,anti-VvJAZ9 抗体可以用于检测葡萄内源JAZ9蛋白表达情况,葡萄原生质体中JAZ9蛋白在MeJA 处理后呈现下降的表达趋势,说明VvJAZ9 蛋白在高水平JA 条件下容易降解,说明植物体内JAZ蛋白的降解受JA水平的影响。
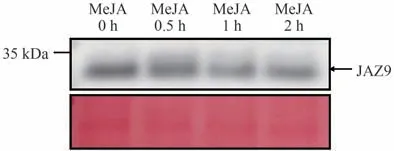
图10 葡萄原生质体中检测JAZ9蛋白Fig.10 Detection of JAZ9 protein in grape protoplast
2.8 VvJAZ9基因的植物过量表达载体检测分析
为进一步在瞬时转化体系中确认anti-VvJAZ9 抗体的特异性,同样将前期浓缩的pC1307-VvJAZ9与pC2300-VvJAZ9载体转入葡萄原生质体中,经24 h 后收集样品进行Western Blot 分析,结果如图11所示。anti-VvJAZ9抗体具有良好的特异性,可以特异识别出葡萄内源的JAZ9 蛋白、JAZ9-MYC 融合蛋白以及JAZ9-GFP 融合蛋白。表明前期构建的VvJAZ9 植物过量表达载体可以用于葡萄遗传转化试验,所制备的抗体可以用于检测葡萄内源对应基因的表达。

图11 VvJAZ9基因的植物过量表达载体检测分析Fig.11 Detection and analysis of plant overexpression vector of VvJAZ9
3 讨论
JA 是一种广泛存在于高等植物体内的脂肪酸衍生植物激素,不仅在植物生长发育过程中具有重要的调节作用,而且在植物应对生物和非生物胁迫中也扮演着重要角色[24]。SCFCOI1(Skp1-Cul1-F-box proteinCOI1)泛素蛋白复合体、转录抑制因子JAZ 蛋白和转录激活因子MYC 蛋白是JA 信号通路的三个核心作用元件,其中JAZ 蛋白作为E3 泛素连接酶SCFCOI1的靶蛋白和MYC 的转录抑制子,是JA 信号转导途径的关键组分,在JA调控植物胁迫应答的过程中发挥着重要作用[10]。JAZ 基因家族成员众多,且生物学功能丰富。目前己报道在拟南芥[25]、烟草(Nicotiana tabacum)[26]、番茄[27]、水稻[28]、 西瓜[29]和葡萄[30]中分别鉴定出12、15、13、15、8 及11 个JAZ基因。Zhang 等[30]运用生物信息学手段从葡萄基因组中鉴定出11 个JAZ基因。而本研究用生物信息学方法从葡萄全基因组中筛11 个葡萄JAZs基因家族成员,并根据JAZ基因在染色体上的分布将其分别命名为VvJAZ1~VvJAZ11。本研究筛选鉴定结果与前人一致,说明葡萄中存有11 个JAZ基因家族成员,但其分别参与葡萄各种生物学过程有待进一步研究。粗山羊草(Aegilops tauschii)中鉴定出的9个AtJAZs成员在染色体上的分布较广泛,在7号染色体上分布密集[31]。本研究发现11 个VvJAZs成员不均匀地分布在7 条染色体上,在10 号染色体上分布较集中。这与粗山羊草JAZs家族基因在染色体上的分布研究结果类似,说明葡萄VvJAZ基因家族随机分布在染色体上,没有染色体偏好性,但在10 号染色体上分布密集,推测这些基因可能存在正向或反向的重复。前人研究结果显示,橡胶草(Taraxacum kok-saghyz)TkJAZ9 蛋白与黄花蒿(Artemisia annua)AaJAZ9 蛋白的进化距离最近[32];黑果枸杞(Lycium ruthenicum)LrJAZ9 蛋白与拟南芥AtJAZ9 蛋白亲缘关系最近[33];葡萄VvJAZ9 蛋白与AtJAZ1 和VvJAZ4 亲缘关系最近[30]。本研究通过系统进化分析发现,VvJAZ9蛋白与拟南芥AtJAZ1 和AtJAZ2 亲缘关系最近,并推测VvJAZ9 蛋白可能与AtJAZ1 和AtJAZ2 在蛋白结构或功能上具有一定的相似性。
近年来,随着JAZ 蛋白在JA 信号途径中研究的不断深入,许多植物中JAZ 蛋白基因已被成功克隆。本研究采用同源克隆的方法从欧洲葡萄中成功克隆出VvJAZ9基因,隶属植物特有的JAZ基因家族。该基因位于第11 条染色体,有5 个外显子,4 个内含子,编码268 个氨基酸残基,蛋白分子质量约为28.58 kDa,是碱性不稳定亲水蛋白,与LrJAZ9 蛋白性质研究类似[33]。橡胶草TkJAZ9[32]、黑果枸杞LrJAZ9[33]、高粱(Sorghum bicolor)SbJAZ9[34]、水稻OsJAZ9[35]蛋白都具有两个高度保守的ZIM 和Jas 结构域,其中LrJAZ9 和OsJAZ9都属于核定位蛋白。本试验结果表明,VvJAZ9蛋白定位于细胞核,也具有ZIM 和Jas 保守结构域,属于典型的JAZ家族蛋白,与上述前人研究结果一致。
JAZ基因是茉莉酸信号通路中的关键节点基因,也是植物响应逆境胁迫的关键调控因子。水稻中OsJAZ9 蛋白与OsMYB30 相互作用负调控BMY(Betaamylase)基因以调节淀粉分解和麦芽糖含量,从而增强植物的抗寒性[36]。在NaCl处理后,黑果枸杞叶片中的LrJAZ9和橡胶草中的TkJAZ9基因都受盐诱导表达,随处理时间的推移其表达量逐渐升高,且都在6 h时表达量达到最高,表明LrJAZ9和TkJAZ9可能参与植物盐胁迫响应[32-33]。PEG-6000 处理后的高粱植株叶片中SbJAZ9基因的表达水平显著增加,在12 h 达到最大[34]。棉花(Gossypium hirsutum)幼苗叶片中GhJAZ1基因受低温诱导表达,随着低温处理时间的延长,其表达量逐渐升高,且在12 h 达到最高值,推测该基因参与棉花低温胁迫防御反应[37]。本研究结果表明,低温处理后的葡萄叶片中VvJAZ9基因的表达量随胁迫时间延长而呈现上升趋势,显著受低温诱导表达,与上述前人研究结果类似,说明VvJAZ9基因可能参与葡萄应答低温胁迫过程。
目前,运用原核表达的重组蛋白免疫鼠、兔等动物制备多克隆抗体已成为一种行之有效且常用的方法[38]。此外,通过原核表达获得大量的抗原蛋白,既可用于蛋白质性质与功能研究,也可用于蛋白质的相互作用等生化功能研究[39]。在葡萄抗寒方面研究所制备出的多克隆抗体有anti-VvHOS1[1]、anti-VaCIPK18[22]和anti-VaERD15[40],而VvHOS1、VaCIPK18和VaERD15在植物响应低温胁迫过程中发挥着重要作用。本研究中VvJAZ9蛋白不含能够影响原核表达效率的信号肽、跨膜区等高级结构,使得其在原核细胞内能够高效表达。经免疫纯化后可获得效价高且特异性好的anti-VvJAZ9多克隆抗体,该抗体能够特异识别葡萄中不同形式JAZ9 蛋白。通过anti-VvJAZ9 抗体检测到外源MeJA 处理后的葡萄中VvJAZ9蛋白表达呈现下降的趋势,说明在JA 作用下葡萄JAZ 蛋白易发生降解,JA 信号通路中JAZ 蛋白的降解受JA 水平影响。综上,本研究为深入分析JAZ蛋白在葡萄抗寒反应中的调控功能奠定了理论基础,并为JAZ 基因参与葡萄抗寒控机理的研究和抗寒葡萄品种的选育提供了参考。
4 结论
本研究从欧洲葡萄中克隆得到VvJAZ9基因,经生物信息学分析可知,VvJAZ9 蛋白具有JAZ 蛋白家族特有的TIFY 和CCT_2 保守结构域。qRT-PCR 结果表明,VvJAZ9 显著响应低温诱导表达,推测该基因可能在葡萄抵御冷胁迫的应答过程中起重要作用。通过亚细胞定位分析发现,VvJAZ9在细胞核中表达并发挥功能。将VvJAZ9基因成功构建至植物表达载体pC1307-MYC、pBI221-GFP、pC2300-GFP 及原核表达载体pET28b-His形成融合表达载体pC1307-VvJAZ9-MYC、pBI221-VvJAZ9-GFP、pC2300-VvJAZ9-GFP 和pET28b-VvJAZ9-His。pET28b-VvJAZ9-His 在E.coliBL21 中,经37 ℃、1.0 mmol·L-1IPTG 诱导表达,再经免疫纯化后获得anti-VvJA9 多克隆抗体。Western Blot 结果表明,anti-VvJAZ9抗体可以特异性识别葡萄中不同形式的VvJAZ9 蛋白,植物体内高水平的JA 会促使JAZ 蛋白降解,JA 信号途径中的JAZ 蛋白的降解受JA 水平影响。
