桔梗过氧化物酶Ⅲ基因家族的鉴定及辐射后表达分析
2023-05-06李雪虎马晓辉王富胜周利斌
刘 霄 杜 艳 李雪虎 晋 玲 马晓辉 王富胜 周利斌,5,*
(1中国科学院近代物理研究所生物物理室,甘肃 兰州 730000;2中国科学院大学,北京 100049;3甘肃中医药大学药学院,甘肃 兰州 730000;4定西市农业科学院,甘肃 定西 743000;5白银市科近重离子束生物产业创新研究院,甘肃 白银 730900)
桔梗(Platycodon grandiflorus)是桔梗科桔梗属的多年生草本植物,产地辽阔,主要分布于我国东北、华北、华东、华中及西南地区,具有较强的环境适应能力[1]。其干燥根是常用中药材之一,具有宣肺利咽、排脓祛痰的功效[2],在新冠病毒的防治中也发挥了重要作用[3]。随着基因测序技术的发展,桔梗染色体水平的基因组组装已完成,基因组的总长度为622.86 Mb,编码基因大于20 000 个基因[4],但其多数基因家族仍然缺乏系统的鉴定和功能研究。
过氧化物酶Ⅲ(peroxidases class Ⅲ,PERs)是一个高等植物中普遍存在的多基因抗氧化酶家族,主要参与过氧化氢的催化反应,通过过氧循环、氧化循环和羟基循环维持细胞内活性氧的平衡[5]。目前,PERs 这一多基因家族已在拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)等多种植物中被报道[6]。为促进抗氧化物酶的系统研究,2004年瑞士生物信息学研究所主持建立了专门研究Ⅲ类过氧化物酶家族的数据库PeroxiBase(http://peroxibase.toulouse.inra.fr/)[7]。此外,非模式植物的抗氧化物酶家族研究也相继开展,例如大豆(Glycine max)中筛选获得了164个PERs家族成员,对其中部分成员进行了克隆和功能分析[8];石榴(Punica granatumL.)中共鉴定出107 个PERs 基因家族成员[9];茶树[Camellia sinesis(L.)O.ktze]中鉴定到122个PERs基因家族成员[10];谷子(Setaria italicaL.)中鉴定到132个PERs家族成员[11]。
Ⅲ类PERs既参与了植物的生长代谢调控[12-13],又能增强植物对盐胁迫、干旱、低温等环境胁迫的耐受性[14-15]。此外,辐射也会影响植物过氧化物酶的活性[16-17]。王婷等[18]研究表明,浮萍(Lemna minorL.)经紫外光(ultraviolet radiation B,UV-B)短时间辐射后过氧化物酶的活性降低,而较长时间辐射后过氧化物酶活性增加;60Co-γ射线辐射库尔勒香梨(Pyrus sinkiangensisYu)和黑麦草(Lolium perenneL.)后都引起了植株过氧化物酶基因的差异表达[19-20];许超丽等[21]研究表明,水稻幼苗经高能重离子束辐射后,过氧化物酶的活性随辐射后时间的增加先升高后降低。上述前人研究说明不同类型的辐射均会影响植物过氧化物酶基因的表达和酶活性。
尽管植物Ⅲ类PERs 家族在抵御胁迫和辐射损伤方面已被广泛研究,但PERs家族成员的功能研究仍然滞后。由于成员之间功能冗余,底物特异性低,对单个PER基因进行探究依然存在挑战[22]。目前,关于中药材桔梗PERs(PgPERs)基因家族鉴定和功能分析鲜见报道,因此,本研究基于生物信息学对PgPERs 家族进行了鉴定,分析其蛋白的理化性质、保守基序、启动子调控元件及在辐射处理后基因的表达量变化,以期促进对PgPERs特征和功能的理解。
1 材料与方法
1.1 数据来源和试验材料
在The Arabidopsis Information Resource 数据库(TAIR,https://www.arabidopsis.org/)检索并获取拟南芥过氧化物酶Ⅲ家族73个成员的蛋白序列。从Genome Warehouse 数据库(GWH,https://ngdc.cncb.ac.cn/gwh/)下载桔梗基因组的序列文件和注释文件,登录号为:GWHARYT00000000。
供试桔梗种子为紫花桔梗,由定西市农业科学研究院提供,挑选粒型饱满的桔梗种子用4%的次氯酸钠消毒10 min,再用无菌水洗5 次,将种子置于1/2 MS(Murashige and Skoog)培养基上培养,光周期为16 h光照/8 h黑暗,培养温度为(25±1)℃。
1.2 基因家族鉴定和理化性质分析
使用TBtools V1.098769 的Blast 功能进行序列相似性鉴定[23],再将鉴定到的蛋白序列与Swissprot 序列比对以滤除旁系同源。过氧化物酶Ⅲ家族的结构域在Pfam 的编号为PF00141(血红素过氧化物酶结构域),使用TBtools 的HMM 功能进行PERs 的结构域鉴定。使用TBtools 的Protein Paramter Calc 功能进行蛋白质理化性质分析。
1.3 蛋白保守模式和启动子调控元件分析
使用MEME Suite 5.4.1(https://meme-suite.org)进行保守模式分析,使用TBtools 可视化分析结果。提取PgPERs基因上游2 000 bp 的启动子序列,在PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行基因调控元件的分析,使用TBtools进行可视化。
1.4 系统进化树和共线性分析
使用MEGA 7 进行蛋白的多序列比对,用邻接(neighbor-joining,NJ)法构建系统进化树。利用TBtools的One Step MCScanX-Super Fast 功能进行桔梗和拟南芥基因的共线性分析,使用Dual Systeny Plot 功能进行可视化。
1.5 桔梗幼苗辐射处理及叶面积测定
培养12 d后的桔梗幼苗被高能碳离子束和X射线辐射处理。碳离子束辐射由兰州重离子研究装置(Heavy Ion Research Facility in Lanzhou,HIRFL)提供,能量为967 MeV,样品处平均传能线密度(linear energy transfer,LET)为34 keV·µm-1,辐射剂量为5、10、15、20 和30 Gy。X 射线辐射采用X-RAD225 X 射线辐射仪(Precision X-Ray,美国),管电压为225 kV,辐射剂量为10、20、30、40 和60 Gy。对照组与辐射组培养条件一致,但不辐射处理。使用1/2的Hoagland营养液对辐射后的桔梗进行水培,培养20 d 后测量最大叶的叶面积。
1.6 RNA测序和分析
辐射后6 和24 h 收集辐射组和对照组样品,每组3 个生物学重复,液氮速冻后保存于-80 ℃冰箱。选取15 Gy 重离子束和20 Gy X 射线辐射后的样品用于转录组测序分析。使用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法提取样品RNA,使用华大基因DNBSEQ 高通量测序平台进行RNA 测序,再进行数据质控、与基因组比对、基因注释,将基因表达量标准化为每千个碱基的转录每百万映射读取的片段(fragments per kilobase of transcript per million fragments mapped,FPKM)。测序结果已上传至国家基因组科学数据中心(National Genomics Data Center,NGDC),登录号为OMIX001025。使用TBtools 的Blast 功能对RNA 测序序列与鉴定的53 个PgPERs进行相似性鉴定,相似度大于99%的确定为PgPERs。分析PgPERs基因在各样品中的表达量变化情况,以|Log2(Fold Change)|≥1,且Q 值≤0.05 作为鉴定差异表达基因的条件。使用辐射组和对照组表达量差异倍数的对数值Log2(Fold Change)做热图,使用各样品的基因FPKM值做表达量柱状图。
1.7 蛋白结构分析
使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对PgPERs蛋白质进行二级结构分析,使用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/)进行蛋白质三级结构分析。
2 结果与分析
2.1 桔梗过氧化物酶Ⅲ家族的鉴定及其理化性质
基于序列相似性鉴定桔梗PERs,根据TAIR 数据库中已鉴定的拟南芥过氧化物酶Ⅲ(AtPERs)家族成员的蛋白序列,对桔梗蛋白序列比对,得到了63个桔梗PERs蛋白,记为PgPERs。使用Swissprot数据库注释排除6 个旁系同源。另外,PERs 具有由原卟啉IX 和Fe(Ⅲ)组成的血红素基团,即血红素过氧化物酶结构域PF00141,所以对桔梗PERs 家族进行结构域鉴定,得到64 个PgPERs。综合两种鉴定结果来看,排除旁系同源后,同时具有序列相似性和血红素过氧化物酶结构域的PgPERs共57个。
根据Swissprot 注释信息和桔梗基因ID 排序,对PgPERs家族成员进行命名(电子附表1)。蛋白理化性质分析表明,PgPERs家族成员的蛋白序列长度差异较大:PgPER1-1、PgPER5-3、PgPER64-2、PgPER64-3均小于200个氨基酸,PgPER11为846个氨基酸,其余PgPERs的氨基酸数量在258~621 之间。PgPERs 的蛋白分子量在11 094~94 422 之间,不稳定性指数为22.18~58.95。其中34 个蛋白为碱性蛋白(占总数的60%),其余蛋白的理论等电点介于4.46~6.95。
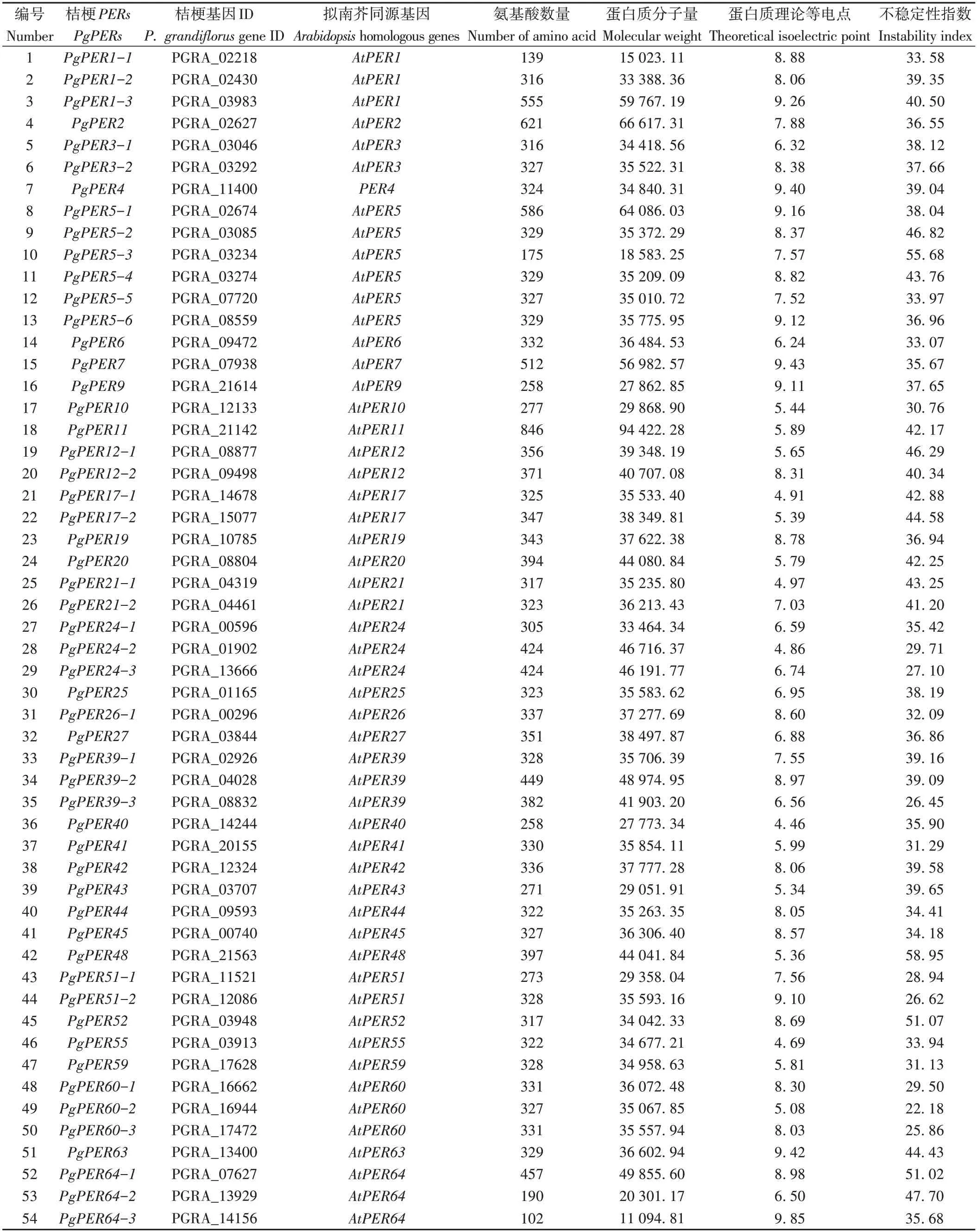
电子附表1 桔梗过氧化物酶Ⅲ家族成员的理化性质Electronic Table S1 Physicochemical properties of peroxidases class Ⅲ of Platycodon grandiflorus
2.2 PgPERs的保守基序分布
同一个基因家族编码的蛋白质通常拥有生物学功能相似的保守序列。保守基序(Motif)分析结果显示,PgPER1-1、PgPER5-3、PgPER64-2 和PgPER64-3 蛋白存在明显不同的Motif模式,可能不属于PERs 成员,因此在后续的分析中予以滤除(图1)。其余53个PgPERs的蛋白质序列具有相似的序列特征,即都具有Motif 2、Motif 3、Motif 4、Motif 5、Motif 6、Motif 8 和Motif 9,推测这7个Motifs可能为PgPERs家族蛋白质的共有保守基序。28个蛋白都具有9个保守的基序(Motif 1~Motif 9),其中PgPER1-3、PgPER2 和PgPER5-1 的蛋白序列较长,存在多个重复的Motif。结果表明,桔梗的Ⅲ类过氧化物酶家族具有相似的保守基序组成和排列顺序。
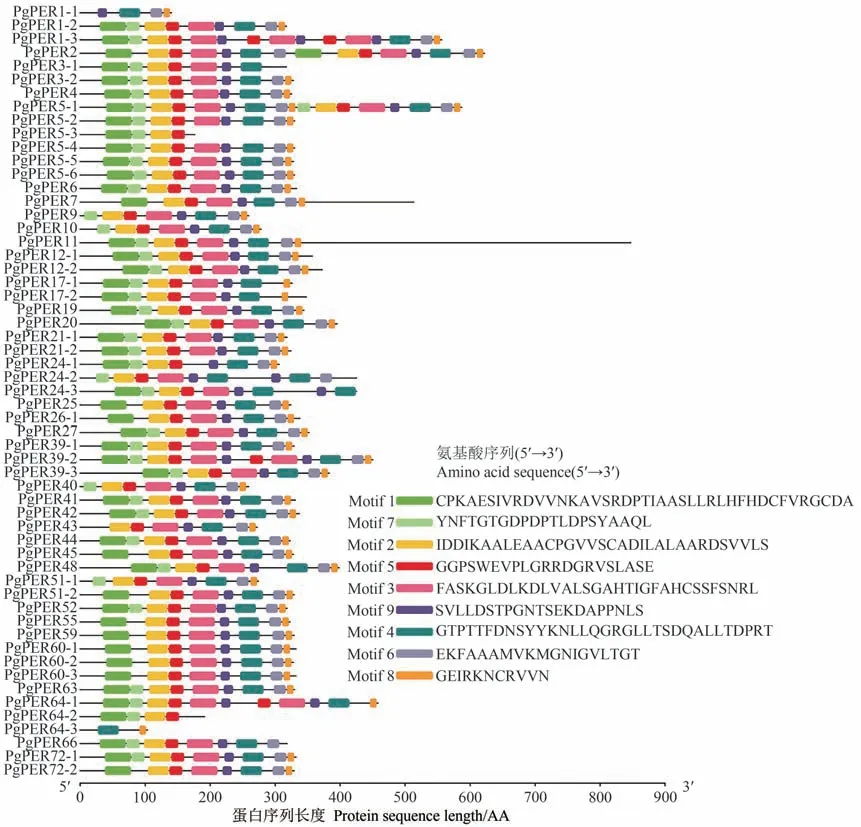
图1 PgPERs家族的蛋白质保守基序分布Fig.1 Distribution of protein conserved motifs of PgPERs family
2.3 PgPERs基因的启动子调控元件分布
启动子中的顺式作用元件在基因转录起始调控中起重要的作用,其分布规律揭示了蛋白功能和调控水平的差异。在PgPERs基因家族启动子区检测到大量生长发育、植物激素和逆境胁迫相关的顺式作用元件(图2)。生长发育相关的调控元件包括胚乳发育、分生组织发育、细胞分化和种子特异调控相关的作用元件等。植物激素相关的调控元件包括茉莉酸、赤霉素、脱落酸、水杨酸和生长素等相关的顺式作用元件。非生物胁迫相关的调控元件包括干旱诱导元件、厌氧诱导元件、防御和胁迫响应元件、低温响应元件和创伤响应元件。以上结果映证了PERs家族在植物发育和胁迫响应中发挥重要功能。

图2 PgPERs的启动子区调控元件Fig.2 Regulation elements of PgPERs in the promoter region
2.4 PgPERs的进化分析
基于PgPERs 的氨基酸序列,使用MEGA 构建系统进化树。由图3可知,根据进化距离,这些PgPERs分为5个簇(Cluster)。其中簇1分化时间最早,包含PgPER60在内的9个蛋白;簇3 和簇5 包含的PgPERs 最多,分别为15个和17个。桔梗和拟南芥的PERs基因共线性分析发现这两个物种间存在29 对共线性关系(图4),表明这些PERs 家族的基因在拟南芥和桔梗中具有较高的保守性,这种基因复制事件在植物进化过程中至关重要。桔梗5 号染色体上的PERs基因与拟南芥的共线性关系较多,说明这两个物种5号染色体上的PERs基因可能来自共同的祖先,具有类似的功能。另外,分布在2号、6号和9号染色体的PgPERs基因与拟南芥不存在共线性关系。

图3 PgPERs的系统进化树Fig.3 Phylogenetic tree of PgPERs

图4 桔梗和拟南芥间PERs基因的共线性Fig.4 Collinearity of PERs between Platycodon grandiflorus and Arabidopsis thaliana
2.5 辐射后PgPERs基因的表达分析
重离子束和X 射线辐射均对桔梗生长有影响,随着辐射剂量的增加,桔梗叶面积减小。相同剂量下,重离子束对桔梗叶片生长的抑制作用比X 射线更强(图5-A、B)。15 Gy的重离子束和20 Gy的X射线对桔梗幼苗叶面积的抑制效应相当,15 Gy重离子束辐射后桔梗的平均叶面积为1.57 cm2,20 Gy X 射线辐射后桔梗的平均叶面积为1.59 cm2。因此选择对桔梗生长具有相同抑制效应的15 Gy 重离子束和20 Gy X 射线辐射处理桔梗幼苗,探究两种辐射对桔梗抗氧化物酶基因表达调控的异同。重离子束和X 射线辐射处理后6 和24 h 共检测到10 个PgPERs基因的表达量发生了显著变化(图5-C)。PgPER1-2(图6-A)、PgPER72-1(图6-I)和PgPER72-2(图6-J)在X 射线辐射后24 h 表达量显著降低;PgPER3-2(图6-B)和PgPER55(图6-H)的表达量在X 射线辐射后6 h 显著降低;X 射线辐射后24 hPgPER43的表达量是对照组的6.77 倍(图6-G);PgPER5-5的表达量在X 射线辐射后6 h 和24 h 都显著降低(图6-D);这些基因在重离子束辐射后都未出现差异性表达(图5-C)。重离子束辐射后PgPER5-2(图6-C)和PgPER12-1(图6-E)的表达量分别是对照组的4.63 倍和3.84 倍。PgPER39-1(图6-F)的表达量在重离子束和X 射线辐射后6 h 都显著升高(图5-C)。这说明重离子束和X 射线辐射导致了PgPERs基因不同的表达模式,这可能是由于两种辐射的物理学特性不同,引发了桔梗不同的生物学响应。

图5 重离子束(A)和X射线(B)辐射对桔梗叶面积和PgPERs基因表达(C)的影响Fig.5 Effects of the heavy ion beam(A)and X-ray(B)radiations on leaf area and expressions of PgPERs (C)of Platycodon grandiflorus

图6 重离子束和X射线辐射后桔梗PgPERs基因的表达量Fig.6 Expressions of PgPERs of P.grandiflorus after heavy ion beam and X-ray radiations
2.6 响应两种辐射的PgPERs结构分析
对响应重离子束和X 射线辐射的10 个PgPERs 进行蛋白质结构分析,结果如表1所示。这些蛋白质的二级结构包括α-螺旋、延伸链、β-转角和无规则卷曲,α-螺旋和无规则卷曲占比较大,β-转角构象最少。对蛋白质进行三级结构预测,目标序列与模型序列的覆盖度在85%及以上,预测结果显示PgPER1-2、PgPER71-1和PgPER71-2 具有相似的三级结构,其余7 个蛋白的三级结构相似(图7)。此外,除PgPER43之外,其他9种蛋白被预测为有跨膜螺旋结构,氨基酸数量为119~153 个(N 端至C 端),说明这些蛋白可能会经历跨膜转运。
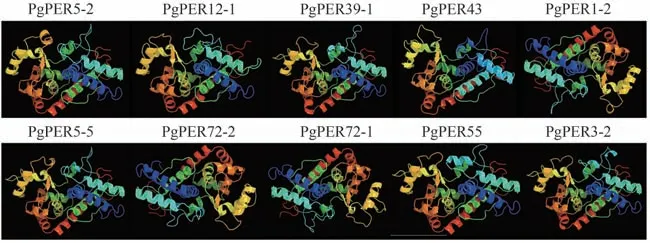
图7 响应辐射的PgPERs的三级结构Fig.7 Tertiary structure of PgPERs responded to radiation

表1 响应重离子束和X射线辐射的PgPERs二级结构预测Table 1 Secondary structure prediction of PgPERs responded to heavy ion beam and X-ray radiations
3 讨论
植物在非生物胁迫条件下,会通过增强自身的抗氧化活性以减缓活性氧造成的损伤。Ⅲ类过氧化物酶能够促进细胞对过氧化氢(H2O2)的分解,提高植物对胁迫的耐受性。本研究通过生物信息学的方法鉴定了桔梗PERs 基因家族,共鉴定出53 个PgPERs,低于拟南芥(73个AtPERs)中的成员数量,这可能是进化过程中基因复制和丢失造成的结果。根据进化树结果,这些PgPERs共分为5个簇(图3),包括PgPER60在内的9个成员进化最早,即Clusterl进化最早。桔梗与拟南芥的PERs之间共存在29 对共线性关系(图4),说明桔梗与拟南芥的这29个基因由同一个祖先进化而来。
Motif分析表明,PgPERs与其他物种的PERs类似,具有9个保守的Motif(图1),这与Kidwai等[5]的研究结果一致,说明了植物Ⅲ类过氧化物酶基因家族在进化和功能上的保守性。一方面,PERs参与了植物生长发育的调节[12-13],如PRX8转基因苹果(Malus domesticaL.)的PER 活性提高了4倍,使苹果的生长速度加快[24]。另一方面,PERs在胁迫条件下发挥了重要作用[14-15],如大豆PER过表达增强了大豆的耐盐性[25];橡胶树(Hevea brasiliensis)HbPRX42在机械损伤、干旱和H2O2处理下诱导性表达[26]。本研究结果表明PgPERs 启动子顺式作用元件含有多个生长发育、植物激素和逆境胁迫相关的调控元件(图2),这与Ⅲ类过氧化物酶的多种生物学功能相互对应。
电离辐射是一种应用广泛且有效的育种技术,辐射作用于植物细胞,通过辐解水分子产生超氧阴离子、H2O2、羟自由基等活性氧物质[27],这些活性氧不仅可以造成植物的氧化损伤,而且会诱发抗氧化系统的积极调控。本研究在重离子束和X 射线辐射桔梗后检测到10 个PgPERs基因差异表达(图5),PgPER39-1在两种电离辐射处理后6 h都显著上调。而PgPER5-2和PgPER12-1表达量仅在重离子束辐射后显著上调(图5-A),说明基因表达量增加,使桔梗的抗氧化物酶活性升高。王琳[28]的研究也表明较低剂量的重离子束辐射后过氧化物酶的活性升高。其余7个PgPERs仅在X射线辐射后呈现显著差异表达。PgPER3-2、PgPER5-5和PgPER55在X 射线辐射后6 h 下调。PgPER1-2、PgPER5-5、PgPER72-1和PgPER72-2在X射线辐射后24 h下调,而PgPER43上调表达(图5-B)。这些PgPERs基因辐射后不同的表达模式反映了桔梗对不同辐射的响应特征。仅2 个基因(PgPER39-1和PgPER43)在X 射线辐射后上调表达,推测是因为X 射线辐射后产生较少的活性氧。而重离子束作为高LET 辐射[29],其能量约为967 MeV,辐射产生了较多活性氧,激活PgPERs表达以缓解氧化损伤。
响应辐射的10 个PgPERs启动子区调控元件主要包括厌氧诱导、干旱、低温和激素响应元件。其中6 个PgPERs基因有胁迫和防御元件(5'-ATTCTCTAAC-3'),包括PgPER3-2、PgPER5-5、PgPER12-1、PgPER39-1、PgPER72-1和PgPER72-2(图2)。结构分析结果显示,响应电离辐射的PgPERs 二级结构包括了α-螺旋和β-转角等结构,与晶体结构研究报道结果相似:Ⅲ类过氧化物酶结构主要包括10~12 个保守α-螺旋、由8个半胱氨酸残基形成的4 个保守的二硫键、2 个短的β-链和钙结合位点[30-31]。PERs的亚细胞位置是其行使生物功能的重要因素,例如位于细胞壁、细胞质或质体将有助于细胞壁稳定性和压力耐受。许多定位于细胞外区域的PERs在植物生长发育和植物防御中发挥重要作用[32-33],而一些定位于液泡上的PERs通常在植物生长和防御中的作用微弱[34]。在本研究中,响应于电离辐射的PgPERs大部分都具有跨膜螺旋,具有分泌到细胞外的潜能,说明这几个PgPERs参与桔梗防御和胁迫响应。
由于PERs 在植物生长和胁迫耐受中发挥了重要的作用,一些PERs已经通过过表达产生了对不同类型胁迫耐受的转基因植物。例如,OsPRX38使水稻(Oryza sativa)呈现出对砷的耐受性,使植株的砷含量降低[32];AtPRX64转基因烟草表现为对铝的耐受性,并减少了铝在植物中的积累[35]。上述结果说明PERs 在作物改良中的应用潜力,可以用于提高植物对各类胁迫的耐受性,增强植物对环境的适应性。但PERs基因的功能特征、分子和遗传研究不足,导致其在作物改良中的应用相对滞后。后续研究将在本研究基础上,开发具有胁迫耐受功能的桔梗PERs基因,以期在药材品种改良中进行应用。
4 结论
本研究鉴定了中药材桔梗的PERs基因家族,分析了成员特点及其幼苗经高能重离子束和X射线辐射处理后PgPERs的表达特征,共鉴定到53 个PgPERs 基因家族成员,其蛋白序列长度主要分布在258~621 个氨基酸之间,多数是碱性蛋白;PgPERs启动子区存在多种与生长发育、植物激素和逆境胁迫相关的顺式作用元件;与拟南芥相比有29 个基因来自共同的祖先。高能重离子束导致3 个PgPERs上调表达,X 射线诱发了6个PgPERs下调表达,这些基因编码的蛋白二级结构以α-螺旋和无规则卷曲为主,三级结构的相似度高,并含有跨膜螺旋。
