可溶性识别分子PTX3在ST段抬高型心肌梗死中的作用及其分子机制的研究
2023-05-05张雅兰李晓琳
苏 艳,孙 倩,张雅兰,李晓琳
(保定市第二医院 1.心血管内一科,2.特需诊疗科,河北 保定 071051)
ST段抬高型心肌梗死(STEMI)其临床特征为有典型的缺血性胸痛,持续超过20 min,血清心肌坏死标记物浓度升高并有动态演变,心电图具有典型的ST段抬高[1-2]。STEMI的先兆症状主要包括心绞痛发作较以往频繁、程度较剧、持续较久、硝酸甘油疗效差,其诱发因素及发病分子机制尚不明确[3-4]。有研究表明通过对STEMI患者冠状动脉内炎症的评估,证实多种炎症因子的释放与STEMI具有显著的相关性[5],另有针对199名STEMI患者的临床队列研究,通过使用炎症因子IL-6受体的抑制剂治疗,证实IL-6受体抑制剂可以显著的提高患者心肌挽救率[6]。PTX3是一种可溶性识别分子,在炎症因子和外源刺激下由多种细胞如成纤维细胞、活化的内皮细胞、树突状细胞、巨噬细胞以及其他组织细胞产生[7-8],与心衰及冠状动脉粥样硬化斑块的易损性密切相关,在破裂的冠状动脉斑块中也检测到PTX3的高表达,可见PTX3是参与心肌损伤过程的重要分子[9-10],但其在STEMI患者中的表达水平尚不明确,同时PTX3是否可以影响炎症因子的分泌同时参与心肌细胞的凋亡,进而影响临床心肌挽救率尚不明确。因此,本研究将通过STEMI患者探究外周血PTX3的表达水平,分析患者血清中炎症因子的表达水平,同时通过人心肌细胞过表达PTX3,探究PTX3是否通过影响炎症因子释放干预心肌细胞凋亡,为PTX3在STEMI中的作用及其分子机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样本来源 人心肌细胞细胞系HCM购于中国科学院典型培养物保藏委员会细胞库(上海);2020年1月-2022 年1月在保定市第二医院获得的临床资料完整的STEMI患者93例以及183例健康对照,年龄(56.45±8.40)岁。入选标准:①符合中华医学会心血管分会制定的急性心肌梗死诊断和治疗指南提出的STEMI的诊断标准;②发病时间小于12 h。排除标准:①心源性休克;②既往有出血性脑卒中或中重度肝病的患者;③大出血活动期患者;④6个月内有重大手术或外伤、脑血管疾病者;⑤凝血疾病和血小板减少症者。本筛查研究中所有参与者均签署知情同意书并通过保定市第二医院伦理委员会审核。
1.1.2 试剂和设备 DMEM(Gibco,货号:11995040),FBS(Gibco货号: 16000-044),P/S(Gibco,货号15140-022);细胞培养皿、离心管、EP管等试验耗材购于美国Corning公司;PTX3质粒及NC质粒等购于广州Ribobio公司;引物由生工生物工程(上海)股份有限公司设计并合成;330全自动生化分析仪购于上海科华卓越有限公司,FACSVia流式细胞仪购于美国BD公司。
1.2 方法
1.2.1 血液生化指标检测 所有患者及健康对照用抗凝管采集5 mL外周血,室温静置30 min,3 500 r/min 离心10 min,分离血清,检测血清TC、TG、HDL-C、Non-HDL-C、Tnl admission、Tnl max、AOPP、TOS、PAB、SH、TAS、SOD 各指标。
1.2.2 细胞培养及质粒转染 HCM细胞培养条件:5%,CO2;37 ℃,培养密度:1×106cells/培养皿;换液及传代:每隔1 d更换培养液,2~3 d传代,传代比例为1∶3~4。转染条件:按照Lipofectamine TM 3000说明书对细胞进行转染NC质粒和PTX3质粒,转染6~8 h后更换完全培养基,5 % CO2,37 ℃培养。
1.2.3 qPCR检测PTX3、IL-1β、IL-6、TNF-α表达水平 通过qPCR检测细胞中的PTX3、IL-1β、IL-6、TNF-α表达水平。将适量的细胞加入1 mL TRIZOL法提取总RNA,后反转录合成cDNA,进行PCR扩增。95 ℃预变性10 min,95 ℃变性15 s, 55 ℃退火15 s,共40个循环。引物序列见表1。每个样品重复3次检测,利用2-ΔΔCT相对定量法计算各个指标的相对表达量,用内参β-actin对其标准化处理。

表1 引物序列
1.2.4 细胞凋亡实验 将各组细胞用不含EDTA的胰酶消化后, 800 r/min 4 ℃离心5 min收集细胞。用预冷的PBS洗涤细胞2次,800 r/min 4 ℃离心5 min。收集细胞加入100 μL 1×Binding Buffer重悬细胞。严格按照试剂盒要求加入5 μL Annexin V-FITC和10 μL PI Staining Solution,轻轻混匀;反应条件为:避光、室温10~15 min;加入400 μL 1×Binding Buffer,混匀后放置于冰上;样品在1 h内用流式细胞仪检测。

2 结果
2.1 两组患者一般资料比较 如表2所示,与对照组相比,STEMI组患者的收缩压和舒张压、血糖、TG浓度高于对照组,而TC和HDL-C浓度低于对照组。氧化应激参数中STEMI组的PAB值较高,而STEMI患者的AOPP浓度低于对照组。STEMI患者的抗氧化酶SOD显著升高,差异具有统计学意义(P<0.001)。

表2 STEMI患者和对照组的一般资料比较
2.2 两组患者PTX3 mRNA表达水平的比较 通过qPCR检测两组患者外周血PTX3 mRNA表达水平,图1结果表明,与对照组相比,STEMI组患者PTX3 mRNA表达水平显著增加,差异具有统计学意义(P<0.01)。
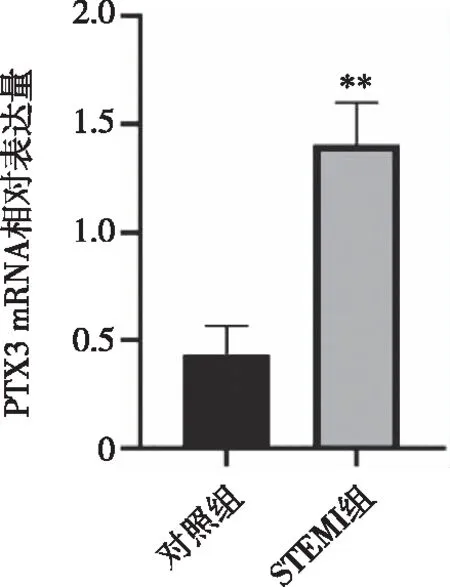
图1 两组患者PTX3表达水平比较
2.3 两组患者血清炎症因子表达水平的比较 两组患者外周血血清炎症因子表达水平,如表3所示。结果表明,与对照组患者相比,STEMI组患者外周血炎症因子IL-1β、IL-6、TNF-α表达水平均显著升高,差异具有统计学意义(P<0.01)。
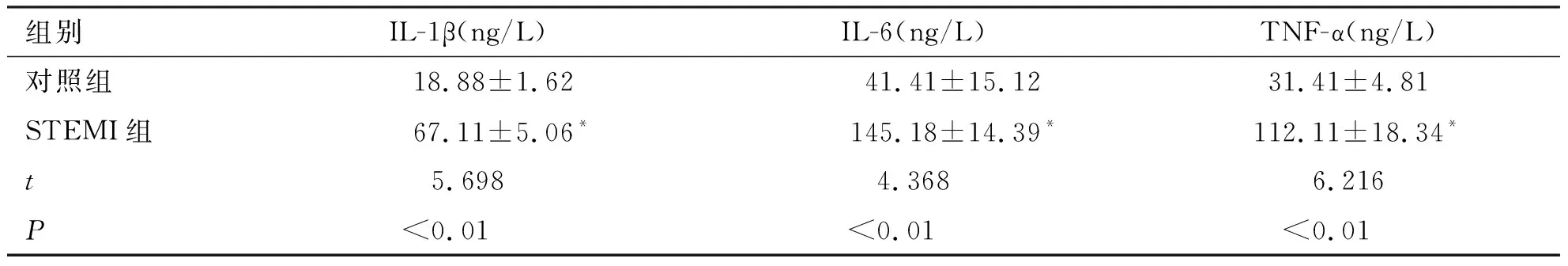
表3 两组患者外周血炎症因子水平比较
2.4 转染PTX3对人心肌细胞炎症因子表达的影响 通过qPCR检测转染PTX3对炎症因子mRNA表达水平的影响,结果表明与对照组和NC组相比,试验组细胞IL-1β、IL-6、TNF-α表达水平显著升高,差异具有统计学意义(P<0.01),NC组和对照组比较,差异无统计学意义(P>0.05,表4)。

表4 转染PTX3对人心肌细胞炎症因子表达的影响
2.5 转染PTX3对人心肌细胞凋亡表达的影响 通过流式细胞分析转染PTX3对人心肌细胞炎症因子表达的影响,如图2所示,结果表明与对照组和NC组比较,试验组细胞凋亡比例显著升高,差异具有统计学意义(P<0.01),NC组和对照组比较,差异无统计学意义(P>0.05)。

*:与对照组比较, P<0.01。图2 转染PTX3对人心肌细胞凋亡表达的影响
3 讨论
ST段抬高型心肌梗死由于心脏的供应血管有急性血栓形成,导致相应的区域出现透壁性心肌梗死[11]。STEMI容易造成患者心律失常、室壁瘤,甚至心脏破裂,导致患者猝死,因此应尽早的给予溶栓或者应用PCI进行治疗,救治及时大多数患者都能获得较好的临床预后,如果患者发病时间过长,错过最佳救治时间不能逆转心脏损伤,会造成患者后期活动耐量下降、呼吸困难、生活质量下降的不良症状[12-13]。
炎症因子释放对STEMI病理生理学中起着重要干预作用[14],研究表明STEMI患者的炎症生物标志物IL-6、IL-1β和丙二醛(Malondialdehyde,MDA)水平显著升高,IL-6、IL-1β和MDA之间以及STEMI患者TIMI评分与IL-1β之间存在正相关关系[15],也有研究证实系统免疫炎症指数可以作为预测ST段抬高型心肌梗死患者引发的肾病的炎症标志物[16],本研究通过临床STEMI患者及健康者血清,发现STEMI患者炎症因子IL-1β、IL-6及TNF-α显著高表达,这与当前心肌梗死研究结果相一致,提示炎症因子大量释放可能是STEMI发病的结果之一;同时,本研究通过qPCR证实了PTX3在STEMI患者中显著高表达。有研究表明,PTX3在炎症、止血反应、组织修复和纤维化消退的调节中发挥重要功能,这种可溶性模式识别分子属于体液固有免疫系统的重要分子,通常由吞噬细胞和基质细胞在炎症部位迅速产生,在感染或组织器官损伤中发挥作用[17]。这提示在STEMI发生发展过程中,PTX3可能通过影响炎症因子干预心肌损伤的修复及心肌细胞功能。有研究通过小鼠及细胞学实验证实PTX3参与了多种类型细胞的增殖、分化、凋亡,并且这些过程伴随着炎症因子的调控,PTX3通过JNK信号通路促进小鼠胚胎干细胞心脏分化,PTX3增强了JNK的磷酸化,促进了Nkx2 Mef2c、Tbx5、dHand和αMHC的转录,发挥了小鼠胚胎干细胞向心肌细胞分化中的调节作用[18];PTX3调节脂多糖诱导炎症期间棕色脂肪细胞中miR-21的表达和分泌[19],内皮功能障碍中神经肽Y升高促进巨噬细胞浸润和平滑肌泡沫细胞形成是通过PTX3的调控发生的,并且这些过程伴随着增加炎症细胞的趋化性而放大血管炎症,触发平滑肌泡沫细胞的形成[20]。以上研究均证实了,在不同类型的细胞及不同的组织中,PTX3均会影响炎症因子释放,从而发挥特定的生物学功能。作者在临床样本中发现STEMI患者中PTX3表达增高,进一步通过细胞学实验探究了PTX3和炎症因子与心肌细胞凋亡的关系。本研究探究过表达PTX3对心肌细胞的影响,qPCR结果提示过表达PTX3后心肌细胞炎症因子IL-1β、IL6和TNF-α显著上升,这提示PTX3具有调控炎症因子释放的功能,与临床结果发现的患者外周血炎症因子及氧化应激分子的增加结果相一致;同时本研究通过流式细胞分析探究炎症因子释放是否会对心肌细胞凋亡产生影响,结果表明过表达PTX3会引发心肌细胞存活率降低,而早期凋亡和晚期凋亡水平均显著增加,这与当前文献报道的STEMI患者存在不可逆的心肌细胞损伤相一致。由此推测,PTX3可能通过促进炎症因子释放,引发心肌细胞凋亡,进而导致了心肌组织的不可逆损伤。
综上,STEMI患者中PTX3表达水平显著升高,炎症因子分泌增加,表明PTX3可能通过促进炎症因子的分泌诱导心肌细胞的凋亡,引发心肌损伤。本研究可以进一步通过分子生物学实验探究PTX3对细胞凋亡相关分子CyclinD1和CDK1等信号通路的调控,完善PTX3对细胞凋亡影响的分子机制,为临床研究提供理论基础。
