KAI1通过调节TGF-β1/Smad2信号通路减弱上皮-间充质转化抑制胃癌细胞的侵袭和迁移
2023-05-05张嫄怡李春鸣
张嫄怡,李春鸣,张 霞,梁 娜
(1.肇庆医学高等专科学校 病理学与病理生理学教研室,广东 肇庆 526020;2.遵义医科大学附属医院 病理科,贵州 遵义 563000;3.遵义医科大学 组织胚胎学教研室,贵州 遵义 563099)
胃癌是全世界最常见的恶性肿瘤之一,也是癌症相关死亡的第三大原因,在中国每年约有40万新发病例,占全球病例的40 %[1]。尽管当前胃癌的发病率和死亡率趋势有所下降[2],但该病的预后仍然是所有实体器官肿瘤中最差的,主要是因为大多数确诊病例处于晚期,具有广泛的转移和高复发性[3]。
上皮-间充质转化(epithelial-mesenchymal transition,EMT)是上皮细胞失去上皮特征(如根尖-基底极性和细胞之间粘附)并获得间充质特征(如侵袭性、运动性和抗细胞死亡)的过程[4]。EMT的过程不仅可以由细胞内致癌分子或致癌因子启动,还可以由许多细胞外因子触发细胞内信号事件,转化生长因子β(transforming growth factor-β,TGF-β)为其中之一[5]。TGF-β属于TGF超家族,TGF-β信号通路在多种肿瘤生物学行为中发挥关键作用,包括肿瘤细胞的生长、凋亡、分化、迁移、侵袭和黏附[6-7]。有研究表明,与健康对照组相比,TGF-β1在胃癌患者的黏膜、血清和组织中的表达增强,TGF-β1水平升高能促进胃癌转移,引发复发性胃癌[8]。TGF-β/Smad信号通路可以通过调节E-钙黏蛋白 (E-cadherin)转录因子的表达来诱导细胞发生EMT[9]。
KAI1位于人类染色体11p11.2上,与CD82 完全相同,属于跨膜超4家族的成员,KAI1可以调节细胞的信号转导并参与细胞复制中多个关键环节,比如细胞的融合、迁移、受精、分化和侵袭[10-11]。越来越多的研究表明KAI1表达的降低或丢失与胃癌的转移有关[12-13]。虽然过表达KAI1能显著降低胃癌细胞的侵袭和转移能力,但是KAI1在胃癌细胞发生EMT时所发挥的作用和潜在的机制尚不明朗。本研究通过观察过表达KAI1对TGF-β1/Smad2信号通路及胃癌细胞侵袭、迁移的影响,探讨其在胃癌发生发展中的可能作用机制。
1 材料与方法
1.1 材料
人胃癌SGC-7901细胞株(中国科学院上海细胞库);慢病毒包装(上海吉满生物公司);胰蛋白酶和DMEM培养基(美国Gibco公司);Trizol试剂盒,qPCR试剂盒(上海翊圣公司);ECL化学发光试剂盒(美国Immobilon公司);结晶紫(上海TCI公司);TGF-β1、E-cadherin抗体、Vimentin抗体(美国Abcam公司);CD82/KAI1抗体(美国Santa Cruz公司);超微量紫外线可见分光光度计(杭州遂真公司);荧光定量PCR仪(美国Bioer公司);倒置显微镜(日本Olympus公司);Transwell小室(美国Corning公司);Tanon 4600系列全自动化学发光/荧光图像分析系统(上海Tanon公司)。
1.2 方法
1.2.1 细胞的培养 人胃癌SGC-7901细胞培养于DMEM培养基中,含10 %胎牛血清,1 %青-链霉素混合液,置于培养箱中进行培养。
1.2.2 细胞的分组和转染 将对数生长期的SGC-7901细胞分为转染PGMLV-CMV-H_CD82(KAI1)-PGK-Puro的KAI1组,转染空病毒PGMLV-CMV- MCS-PGK-Puro的NC组,不转染病毒的Control组。将3 组SGC-7901细胞按照2×105/细胞接种于24孔板,至细胞达50 %时开始转染。用400 μL完全培养基按MOI=300稀释病毒原液,将250 μL含有慢病毒稀释液的培养基加到KAI1组和NC组细胞中进行感染,感染16 h后更换为500 μL的完全培养基,再添加嘌呤霉素进行筛选,筛选2次,每次2 d,通过qPCR和Western blot验证获得的稳定细胞株。
1.2.3 筛选TGF-β1诱导人胃癌SGC-7901细胞发生EMT的最佳药物浓度与时间 取对数生长期的SGC-7901细胞接种于6孔板中,分别加入浓度为0、2、5、10、20 ng/mL的TGF-β1进行培养,观察在6、12、24、48、72 h时细胞形态的变化。提取不同浓度、不同时间TGF-β1培养细胞的mRNA,用qPCR法检测E-cadherin和Vimentin表达水平。根据细胞形态学变化和E-cadherin、Vimentin表达水平确定发生EMT的最佳药物浓度与时间。用最佳TGF-β1浓度和时间培养KAI1组、NC组和Control组细胞分别为KAI1+TGF-β1组,NC+TGF-β1组和TGF-β1组进行后续实验。
1.2.4 qPCR检测 用Trizol液提取KAI1、NC 和Control 组总RNA,反转录为cDNA,qPCR法检测KAI1表达水平。用相同的方法分别提取浓度0、2、5、10、20 ng/mL的TGF-β1培养6、12、24、48、72 h时人胃癌SGC-7901细胞的总RNA,反转录为cDNA,qPCR检测E-cadherin和Vimentin表达水平。PCR反应条件:95 ℃、10 min;95 ℃、30 s、60 ℃、30 s、72 ℃、1 min,共40个循环。采用2-ΔΔct法计算KAI1表达水平。KAI1上游5'-GATCCTCATTGCCCAGGTGA-3'、下游5'-CCTCGCGACTGCTGTTGTAG-3',E-cadherin上游5'-GAAGGCGGTGGAG-AAGATGAT-3'、下游5'-CGGTCGAGGTCTGTACTGAGGTG-3',Vimentin上游5'-CGACTCCTGACCAAGACCAACA-3'、下游5'-CACATCGTTCCTCCACCACC-3'。
1.2.5 Western blot检测 收集KAI1、NC和Control组细胞,经裂解、离心后收集总蛋白;用同样的方法收集KAI1+TGF-β1组,NC+TGF-β1组和TGF-β1组总蛋白。使用BCA试剂盒检测目标蛋白浓度。将蛋白质转移到硝酸纤维素膜(NC膜)上,脱脂奶粉(5 %)用于封闭,用一抗(4 ℃,隔夜)孵育∶兔抗人KAI1(1∶1 000)、E-caherin(1∶10 000)、Vimentin(1∶5 000)、Smad2(1∶1 000)、p-Smad2(1∶1 000)单克隆抗体。加入二抗(1∶3 000)室温孵育2 h。孵育完成后用TBST溶液洗膜3次,使用Tanon 4600系列全自动化学发光/荧光图像分析系统显影,Image J软件分析蛋白质的相对表达水平。
1.2.6 细胞划痕实验 提前在6孔板上划好3条平行线作为标记。取对数生长期的KAI1+TGF-β1组,NC+TGF-β1组和TGF-β1组细胞调整密度至6×105个/mL,接种到6孔板中,静置20 min后放入培养箱中培养。当6孔板内的细胞密度达90 %时,用100 μL的无菌移液管画出垂直于标记线的划痕,用Image J测量0、24 h划痕宽度并计算划痕愈合率。进行3次重复测定平均值,比较各组细胞迁移率。
1.2.7 Transwell细胞侵袭实验 制备无血清的细胞悬液100 μL,调整密度为1×105ml/l加入Transwell小室上室,而下室加入含30 %胎牛血清的DMEM,将小室放入培养板常规培养24 h。将侵入的细胞用苏木素染色。用PBS液洗掉多余染色,将Transwell小室倒置,取镜下5个视野计数,取平均值算出侵袭SGC-7901细胞数。

2 结果
2.1 慢病毒转染后稳定株建立 携带KAI1的重组慢病毒转染人胃癌SGC-7901后,Western blotting检测3组细胞显示KAI1组KAI1蛋白表达量(1.16±0.61)显著高于NC组(0.38±0.20)和Control组(0.37±0.19),差异有统计学意义(P<0.05,图1A)。此外qPCR检测3 组细胞结果显示KAI1组细胞中KAI1mRNA表达水平(11.66±1.03)明显高于NC组(1.08±0.12)和Control组(1.00±0.12),差异有统计学意义(P<0.05,图1B)。Western blotting和qPCR结果均提示KAI1组KAI1基因过表达。
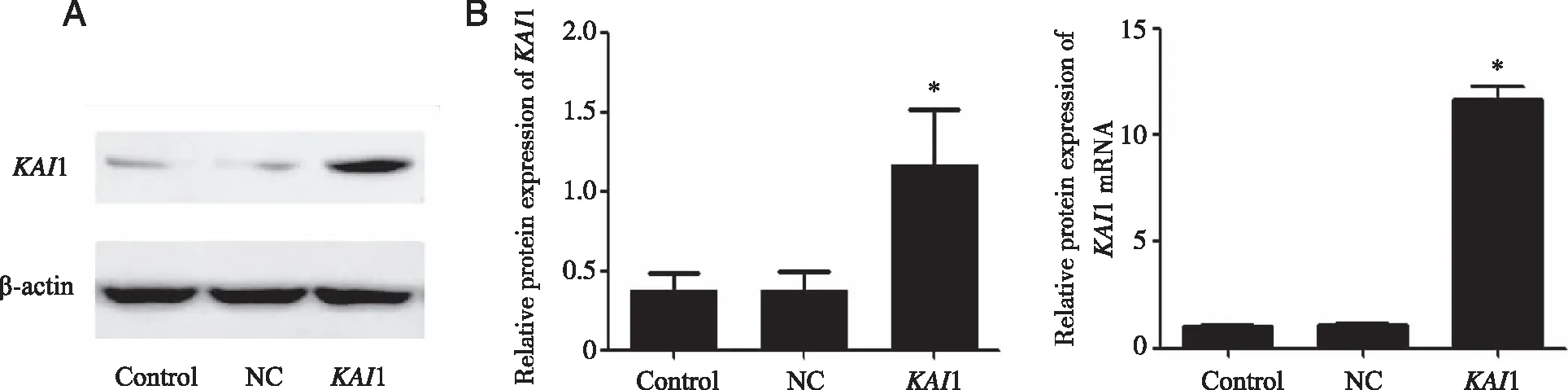
*:与Control和NC组比较,P<0.05。图1 KAI1基因在3 组细胞中表达情况
2.2 TGF-β1培养人胃癌SGC-7901发生EMT最佳时间和浓度 分别用不同浓度、不同时间的TGF-β1培养人胃癌SGC-7901细胞,观察细胞形态时发现,当TGF-β1浓度达到10 ng/mL,培养24 h后可见细胞形态从椭圆形或多角形明显转化为具有凸起结构的成纤维细胞的形状,出现类似于在细胞运动和分裂中的片状伪足(图2A)。增加TGF-β1浓度,延长培养时间细胞形态改变不明显。此外,qPCR检测发现随着TGF-β1培养浓度的增加,时间的延长,E-cadherin蛋白表达逐渐减少,Vimentin蛋白表达逐渐增加。当TGF-β1浓度为10 ng/mL、培养时间为24 h时E-cadherin和Vimentin变化最明显,增大浓度、延长时间改变并不明显(图2B)。因此,后续将 TGF-β1培养人胃癌SGC-7901发生EMT的浓度定为10 ng/mL,时间定为24 h。

A:10 ng/mL的TGF-β1培养SGC-7901细胞24 h时细胞形态的改变(×100);B:qPCR法检测不同浓度TGF-β1培养SGC-7901细胞24 h时E-cadherin和Vimentin的mRNA表达情况。图2 TGF-β1培养SGC-7901细胞的形态及相关蛋白的表达情况
2.3 TGF-β1诱导后各组人胃癌SGC-7901形态学改变 显微镜观察发现NC+TGF-β1组和TGF-β1组细胞形态改变明显,而KAI1+TGF-β1组细胞形态没有出现明显的伪足等结构(图3)。

a:NC+TGF-β1;b:TGF-β1; c:KAI1+TGF-β1。 图3 各组细胞EMT样形态学比较(×100)
2.4 TGF-β1诱导各组人胃癌SGC-7901发生侵袭和迁移细胞数 划痕操作后继续培养3 组细胞24 h,通过显微镜观察发现KAI1+TGF-β1组划痕的宽度较NC+TGF-β1和TGF-β1组大(图4A);计算各组细胞迁移率,发现KAI1+TGF-β1组迁移率(0.49±0.08)小于NC+TGF-β1(0.84±0.06)和TGF-β1组(0.77±0.19),结果有统计学意义(P<0.05,图4B)。通过Transwell细胞侵袭实验发现KAI1+TGF-β1组侵袭细胞数量(24.33±1.53)明显少于NC+TGF-β1(47.00±11.27)和TGF-β1组(55.33±12.06),结果有统计学意义(P<0.05,图5)。
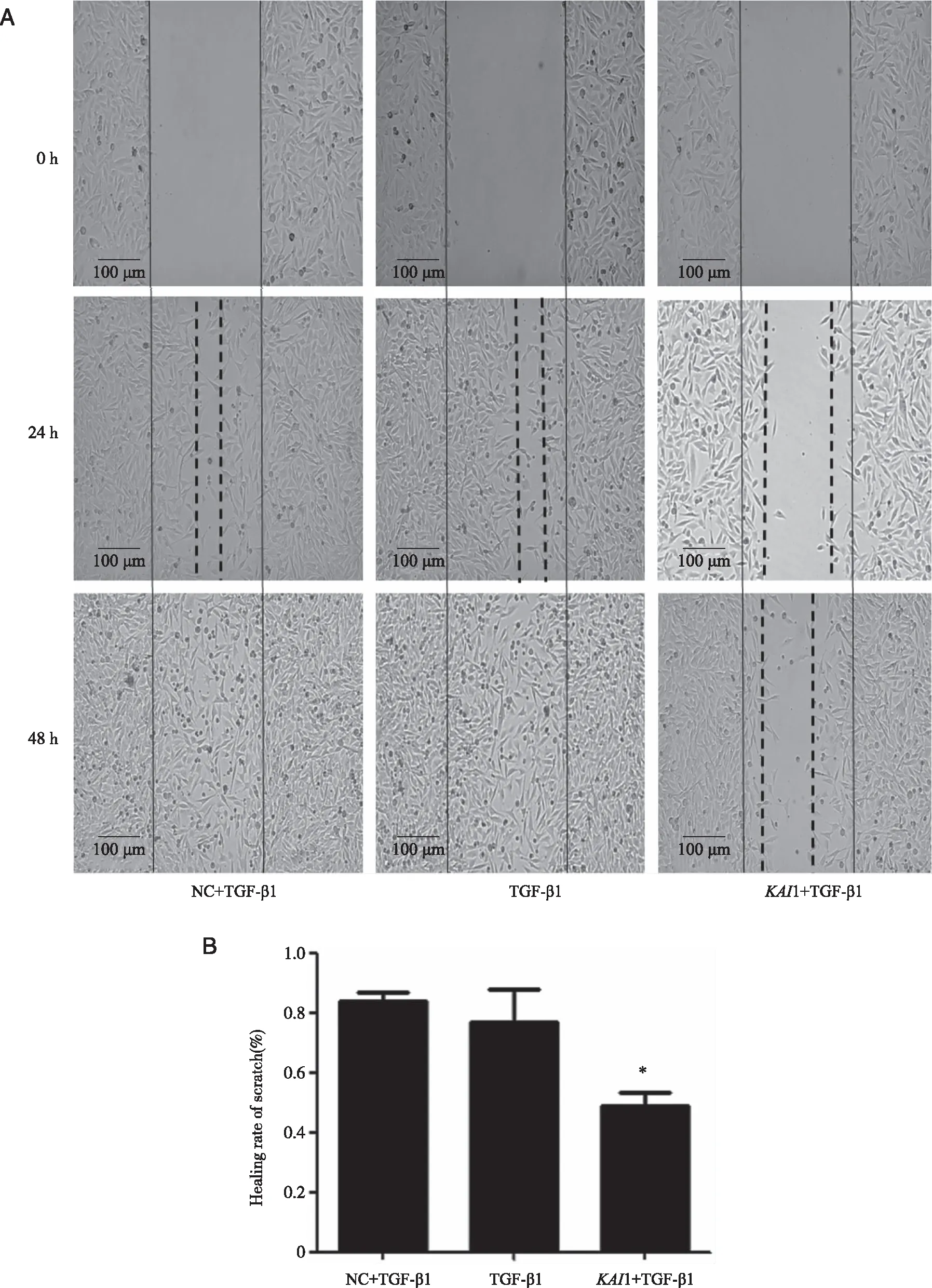
*:与NC+TGF-β1和TGF-β1组比较,P<0.05;×100。图4 细胞划痕检测各组细胞迁移情况
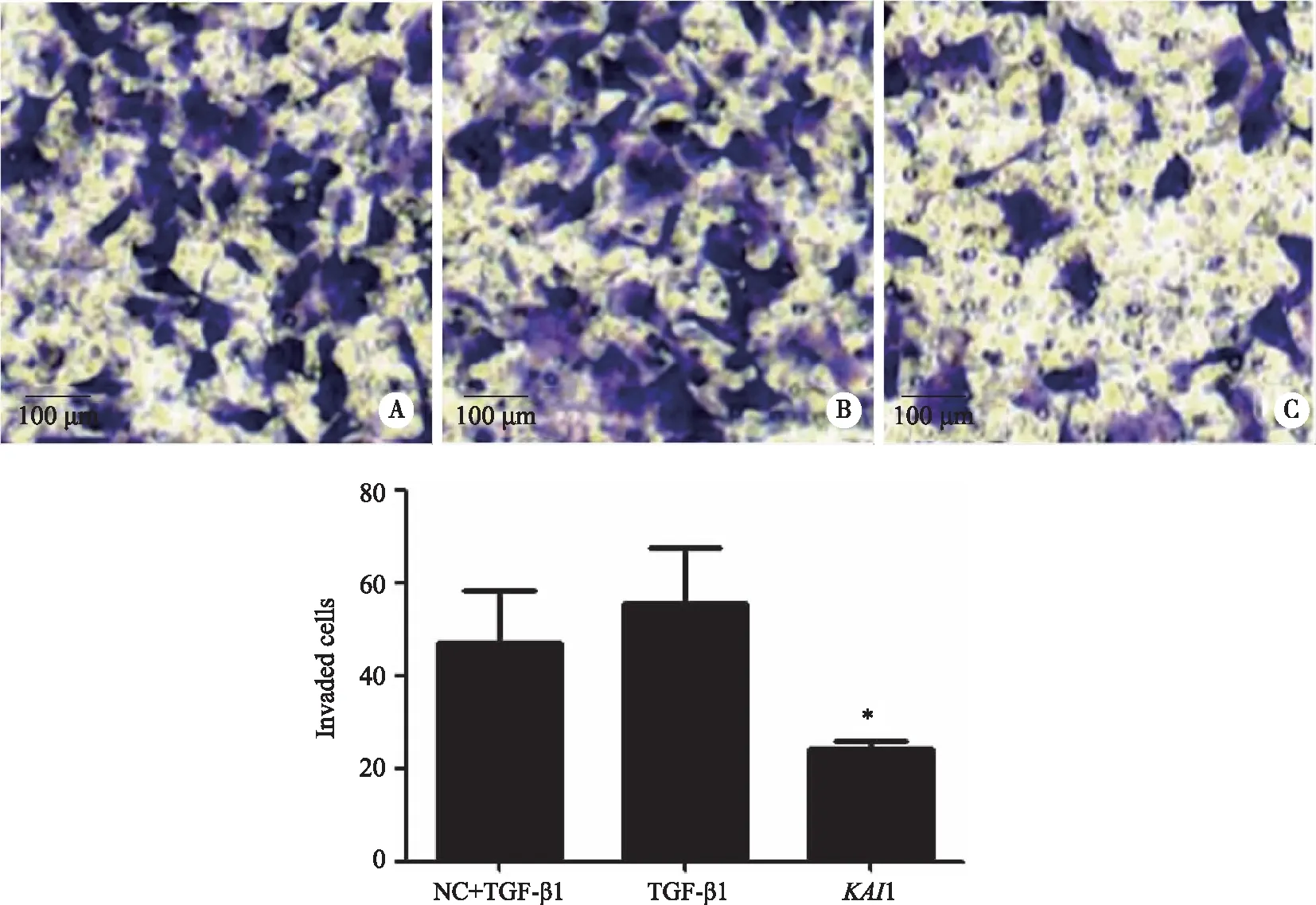
*:与NC+TGF-β1和TGF-β1组比较,P<0.05;×100。图5 Transwell侵袭实验检测各组细胞侵袭情况
2.5 TGF-β1诱导后各组人胃癌SGC-7901中E-cadherin、Vimentin、Smad2和p-Smad2蛋白表达水平KAI1+TGF-β1组E-cadherin蛋白表达水平(0.90±0.16)明显高于NC+TGF-β1组(0.55±0.07)和TGF-β1组(0.57±0.04);KAI1+TGF-β1组Vimentin蛋白表达水平(0.76±0.07)明显低于NC+TGF-β1组(1.20±0.08)和TGF-β1组(1.10±0.17),结果有统计学意义(P<0.05)。KAI1+TGF-β1组Smad2蛋白表达水平(0.75±0.13)和p-Smad2蛋白表达水平(0.36±0.10)明显低于NC+TGF-β1(1.37±0.32)、(0.96±0.29)和TGF-β1组(1.25±0.20)、(0.77±0.12),结果有统计学意义(P<0.05,图6)。
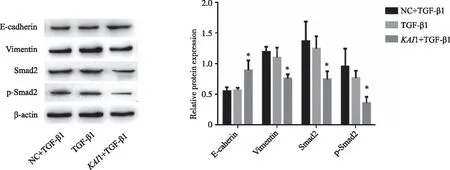
*:与NC+TGF-β1和TGF-β1组比较,P<0.05。图6 Western blot检测各组细胞中E-cadherin、Vimentin、Smad2和p-Smad2蛋白表达水平
3 讨论
胃癌早期时症状隐匿,大多数胃癌患者确诊时已为晚期阶段[14]。临床病理学研究表明KAI1在胃癌组织中低表达,并与胃癌肿瘤分级、淋巴结转移、浸润深度和TNM分期相关[15]。还有研究表明KAI1可以抑制胃癌的迁移,其表达下降与胃癌的转移密切相关[16]。KAI1在胃癌的发生发展中发挥的作用尚不明确。本研究通过转染KAI1,观察其对胃癌细胞发生EMT及TGF-β1/Smad2信号通路的影响,进一步探讨KAI1相关分子机制。
EMT可导致上皮细胞发生多种生物化学改变,例如粘附连接蛋白E-cadherin、ZO-1等上皮标记物的丢失,获得侵袭性间充质表型,如N-cadherin、Vimentin[4]。E-cadherin是一种跨膜糖蛋白,在维持细胞间粘附中起重要作用,作为EMT最重要的标志物之一,可在正常组织和肿瘤组织中发现,E-cadherin的下调使细胞间粘附连接和极性降低,有助于肿瘤细胞侵入周围组织[17]。Vimentin是一种Ⅲ型中间丝蛋白,它在EMT过程中起着重要作用,是发生EMT的癌细胞迁移所必需的[18]。TGF-β1在各种上皮来源的细胞中充当有效的EMT驱动因子,包括胃癌细胞,可以通过Smad介导的转录调节激活TGF-β1诱导的EMT[19]。本研究中发现,人胃癌SGC-7901细胞经过TGF-β1直接处理后,细胞形态由椭圆形或多角形转变为梭形,出现EMT表型,qPCR提示Vimentin mRNA表达升高,E-cadherin mRNA表达明显降低。基于上述改变,本实验利用光镜观察发现过表达KAI1可以减弱TGF-β1导致的胃癌细胞形态改变,与对照组相比,实验组细胞并没有出现明显的伪足等结构;同时细胞划痕和Transwell侵袭实验观察到过表达KAI1可以抑制TGF-β1诱导的胃癌细胞发生的侵袭和迁移。另外,与对照组相比,过表达KAI1逆转了TGF-β1诱导的EMT相关蛋白的表达,E-cadherin表达明显增多,Vimentin表达明显减少;表明KAI1 可以通过抑制TGF-β1诱导的胃癌细胞EMT,从而抑制EMT相关的胃癌细胞侵袭和转移。
KAI1能通过多种信号通路参与恶性肿瘤的发生发展,例如通过下调Wnt通路和上调Hippo通路抑制癌细胞的EMT[20];并通过逆转EMT相关标志物的表达,从而抑制胰腺癌细胞的迁移和侵袭[21]。TGF-β/Smad信号通路的异常与多种肿瘤的发生关系密切,活化的TGF-β调节激活Smad蛋白磷酸化,影响细胞核中基因的转录,最终促成TGF-β1诱导的EMT过程[22]。在多种肿瘤中发现抑制TGF-β1/Smad2信号通路可以逆转肿瘤细胞EMT的表型和转移[7,23]。
综上所述,本研究用Western blot检测Smad2蛋白和磷酸化Smad2蛋白p-Smad2,发现KAI1可以降低TGF-β1诱导的人胃癌SGC-7901细胞Smad2和p-Smad2蛋白的表达。这些结果说明,在TGF-β1/Smad2促使胃癌细胞EMT的发生过程中,过表达KAI1抑制胃癌细胞侵袭和迁移的机制与抑制TGF-β1/Smad2信号通路激活、调节EMT相关因子,从而抑制胃癌细胞EMT有关。
