黄河鲤CFH 基因的克隆、组织表达及对病原类似物的表达响应
2023-05-01赵彤朱雷高园园孔祥会
赵彤,朱雷,高园园,孔祥会
(河南师范大学水产学院,河南 新乡 453007)
补体调节蛋白(Complement regular protein)是在补体激活系统中发挥调节作用的蛋白,主要分为两大类,一类是膜结合性调节蛋白,另一类是可溶性调节蛋白。前者主要包括膜辅因子蛋白、促衰变因子和同种限制因子等[1]。该类蛋白主要分布于组织细胞表面,可有效保护自身组织免受补体介导的过度激活而产生的损伤[2,3]。后者主要包括C1 抑制物(C1INH)、C4 结合蛋白、CFI 蛋白因子和CFH(Complement factor H)蛋白家族等。这类蛋白主要通过调节补体级联激活反应的活性来维持机体稳态。其中,CFH 蛋白家族基因均位于常染色体1q32 的补体激活调控基因簇(Regulator of complement activation,RCA)区域,因此也将CFH 蛋白家族基因称为RCA 家族基因。CFH 蛋白的主要功能是通过3 种方式发挥抑制C3 转化酶的形成,调节补体系统激活。CFH 蛋白分子的功能结构域主要位于C 末端CCP18-20 和N-末端CCP1-4 区域[4,5],其中,C-末端CCP18-20 区域负责识别和结合靶细胞使其免受补体活化产物的攻击。CFH 蛋白N 末端CCP1-4 区域可以通过与C3b 的相互作用抑制C3 转化酶的组装,还可以作为I 因子的辅助因子促进已经形成的C3 转化酶复合物的衰变,因此CFH 蛋白分子的N-末端CCP1-4 区域对于调节补体激活反应发挥至关重要的作用[6]。目前,在分子水平上已经观察到C3b与CFH 的CCP1-4 和CCP19-20 区域结合的晶体结构[7-9],这为CFH 蛋白的功能生物学研究提供了相关的理论依据[10,11]。
近年来,已在人和猪(Susscrofa domestica)等哺乳物种中广泛研究了作为补体系统的重要调节蛋白的CFH 家族蛋白[12]。研究表明:CFH 蛋白不仅可以调节补体系统的激活,在机体免疫反应中也发挥重要作用。人体中CFH 的减少或缺失将会增强引起机体炎症反应及激活补体旁路途径,进一步发生心血管等疾病[13]。CFH 蛋白的突变还是年龄相关性黄斑病变(age-related macular degeneration,AMD)的发病诱因之一[14]。CFH 因子在肾脏相关疾病中也扮演重要角色,CFH 因子突变将会引起肾炎、IgA 肾病等相关肾脏组织炎症反应等[15-18]。近年来研究表明,CFH 蛋白在水产动物对病原感染的免疫响应过程中也发挥重要作用。文昌鱼(Branchiostoma floriaae)CFH 基因广泛表达于不同组织中,经脂多糖(LPS)刺激后其表达水平呈现先上升后下降的变化趋势[19]。斑马鱼(Danio rerio)在受到LPS 刺激后,头肾中CFH 基因的表达水平逐渐上升,并在刺激72 h 后达到峰值[20]。大黄鱼(Larimichthys crocea)经溶藻弧菌(Vibrio alginolyticus)感染后,CFH 基因在肝脏,脾脏和头肾中表达水平均先上升后下降[21]。
黄河鲤(Cyprinus carpio YR)是河南省重要的经济鱼类,随着养殖密度提高,黄河鲤免疫力下降,病害频发,严重威胁黄河鲤养殖业的可持续发展。深入研究黄河鲤免疫防御机制可有效预防和控制病害的发生。为了研究CFH 蛋白在黄河鲤病原感染过程中的作用,本文通过克隆黄河鲤CFH 基因的开放阅读框序列,研究其结构特征、组织分布特点以及对病原感染的免疫响应。
1 材料和方法
1.1 材料
黄河鲤购自河南省焦作市某黄河鲤养殖场,体质量为(20±2)g,实验前暂养一周。暂养期间,水温控制在(20±5)℃,每天换水约1/3。实验前选取行动活泼,体表无明显伤病的个体进行实验。
实验试剂和仪器包括:Trizol、反转录试剂盒、LA Taq 酶、T4 DNA 连接酶购自Takara 公司;琼脂糖购自BIOWEST 公司;实时荧光定量PCR 试剂购自ELK 生物公司;DL2000 DNA Marker、DL 5000 DNA Marker、6×Loading Buffer、DEPC 水和DNA 胶回收试剂盒购自OMEGA 公司;质粒提取试剂购自康为世纪(北京)公司;脂多糖(LPS,L2630)和PolyI:C(127M4085V)购自美国Sigma 公司。
1.2 RNA 提取和cDNA 合成
摘取黄河鲤肝胰脏放入1 mL Trizol 中,充分研磨,冰上静置5 min。加入200 μL 氯仿,震荡后放置5 min。12 000 r/min,离心15 min,吸取上清至新的离心管中。加入300 μL 异丙醇,混匀,室温静置25 min。12 000 r/min,离心10 min,离心后弃去上清,缓慢加入1 mL75%的酒精,清洗沉淀。4℃,12 000 r/min,离心3 min 后,倾倒上清。加入30 μL ddH2O溶解,使用Nanodrop 2000(美国赛默飞世尔)测定RNA 质量和浓度后,以1 μg 黄河鲤肝胰脏总RNA作为模板,使用反转录试剂盒(购自大连Takara 公司)合成cDNA 第一条链,并保存于-80℃备用。
1.3 目的基因的扩增
根据NCBI 数据库中黄河鲤CFH 基因片段(Genebank 登录号:LOC109046644),使用primer 5.0软件设计特异性引物(表1)。随后以黄河鲤cDNA为模板,用分三段设计特异性引物扩增CFH 基因序列。扩增结束后,胶回收扩增产物,随后连接、转化,选取阳性克隆将其送至生工生物工程(上海)股份有限公司测序,将测序结果进行拼接获得CFH 基因开放阅读框序列。
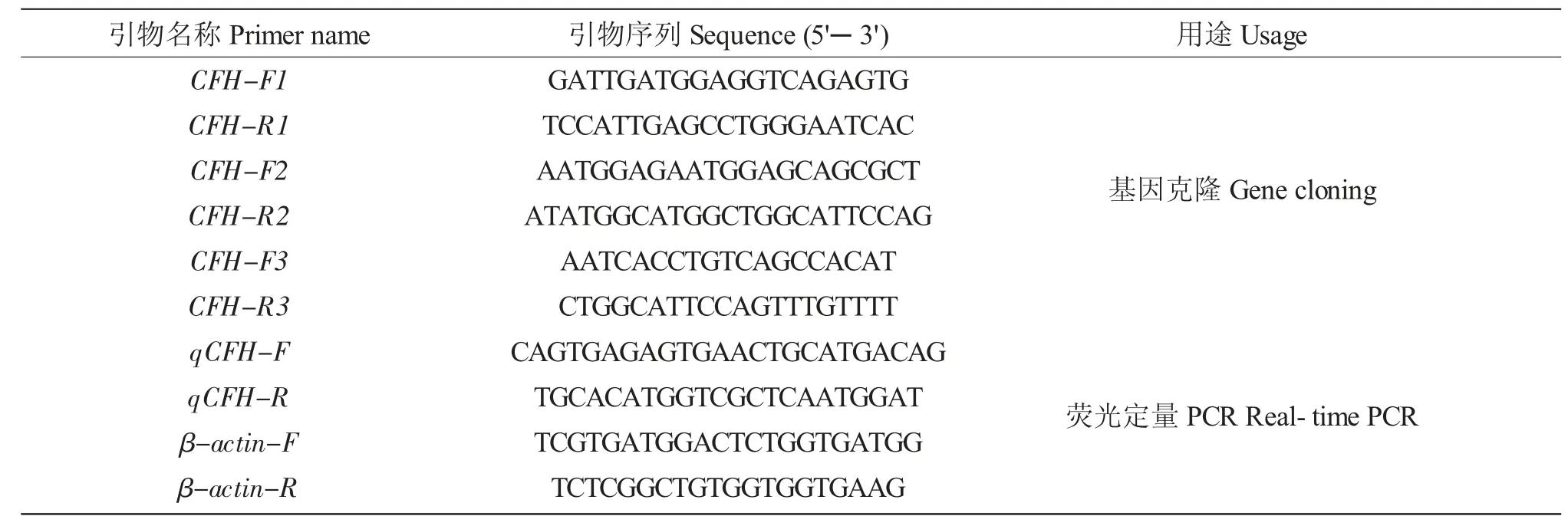
表1 实验所用引物序列Tab.1 Primers used for cDNA cloning in the experiment
1.4 生物信息学分析
使用在线软件SMART(http://smart.emblheidelberg.de/)分析信号肽序列和蛋白结构域;使用在线软件PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)分析蛋白序列二级结构;将蛋白序列经Swiss model(https://swissmodel.expasy.org/)在线软件进行同源建模,之后用蛋白三维结构分析软件预测CcCFH蛋白三维结构模型;使用DNAman 软件对不同硬骨鱼的CcCFH 基因的蛋白序列进行多重序列比对;使用Mega 5.0 构建系统发育树。
1.5 CcCFH 基因组织分布研究
随机选择3 尾健康黄河鲤,无菌条件下取肝脏、脾脏、头肾、鳃、心脏、皮肤、肠和肾等组织,并按照上述方法提取组织中RNA 和反转录成cDNA。使用primer 5.0 软件设计特异性引物,并以β-actin作为内参基因,进行荧光定量PCR 反应。反应体系10 μL:En TurboTM Green PCR Super Mix 5 μL,上下游引物各0.2 μL,cDNA 模板1 μL,ddH2O 3.6 μL。反应程序采用两步法:95℃预变性3 min,95℃5 s,60℃30 s,共40 个循环。使用2-△△CT法计算CcCFH基因相对表达量,使用Excel 2010 软件进行单因素方差分析,显著性水平设为P<0.05。
1.6 CcCFH 基因对病原感染的响应变化分析
选取体表无明显伤病的黄河鲤进行免疫刺激实验。实验分为3 组:LPS 组,每尾鱼从腹腔注射100 μL 浓度为0.2 mg/mL 的LPS 溶液;Poly I:C 组,每尾注射100 μL 浓度为0.2 mg/mL 的Poly I:C 溶液;对照组注,射100 μL 的生理盐水。每组3 个平行,每个平行30 尾鱼。感染后3 h、6 h、12 h、24 h、48 h 和72 h,每组随机挑选3 尾黄河鲤,取脾脏、头肾和体肾等组织,提取RNA 并反转录成cDNA。随后参照上述方法使用RT-qPCR 检测病原类似物(LPS 和PGN)的刺激下,脾脏、头肾和体肾中Cc-CFH 基因的表达水平变化。
2 结果与分析
2.1 CcCFH 基因克隆结果和生物信息学分析
以黄河鲤肝胰脏cDNA 为模板,采用RACE 技术成功获得CcCFH 基因开放阅读框序列。结果显示:CcCFH 基因开放阅读框全长为2 817 bp,编码939 个氨基酸(图1),预测相对分子质量为105.4 KDa,等电点为6.21。CcCFH 蛋白包含一个信号肽和15 个CCP 重复结构域(图2)。二级结构分析结果显示,CcCFH 蛋白主要以β 折叠和无规则卷曲形式存在(图3)。使用Swiss-Model 软件对CcCFH蛋白序列进行三维模型构建,以5o32.1(The structure of Homo sapiens complement complex)为模板,结果显示,CcCFH 蛋白呈现“倒L”形状,由1 个α 螺旋,15 个β 折叠和多个无规则卷曲构成(图4)。

图1 黄河鲤CFH 基因开放阅读框cDNA 序列及氨基酸序列Fig.1 cDNA and deduced amino acid sequence of CFH in Yellow River common carp Cyprinus carpio YR

图2 黄河鲤CFH 基因结构域构成Fig.2 The structure of CFH domain in Yellow River common carp Cyprinus carpio YR

图3 CcCFH 蛋白二级结构分析Fig.3 Secondary structure analysis of CcCFH protein
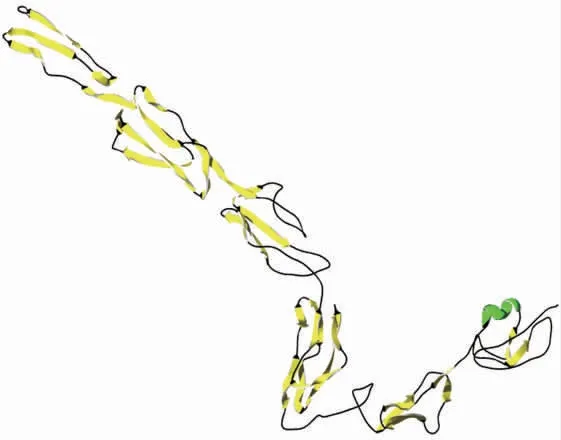
图4 CcCFH 蛋白三维结构分析Fig.4 Three-dimensional structure analysis of CcCFH protein
2.2 CcCFH 序列同源性和系统进化分析
使用MegAlign 软件对黄河鲤CFH 基因开放阅读框进行序列比对。结果显示,该基因编码的氨基酸序列与草鱼(Ctenopharyngodon idella)、鲫(Carassius auratus)、斑马鱼等鲤科鱼类CFH 序列的相似性为45.1%~60.9%,与红鳍东方鲀(Takifugu rubripes)、黄金鲈(Perca flavescens)等非鲤科鱼类CFH 序列相似性为22.2%~23.1%,与人类(Homo sapiens)、小鼠(Mus musculus)、非洲爪蟾(Xenopus laevis)、鸡(Gallus gallus)等CFH 氨基酸序列相似性为17.6%~19.9%(表2)。利用MEGA 5.0 构建系统进化树,结果显示,进化树分为三支,其中鲤科鱼类聚为一支,非鲤科鱼类聚为一支,其他物种聚为一支(图5)。利用DNAman 进行多重序列比对,结果显示黄河鲤CFH 蛋白序列与普通鲤、鲫、草鱼和斑马鱼中的CFH 蛋白序列相似度较高,表明该基因序列具有一定保守性。

表2 黄河鲤CFH 氨基酸序列与其他物种的相似性比较Tab.2 The homology comparisons of the deduced amino acid sequence of CFH in Yellow River common carp Cyprinus carpio YR with other known species
2.3 CcCFH 基因的组织分布
RT-qPCR 方法检测CcCFH 基因在不同组织中的表达水平结果表明,CcCFH 基因在肝脏中表达量最高,皮肤和心脏中次之,肠、鳃、体肾等组织表达水平较低(图6)。
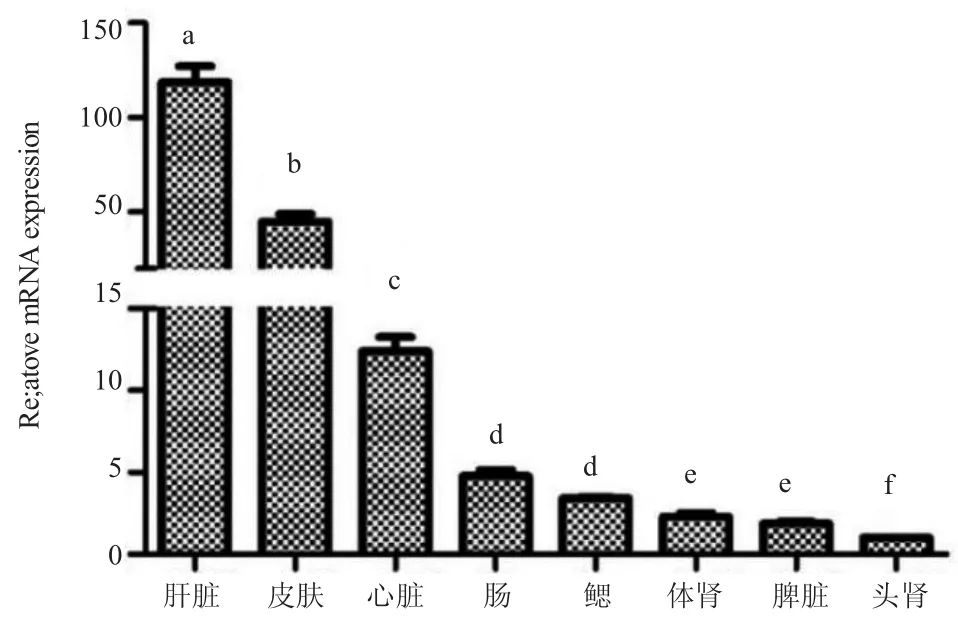
图6 黄河鲤CFH 基因在不同组织的表达水平Fig.6 The expression levels of CFH in different tissues of Yellow River common carp Cyprinus carpio YR
2.4 CcCFH 基因对病原感染的表达响应
脾脏、头肾和体肾在病原类似物感染后不同时间点CcCFH 基因的表达变化结果表明:LPS 刺激后,黄河鲤脾脏中CcCFH 基因总体呈先上升后下降的表达趋势,24 h 表达量出现高峰,随后又显著下降。头肾中CcCFH 基因表达水平出现上升趋势,72 h 时表达水平最高。体肾中CcCFH 基因表达水平在刺激后3 h 表达水平最高,随后逐渐下降。Poly I:C 刺激黄河鲤后,CcCFH 基因在不同组织中的表达水平变化与LPS 刺激后的变化情况基本相同(图7)。
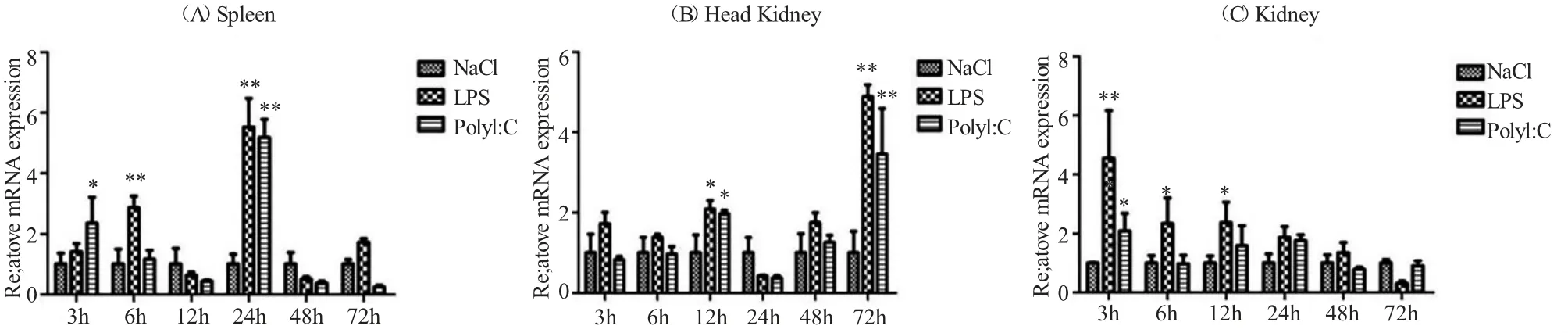
图7 LPS 和PolyI:C 处理后黄河鲤CcCFH 基因表达变化Fig.7 Expression profiles of CcCFH in Yellow River common carp Cyprinus carpio YR exposed to immune stimulation by LPS and PolyI:C
3 讨论
有关鱼类CFH 蛋白的研究起步较晚,但也取得了一些成果,如在沙鲈(Parablax neblifer)中鉴定到具有类似CFH 蛋白分子序列特征的蛋白,命名为补体调节蛋白SBP1,推测沙鲈SBP1 可能是人类和小鼠补体调节蛋白的祖先[22]。Wu 等在斑马鱼基因组中鉴定到ZRC1 和ZRC2 两种补体调节蛋白[23],分别编码膜结合型和可溶性补体调节蛋白,说明该类基因的功能发生了分化。这是首次在鱼类中证实膜结合型调节蛋白的存在,这一结果也将膜结合型补体调节蛋白的起源追溯到有颌脊椎动物鱼类。本实验从黄河鲤基因组中克隆得到一个CFH 基因开放阅读框。对其的多序列比对分析发现,CcCFH 基因与草鱼、鲫和斑马鱼等鲤科鱼类具有一定同源性。系统进化分析显示,CcCFH 氨基酸序列与鱼类聚为一支,亲缘关系较近,哺乳动物CFH 聚为另一支,与CcCFH 亲缘关系较远。CcCFH 蛋白包含一个信号肽和15 个CCP 重复结构域。其中,每个CCP 结构域由约60 个氨基酸残基构成,CCP 结构域氨基酸序列具有高度保守的半胱氨酸、色氨酸和脯氨酸残基,进而使得CCP 区域呈现空间环状结构[5,24-25]。不同物种中CFH 蛋白含有不同数量的CCP 结构域,如斑马鱼中CFH 蛋白含有15 个CCP 结构域[20],而一些哺乳动物中的CFH 蛋白由20 个CCP 结构域组成[26-30]。以上实验结果表明,不同物种CFH 基因有不同的进化水平,并可能和功能差异相关。
组织分布实验结果表明,CcCFH 基因广泛存在于黄河鲤各个组织中,在肝脏中表达水平较高,这与在斑马鱼[20],虹鳟(Oncorhynchus mykiss)[31]和大黄鱼[21]等鱼类的研究结果相似。Cai[19]等系统研究了文昌鱼中CFH 基因的表达模式、病原响应和进化地位,发现CFH 基因在肠、鳃、脊索、肌肉和肝盲肠等多个组织中均有表达,肝盲肠中的CFH 基因表达量较高。CFH 基因也广泛存在虹鳟的不同组织中,在肝脏中的表达水平有较高[22]。这些结果共同表明,肝脏作为免疫因子合成器官可能在防御病原入侵的过程中扮演着重要角色。
本研究中,LPS 和PolyI:C 刺激后,黄河鲤脾脏、头肾和体肾等组织中CcCFH 基因的表达表明:病原类似物刺激后,CcCFH 基因在黄河鲤脾脏、头肾和体肾均表现出明显的表达变化。LPS 刺激后,斑马鱼肾中CFH 基因的表达水平逐渐上升,在刺激的72 h 后达到峰值[20]。溶藻弧菌(Vibrio alginolyticus)感染大黄鱼后,其肝脏,脾脏和头肾中CFH 基因的表达水平均先上升后下降[21]。健康文昌鱼经脂多糖刺激后,CFH 基因表达量先上升后下降[19]。以上实验结果表明,CFH 基因参与了宿主对病原或病原类似物的免疫反应。
近年来,广泛研究了CFH 家族相关蛋白在人、猪和兔(Leporidae)等物种中的情况,CFH 蛋白不仅可作为一类重要的抑制补体系统激活蛋白,而且在抗感染免疫过程中发挥重要作用。有关鱼类CFH 家族蛋白的研究起步较晚,但也取得一些成果。在文昌鱼CFH 基因和大黄鱼CFH 基因的研究中发现,病原类似物及细菌刺激后文昌鱼和大黄鱼组织中CFH 基因出现先上升后下降的表达趋势。以上研究表明,CFH 及其相关蛋白在机体免疫系统中发挥至关重要作用[19,21]。
综上所述,本文克隆得到了黄河鲤CFH 基因开放阅读框全长序列,并分析了其结构特征、组织分布特点以及对病原的响应,实验结果为研究CcCFH基因在黄河鲤免疫防御中的功能奠定基础。现有对CFH 的研究主要集中在哺乳动物CFH,鱼CFH 的相关研究较少,对序列结构分析发现,黄河鲤CFH蛋白在非传统免疫器官肝脏的表达量较高,主要是因为是补体免疫分子的发源器官。但总体来看,对该类调节蛋白抵御细菌感染机制研究较少,可以从结构生物学角度探索鱼类CFH 蛋白质的功能结构域,为深入研究CFH 蛋白在机体免疫防御和调控补体作用等方面提供理论基础。目前研究表明,鱼类CFH 蛋白可参与机体急相反应和抵御病原微生物感染过程。
