异养硝化-好氧反硝化细菌在海水养殖废水脱氮中的研究进展
2023-04-29周鹏刘鹰慕欣廷苏鑫吴英海韩蕊
周鹏 刘鹰 慕欣廷 苏鑫 吴英海 韩蕊


摘要:异养硝化―好氧反硝化(heterotrophic nitrification-aerobic denitrification, HN-AD)脱氮技术可在好氧条件下同步实现硝化/反硝化过程,在海水养殖废水生物脱氮处理中具有巨大应用潜力。梳理海水环境中HN-AD菌的分离筛选研究进展,结合关键功能基因和酶系分析了HN-AD脱氮途径与机制,归纳了碳源、碳氮比、溶解氧、氮源、温度、pH以及新型污染物等主要环境因子对HN-AD菌脱氮效果的影响。今后需进一步通过常规和分子生物学手段获得高效脱氮菌株,借助多组学手段阐明脱氮途径与机制,厘清环境因素影响HN-AD菌的分子生物机制以获得最优工艺参数。
关键词:养殖废水;脱氮菌;生物学机制;环境因子;工艺参数
中图分类号:X55 文献标志码:A 文章编号:1674-3075(2023)06-0148-10
21世纪以来,海水养殖业由早期的粗放式养殖模式逐渐向高密度、集约化方向转变(张志强等,2020)。在新型海水养殖系统中,氮浓度控制对于养殖生物和环境保护尤为重要(Huang et al,2020;马洪婧等,2022)。现有氮去除工艺几乎均依托传统的生物脱氮理论,即氨氮(NH4+-N)在好氧条件自养硝化细菌作用下先生成亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N),接着在缺氧或兼性厌氧条件下进行反硝化将氮从水体中去除(Yan et al,2022)。由于硝化和反硝化2个过程对有机底物和溶解氧(DO)的需求截然不同,除氮必须分段进行,工艺操作复杂,反应耗时且成本高(Zhang et al,2017)。
异养硝化―好氧反硝化(heterotrophic nitrification-aerobic denitrification, HN-AD)菌是近年来发现的新型生物脱氮菌,可在单一反应器内有氧条件下利用有机碳实现同步硝化/反硝化过程,将NH4+-N转化为含氮气体排出,且几乎没有中间产物积累,成为生物脱氮领域的研究热点(Chen & Ni,2011;Chen et al,2016)。HN-AD菌为高DO的水产养殖水体在有氧条件下有效脱氮提供了一种崭新的思路。苏兆鹏等(2021)从海水养殖水体中分离出1株HN-AD菌Halomonas sp. GJWA3,该菌株分别以NH4+-N、NO2--N和NO3--N为唯一氮源,48 h氮去除率分别为96.44%、99.42%和78.27%,氮平衡结果表明该菌株能够去除水体中大部分无机氮。成钰等(2016)从刺参养殖环境中分离筛选出1株具有较强HN-AD能力的花津滩芽孢杆菌(Bacillus hwajinpoensis)SLWX2,24 h对NH4+-N、NO2--N和NO3--N的去除率分别达到100%、99.5%和85.6%。HN-AD菌在海水养殖废水脱氮处理中展现出巨大的应用潜力。
盐度可以抑制脱氮菌的酶活性并影响其生长代谢(Li et al,2018),导致菌株脱氮能力下降,来自淡水等环境的菌株处理海水等高盐度废水无法有效发挥作用(Uygur & Kargi,2004;Duan et al,2015)。目前,关于海水HN-AD菌的研究逐渐增多(Liu et al,2019;Zhao et al,2019;Zhang et al,2020a),但该类菌系统性的综述研究鲜见报道。本文从海水HN-AD菌的分离筛选、脱氮途径及机制、脱氮影响因素等方面评述近年研究成果,并对今后研究方向进行展望,以期为海水养殖水处理工程实际应用提供参考。
1 海水环境中HN-AD菌的分离筛选
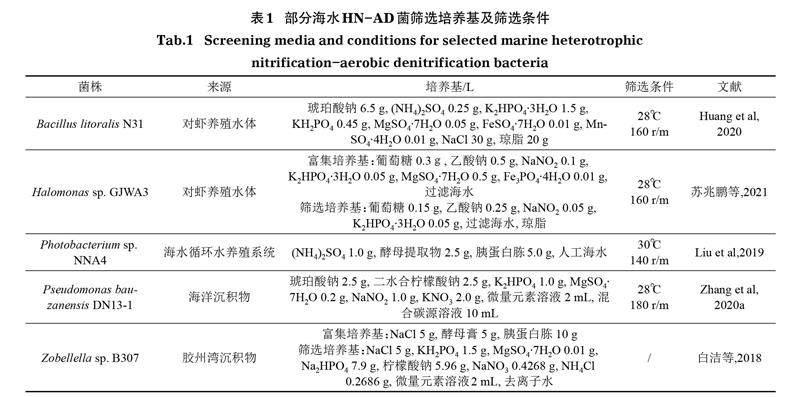
目前,对HN-AD菌的研究还处于实验室阶段,虽然一些菌株在反应器中表现出良好的脱氮效果,但尚未达到实际应用水平,主要原因是缺乏有效的菌株资源(Song et al,2021)。人工及自然环境中均能分离得到HN-AD菌,除少数归类为真菌外,大多为细菌(Yao et al,2020)。近年来,研究人员利用不同培养基并在不同筛选条件下不断从海水环境中分离出HN-AD菌株,已发现的有盐单胞菌属Halomonas sp.(苏兆鹏等,2021)、假单胞菌属Pseudomonas sp.(Zhang et al,2020a)、海洋杆菌属Marinobacter sp.(Zheng et al,2012)、芽孢杆菌属Bacillus sp.(Barman et al,2017)、发光杆菌属Photobacterium sp.(Liu et al,2019)、克雷伯氏菌属Klebsiella sp.(孙庆花等,2016)、弧菌属Vibrio sp.(Duan et al,2015)、节杆菌属Arthrobacter sp.(Zhang et al,2020b)、卓贝尔氏菌属Zobellella sp.(白洁等,2018)、副球菌属Paracoccus sp.(Zhang et al,2015)等。这些菌大多为革兰氏阴性菌,也有少数为革兰氏阳性菌(成钰等,2016;Zhang et al,2020b)。培养基的成分主要包括无机铵盐、亚硝酸盐或者硝酸盐、碳源以及微量元素等,表1列出了部分培养基成分及筛选条件。Yao等(2013)发现使用添加硝酸盐的培养基可以有效富集好氧反硝化菌。由于反硝化过程产碱,可以使用添加溴百里酚蓝(bromothymol blue,BTB)的固体培养基,对遇碱变蓝色的菌株进行初筛(Chen et al,2016)。另外,HN-AD菌在好氧条件下可同时利用O2和NO3-,在厌氧条件下可利用NO3-作为电子受体。根据这一特征,采用间歇曝气法频繁切换好氧、厌氧环境有利于其成为优势菌种,提高筛选效率(Huang et al,2013)。目前,尝试从不同环境介质、使用不同培养基和筛选方法得到高性能HN-AD菌是主要的研究方向。
2 HN-AD菌脱氮途径、机制及相关酶
HN-AD菌的不确定代谢机制也限制了其实际应用。HN-AD菌种属繁多,不同菌株脱氮过程的催化酶系及其编码基因各不相同,氮代谢过程复杂,环境条件也会影响菌株脱氮性能(Song et al,2021),再加上目前研究方法的局限性,导致对其脱氮途径和机制尚不十分清晰,这也是HN-AD菌基础研究和应用面临的主要挑战(Yan et al,2022)。
2.1 氮代谢途径
大多数研究是通过HN-AD菌的代谢产物、菌株生长来推测脱氮途径。HN-AD菌可通过同化作用将无机氮(NH4+-N、NO2--N、NO3--N)转化为生长所必需的细胞内氮(生物量氮),以及通过异化作用将无机氮转化为含氮气体(NO、N2O、N2)(Zhang et al,2020a ;Cao et al,2022),通过研究氮平衡来推测同化与异化作用对脱氮的贡献率。
同化作用对脱氮的贡献不可忽视(图1)。Zhang等(2020a)从海洋沉积物分离的Pseudomonas bauzanensis DN13-1在以NO3--N为唯一氮源脱氮过程中,发现有39.38%的总氮(TN)被转化为细胞内氮,21.88%的TN可能被转化为气态氮从培养基中脱除;比起异化作用,DN13-1更多地利用同化作用来转化无机氮。Duan等(2015)分离的Vibrio diabolicus SF16,氮平衡表明有35.83% NH4+-N转化为生物量氮。而H. GJWA3在不同氮源培养基中将无机氮转化为气态氮的比例均高于对氮的同化率,说明H. GJWA3具有显著的反硝化能力(苏兆鹏等,2021)。细菌死亡后分解产生新的含氮化合物(He et al,2016),这些生物量氮又回到环境中,可能导致脱氮效果受到影响。Huang等(2020)用初始浓度20 mg/L的NH4+-N作为唯一氮源,混合培养25株分离自海水养虾池的HN-AD菌群,8~32 h期间,因死亡细胞的分解,NH4+-N浓度从7.0 mg/L上升到9.0 mg/L。可见,分离筛选出合成气态氮转化率高而生物量氮少的菌株可能更有益于提高总氮的去除率。但Hu等(2014)认为,这些生物量氮可以丰富养殖动物的食物蛋白源,并以此减少含氮温室气体的排放。
异化作用中HN-AD菌将无机氮转化为气态氮而脱除,对水处理反应器脱氮起主要作用(图1)。目前普遍接受的脱氮途径有2个:①完全HN-AD通路(Kuenen & Robertson,1994;Richardson et al,1998);②羟胺氧化通路(Liu et al,2019;Yan et al,2022)。此外,HN-AD过程还会伴随短程硝化―反硝化、厌氧氨氧化、硝酸盐异化还原为铵等,需要进行全面和深入的研究。
通路①中,在好氧条件下,NH4+-N经硝化过程转化为NO2--N、NO3--N后,再经反硝化过程将NO3--N转化为含氮气体。反硝化过程中有机碳作为电子供体,NO3-(NO2-)和O2可同时作为电子受体(Huang et al,2013),菌株通过电子传递过程获得能量。Zhang等(2020b)从海水养殖系统分离出Arthrobacter sp. HHEP5,利用基因组DNA为模板,成功扩增出基因amoA、hao、napA、narG、nirS、nosZ,并结合菌株的脱氮性能提出HHEP5的脱氮途径遵循通路①。白洁等(2018)从胶州湾海底沉积物中分离到的Zobellella sp. B307,通过代谢产物的变化推测其脱氮途径遵循通路①。通路①解决了传统硝化/反硝化因为碳源、氧气需求的差异不能在同一空间进行的问题。对于富氧的水产养殖水处理具有巨大优势。但是如何稳定反应过程,避免中间产物积累还需要深入探索。
通路②中NH4+-N氧化为羟胺后被直接转化为含氮气体。Liu等(2019)从海水循环水养殖系统分离的Photobacterium sp. NNA4在好氧条件下羟胺氧化还原酶(hydroxylamine oxidoreductase,HAO)比活力为0.009 U/mg,可耐受10 mmol/L羟胺,并可高效地将羟胺直接转化为N2O。菌株y6(王骁静等,2017)以NH4Cl为唯一碳源脱氮过程中,没有NO2--N和NO3--N的积累,推测遵循通路②。该通路优点是不产生NO3--N以及对水产动物毒害较大的NO2--N,可提升反应效率且不需要外源碳从而降低运行成本(Yan et al,2022)。羟胺是硝化过程的关键中间产物,对微生物具有毒害作用(Ouyang et al,2020),快速去除羟胺对于提高脱氮效率有重要意义。
2.2 氮代谢相关酶
随着分子生物学技术的发展,在基因水平研究HN-AD过程中涉及到的相关酶学及分子生物学也成为近年来研究的热点之一。已发现的HN-AD菌脱氮过程可能涉及的酶主要有:氨单加氧酶AMO、羟胺氧化还原酶HAO、丙酮肟双加氧酶POD、亚硝酸盐氧化还原酶NXR、硝酸盐还原酶NAP/NAR、亚硝酸盐还原酶NIR、一氧化氮还原酶NOR、一氧化二氮还原酶NOS等(Tsujino et al,2017;Liu et al,2018;Holmes et al,2019;Song et al,2021;Xi et al,2022)。
AMO(amo基因编码)催化游离氨转化为羟胺(Mevel & Prieur,2000),是硝化过程的第一步也是重要的一步,amo被认为是好氧氨氧化的标志基因(Dionisi et al,2002)。HAO(hao基因编码)是1种具有多种催化功能的酶,除了可以将羟胺转化成亚硝酸盐,近年的研究表明,其也与羟胺转化为NO、N2O密切相关(Holmes et al,2019;Liu et al,2019)。POD(pod基因编码)是羟胺转化为亚硝酸盐的另一种酶(Tsujino et al,2017),探究羟胺氧化途径时通常对这2种酶进行研究。NAP(nap基因编码)和NAR(nar基因编码)是可以将NO3--N还原为NO2--N的2种酶。在好氧条件下,nap占主导地位,nar受到抑制(Holmes et al,2019)。NIR(nirS、nirK基因编码)可催化NO2--N还原为NO,nirS和nirK通常不同时存在于同一菌株。有研究发现,与nirK相比,nirS在反硝化过程中发挥的作用更大(Sun et al,2018),特别在水产养殖中,亚硝酸盐对养殖动物毒害比较严重,研究NO2--N的转化意义重大。NOR(nor基因编码)可催化NO还原为N2O,NOS(nos基因编码)可催化N2O还原为N2。其中,NOR活性较强,NO不容易积累(Fujiwara & Fukumori,1996),而NOS对氧气敏感,DO的控制对于温室气体N2O的转化至关重要(Matsuzaka et al,2003)。HN-AD过程中酶的活性(基因表达)通常是通过添加特定的氮底物来测定,而这种分析方法并不适用于不确定特性或未知的酶(基因)(Xi et al,2022)。
虽然HN-AD菌在有氧条件下有许多共同的性状,但由于其系统发育的多样性和生理上的差异,它们在污水处理中的功能尚不明晰(Xi et al,2022)。总结现有研究发现,对于HN-AD过程的分子生物学研究主要集中在代谢相关酶和基因的功能及结构方面,关于细胞内电子传递机制、酶分子动力学等方面的研究极为有限。到目前为止,还没有1株HN-AD菌可以通过多组学方法解读普遍的分子信息(Xi et al,2022)。大多研究通过传统分子生物学方法,如聚合酶链式反应(PCR)来确定细菌种类和脱氮基因,但PCR不能全面反映氮转化过程中的微生物结构和功能的变化(Yang et al,2021)。另外,HN-AD过程有些功能基因或同源基因仍然未知(Zhang et al,2020a)。未来,应通过基因组学、转录组学、蛋白组学、代谢组学以及同位素技术的联合分析,全面解读HN-AD菌脱氮途径和机理。
3 HN-AD脱氮的影响因素
适合的生长条件是水处理微生物发挥作用的重要因素。为了获得适合实际应用的菌株,需要探索HN-AD菌生长和代谢的影响因素。碳源、碳氮比(C/N)、溶解氧(DO)、温度、氮源和pH是HN-AD菌的主要影响因素(表2)。
3.1 碳源
脱氮过程中,有机碳源为HN-AD菌提供必需的能源和反硝化反应的电子,是HN-AD过程必不可少的关键因素。碳源的类型和含量都会对HN-AD速率产生显著的影响(Obaja et al,2005)。
3.1.1 碳源类型 目前,常用的碳源多为可溶性碳源,如葡萄糖(Barman et al,2017)、琥珀酸钠(Liu et al,2019)、柠檬酸钠(王骁静等,2017)、乙酸钠(Pan et al,2020)等。HN-AD菌作为异养菌,必须依赖有机碳进行细胞大分子的生物合成和能量生产(Xia et al,2020)。王骁静等(2017)等从胶州湾海底沉积物中分离筛选出1株克雷伯氏菌属(Klebsiella sp.)y6,使用琥珀酸钠、柠檬酸钠为唯一碳源时NH4+-N去除率都高于92%。菌株V. SF16(Duan et al,2015)使用乙酸钠、葡萄糖、琥珀酸钠、蔗糖为唯一碳源,NH4+-N去除率均在88%以上,使用柠檬酸钠时NH4+-N去除率只有40%左右,而柠檬酸钠却是Klebsiella sp.y5(孙庆花等,2016)的最适碳源。琥珀酸钠、柠檬酸钠等分子量小、化学结构简单易于菌株利用(Xia et al,2020)。也有报道,琥珀酸、柠檬酸是三羧酸的中间体,可直接进入三羧酸循环供微生物利用(Borrero-de et al,2017;Xia et al,2020)。葡萄糖可支持芽孢杆菌属(Bacillus sp.)高效脱氮(Zhao et al,2019),可见,不同菌株对碳源有不同的偏好。
碳源投加不足会导致脱氮不彻底,而投加过量会造成出水COD(chemical oxygen demand,化学需氧量)过高等二次污染。因此,需要复杂的检测和控制系统。此外,一些液态碳源,如甲醇、乙醇,由于其毒性和可燃性,在储存、运输和使用过程中会带来安全风险(Zhang et al,2017)。相比之下,生物可降解聚合物(Biodegradable Polymers,BDPs)可同时作为细菌生长的载体和碳源,具有释碳稳定、无需反复添加、易于控制等优点,在近几年吸引了大量学者的关注(Lopardo & Urakawa,2019),但因其经济成本高等原因还处在实验室研究阶段。目前,寻找适用于海水养殖污水处理的经济有效、稳定缓释的碳源是HN-AD方法应用于水产养殖面临的巨大挑战。
3.1.2 碳氮比 针对发现的新HN-AD菌,研究碳氮比(C/N)对脱氮性能的影响十分重要。C/N过低,菌株因营养供应不足生长会受到抑制(Yang et al,2019a),同时,因缺乏电子供体而导致反硝化不彻底(Zhao et al,2010);C/N过高也会抑制脱氮速率、造成出水二次污染且浪费资源(Xia et al,2020)。应根据菌株生理生态特征和环境因素选择适当的C/N。从目前海水HN-AD的研究结果来看,大多数菌株的最适C/N在10以上,只有少数菌株在10以下(表2)。菌株V. SF16在C/N为10时NH4+-N去除率达到最大值93%。菌株H. GJWA3(苏兆鹏等,2021)利用葡萄糖作为碳源,C/N大于10 时,NH4+-N和NO2--N的去除率接近100%。而随着C/N从10逐渐降低,氮的去除率也呈现不断下降的趋势,当C/N为0时,菌株对NH4+-N和NO2--N的去除率也降为0。Huang等(2017)从对虾海水养殖池塘分离出的海滨芽孢杆菌(Bacillus litoralis) N31,使用乙酸钠为碳源,C/N为5~20时NH4+-N去除率均稳定保持在90%左右,相比于H. GJWA3(苏兆鹏等,2021)具有更宽泛的C/N耐受性。
然而,水产养殖水体C/N较低,通常只有2~3(Schneider et al,2006),不足以维持HN-AD过程,碳源不足是导致海水养殖废水脱氮不彻底的主要原因(郑冰冰等,2020)。额外添加碳源会增加水处理的成本,筛选或驯化出低C/N的HN-AD菌是生物脱氮的一个重要方向。
3.2 溶解氧
溶解氧(DO)是影响HN-AD的又一个重要因素。水产养殖用水通常具有较高DO浓度,HN-AD菌虽然具有一定的DO耐受性,但亚硝酸盐还原酶对O2敏感,高浓度DO可能会导致亚硝酸盐的积累(K?rner & Zumft,1989);低浓度DO又抑制菌株的快速生长,导致NH4+-N的去除受到影响。因此,DO浓度的高低对HN-AD脱氮效果至关重要(Zhao et al,2019)。
段金明等(2019)将海洋菌株(Vibrio diabolicus)SF1接种到曝气生物滤池中,随着DO浓度的升高,NH4+-N去除率呈增强趋势,当DO浓度为4~5 mg/L时,NH4+-N去除率达到最高99%,但再提高DO浓度时,NH4+-N去除率开始下降,同时NO2--N、NO3--N积累量上升,推测原因可能是过高的DO浓度抑制了脱氮酶的合成和活性。与此不同,也有菌株耐受高浓度DO,Zhao等(2019)从养虾池分离的Bacillus subtilis H1是1株典型的好氧菌,在DO饱和度为91.1%(6.65 mg/L)接近饱和水平时,NH4+-N和NO2--N的去除率都达到最高90%左右。由此可见,不同HN-AD菌对DO的适应性不尽相同,即使同一菌株在不同DO水平下的脱氮能力也可能有所差异。确定菌株最适DO是基础研究和未来应用的重要前提。
3.3 温度
大多数HN-AD菌对温度敏感,在一定的温度范围内,温度升高,菌株生长和脱氮能力会显著提高(Ren et al,2014)。而在高温或低温条件下,它们的生长和代谢会受到明显的抑制(Song et al,2021)。P. NNA4(Liu et al,2019)最适温度范围为30~37℃。当温度从16℃上升到30℃时, NH4+-N去除率和菌株生长都显著上升,而当温度进一步从37℃增加到45℃时, NH4+-N浓度从50 mg/L急剧上升到160 mg/L,细胞光密度(OD600)从1.6几乎下降到0。GJWA3对高温具有很好的耐受性,40℃时,NH4+-N和NO2--N的去除率仍高于70%。对于一般的HN-AD菌,最适温度范围为28~37℃(何环等,2017),已发现的海洋HN-AD菌也基本位于这个范围(表2)。水产养殖中,考虑到低温季节和冷水鱼的需要,嗜冷HN-AD菌的筛选尤为重要。
3.4 氮源
作为反应底物,氮源的种类和含量也会影响HN-AD菌株生长和脱氮效果(Song et al,2021)。Huang等(2017)在考察菌株B.N31的硝化速率与NH4+-N初始浓度关系时发现,硝化速率随NH4+-N初始浓度(10~250 mg/L)的增加而增加。可能原因是硝化反应酶需要足够的NH4+-N含量进行激活,较低浓度的氮不能保证HN-AD菌的脱氮效果(苏兆鹏等,2021)。混合氮源中,HN-AD菌往往优先利用NH4+-N(Huang et al,2017)。孙庆花等(2016)从海底沉积物中分离的Klebsiella sp.y5,分别以NH4+-N、NO2--N、NO3--N为唯一氮源时,36 h的氮去除率分别为77.07%、64.14%和100%。而将3种氮源混合时,36 h的总氮去除率达到100%。这个结果与B307类似,B307在混合氮源中NH4+-N去除率达98.35%,显著高于NH4+-N为唯一氮源的67.23%,推测可能是NO3--N加快了电子传递速率,促进了NH4+-N的代谢(白洁等,2018)。NH4+-N、NO2--N、NO3--N是阻碍海水循环水养殖的重要污染,菌株选择应当全面考察对这3种氮素的去除能力。
3.5 pH
HN-AD过程中大多伴随着pH值的变化,当pH值超出菌株适应范围时会降低菌株的酶活性,抑制菌株的生长代谢,进而影响菌株的脱氮性能(Nancharaiah & Reddy,2018)。大多数从海水养殖系统分离的HN-AD菌最适脱氮pH值范围为7.0~9.0(表2)。菌株SF16(Duan et al,2015)具有良好的硝化作用,在弱碱性环境中(pH 7.5~9.5) NH4+-N去除率达到93%以上,可能游离氨对异养硝化有一定的促进作用。氨单加氧酶利用的底物是游离氨而非铵离子,故弱碱性水环境含有更多的氨对异养硝化作用是有利的(Mevel & Prieur,2000)。有研究报道海水养殖水体的pH值为7.0~9.0(Tsukuda et al,2015),适合大多数HN-AD菌株的生态特性。
除了以上因素,抗生素、微塑料以及重金属等也影响到HN-AD菌的脱氮性能。抗生素在水产养殖中用来防治养殖动物疾病,然而其杀菌作用会抑制微生物的脱氮能力。25 mg/L的氨苄青霉素可以明显抑制HN-AD菌株的活性,达到50 mg/L时,总氮去除率和有机物去除率分别下降至48.6%和50.9%(Wang et al,2020)。另外,微塑料(史文超等,2021)、重金属(Yang et al,2019b)也被发现会影响微生物脱氮性能。海水养殖废水HN-AD脱氮处理研究也应对这些新型污染物等影响因素进行探索。
环境因素会影响基因的表达和酶的活性,目前,关于HN-AD菌影响因素的研究大多集中在脱氮性能方面,而对其内在机制的探索较少。生化反应的调节是菌株适应环境的重要因素,因此,有必要对更多菌种进行研究总结出生化机制,从而为实际应用打下良好基础。此外,现有海水HN-AD菌影响因素研究几乎均为单因素研究,单因素研究为菌株应用提供重要的理论依据,但实际工程应用需要对多个因素交互作用进行评价,通常采用生物学领域常用的响应曲面法优化脱氮条件(司圆圆等,2020;Xu et al,2021)。海水HN-AD菌多因素复合影响的研究有待加强。
4 问题及展望
HN-AD作为1种新型的生物脱氮工艺,可以仅在有氧条件下同步完成硝化和反硝化,对于海水养殖废水中氮去除具有明显的优势和较大应用潜力。当前,对HN-AD的研究已经取得了一些成果,但HN-AD技术距离实际应用仍存在一些“瓶颈”问题需解决。如尚不明确脱氮机理和途径、缺乏经济有效的碳源、不明晰多因素共同影响机制等。目前,有不少学者进行模拟反应器中的HN-AD过程研究,但大部分仅限于实验室规模。今后需重点从以下几个方面开展研究:
(1)继续通过常规和分子生物学手段获得适合海水养殖废水的高效脱氮HN-AD菌株。筛选耐盐、脱氮能力高的HN-AD菌株,利用宏基因组测序技术对养殖环境中的菌群进行全面分析;通过基因编辑等方法重新设计关键基因,提高HN-AD过程的电子传递效率,强化HN-AD菌株脱氮性能。
(2)采用组学方法(如基因组学、转录组学、蛋白质组学和代谢组学)多层次深入阐明海水养殖废水HN-AD脱氮途径机制。通过酶的体外表达、功能基因敲除等方法深入解析HN-AD菌的特征酶和功能基因;通过代谢组学分析不同碳源、氮源在HN-AD过程中关键代谢产物的变化。除了深入研究HN-AD菌代谢机制以外,还需进一步构建稳定的HN-AD菌群,以便更好地应用于工程实践。
(3)深入考察海水养殖废水中单一因素对HN-AD过程的影响和分子生物学机制,探索新型污染物对HN-AD过程的影响。明晰多个因素对HN-AD过程的复合影响和生化反应调节机制,获得最优工艺参数。
参考文献
白洁,陈琳,黄潇,等,2018. 1株耐盐异养硝化―好氧反硝化菌Zobellella sp. B307的分离及脱氮特性[J]. 环境科学,39(10):4793-4801.
成钰,李秋芬,费聿涛,等,2016. 海水异养硝化―好氧反硝化芽孢杆菌SLWX2的筛选及脱氮特性[J]. 环境科学,37(7):2681-2688.
段金明,江兴龙,陈宏静,等,2019. 生物强化生物滤池去除海水养殖废水中氨氮[J]. 环境科学与技术,42(1):37-42.
何环,余萱,韩亚涛,等,2017. 异养硝化好氧反硝化菌脱氮特性的研究进展[J]. 工业水处理,37(4):12-17.
马洪婧,刘鹰,慕欣廷,等,2022. 耐盐高效好氧反硝化菌Halomonas sp. HRL-11的分离鉴定及反硝化性能[J]. 大连海洋大学学报,37(2):227-234.
史文超,桂梦瑶,杜俊逸,等,2021. 典型微塑料对好氧反硝化菌群脱氮特性及反硝化相关基因的影响[J]. 环境工程学报,15(4):1333-1343.
司圆圆,许开航,余祥勇,等,2020. 响应曲面法优化脱氮副球菌的反硝化脱氮条件[J]. 基因组学与应用生物学,39(7):3103-3109.
苏兆鹏,李赟,潘鲁青,等,2021. 一株新型异养硝化―好氧反硝化菌GJWA3的脱氮性能及定量检测[J]. 中国海洋大学学报(自然科学版),51(10):41-50.
孙庆花,于德爽,张培玉,等,2016. 1株海洋异养硝化―好氧反硝化菌的分离鉴定及其脱氮特性[J]. 环境科学,(2):647-654.
王骁静,于德爽,李津,等,2017. 海洋异养硝化―好氧反硝化菌y6同步脱氮除碳特性[J]. 中国环境科学,37(2):686-695.
张志强,马宾,张磊,等,2020. 欧洲舌齿鲈幼鱼对养殖水池背景色的偏好研究[J]. 大连海洋大学学报,35(6):901-907.
郑冰冰,吴怡伟,李云辉,等,2020. 不同碳氮比对海水养殖废水脱氮效果的影响[J]. 环境科学研究,33(8):1848-1856.
Barman P, Kati A, Mandal A K, et al, 2017. Biopotentiality of Bacillus cereus PB45 for nitrogenous waste detoxification in ex situ model[J]. Aquaculture International, 25(3):1167-1183.
Borrero-de Acu?a J M, Timmis K N, Jahn M, et al, 2017. Protein complex formation during denitrification by Pseudomonas aeruginosa[J]. Microbial Tiotechnology, 10(6):1523-1534.
Cao X, Zhao B, Wu Y, et al, 2022. Characterization of Alcaligenes aquatilis as a novel member of heterotrophic nitrifier-aerobic denitrifier and its performance in treating piggery wastewater[J]. Bioresource Technology, 354:127176.
Chen J, Gu S, Hao H, et al, 2016. Characteristics and metabolic pathway of Alcaligenes sp. TB for simultaneous heterotrophic nitrification-aerobic denitrification[J]. Applied Microbiology and Biotechnology, 100(22):9787-9794.
Chen Q, Ni J, 2011. Heterotrophic nitrification-aerobic denitrification by novel isolated bacteria[J]. Journal of Industrial Microbiology and Biotechnology, 38(9):1305-1310.
Dionisi H M, Layton A C, Harms G, et al, 2002. Quantification of Nitrosomonas oligotropha-like ammonia-oxidizing bacteria and Nitrospira spp. from full-scale wastewater treatment plants by competitive PCR[J]. Applied and Environmental Microbiology, 68(1):245-253.
Duan J, Fang H, Su B, et al, 2015. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater[J]. Bioresource Technology, 179:421-428.
Fujiwara T, Fukumori Y, 1996. Cytochrome cb-type nitric oxide reductase with cytochrome c oxidase activity from Paracoccus denitrificans ATCC 35512[J]. Journal of Bacteriology, 178(7):1866-1871.
He T, Li Z, Sun Q, et al, 2016. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J]. Bioresource Technology, 200:493-499.
Holmes D E, Dang Y, Smith J A, 2019. Nitrogen cycling during wastewater treatment[J]. Advances in Applied Microbiology, 106:113-192.
Hu Z, Lee J W, Chandran K, et al, 2014. Influence of carbohydrate addition on nitrogen transformations and greenhouse gas emissions of intensive aquaculture system[J]. Science of The Total Environment, 470:193-200.
Huang F, Pan L, Lv N, et al, 2017. Characterization of novel Bacillus strain N31 from mariculture water capable of halophilic heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 124(5):564-571.
Huang F, Pan L, He Z, et al, 2020. Culturable heterotrophic nitrification-aerobic denitrification bacterial consortia with cooperative interactions for removing ammonia and nitrite nitrogen in mariculture effluents[J]. Aquaculture, 523:735211.
Huang X, Li W, Zhang D, et al, 2013. Ammonium removal by a novel oligotrophic Acinetobacter sp. Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature[J]. Bioresource Technology, 146:44-50.
K?rner H, Zumft W G, 1989. Expression of denitrification enzymes in response to the dissolved oxygen level and respiratory substrate in continuous culture of Pseudomonas stutzeri[J]. Applied and Environmental Microbiology, 55(7):1670-1676.
Kuenen J G, Robertson L A, 1994. Combined nitrification-denitrification processes[J]. FEMS Microbiology Reviews, 15(2-3):109-117.
Li J, Bai L, Qiang Z, et al, 2018. Nitrogen removal through “Candidatus Brocadia sinica” treating high-salinity and low-temperature wastewater with glycine addition: Enhanced performance and kinetics[J]. Bioresource Technology, 270:755-761.
Liu X, Shu Z, Sun D, et al, 2018. Heterotrophic nitrifiers dominate reactors treating incineration leachate with high free ammonia concentrations[J]. ACS Sustainable Chemistry & Engineering, 6(11):15040-15049.
Liu Y, Ai G M, Wu M R, et al, 2019. Photobacterium sp. NNA4, an efficient hydroxylamine-transforming heterotrophic nitrifier/aerobic denitrifier[J]. Journal of bioscience and bioengineering, 128(1):64-71.
Lopardo C R, Urakawa H, 2019. Performance and microbial diversity of bioreactors using polycaprolactone and polyhydroxyalkanoate as carbon source and biofilm carrier in a closed recirculating aquaculture system[J]. Aquaculture International, 27(5):1251-1268.
Matsuzaka E, Nomura N, Nakajima-Kambe T, et al, 2003. A simple screening procedure for heterotrophic nitrifying bacteria with oxygen-tolerant denitrification activity[J]. Journal of Bioscience and Bioengineering, 95(4):409-411.
Mevel G, Prieur D, 2000. Heterotrophic nitrification by a thermophilic Bacillus species as influenced by different culture conditions[J]. Canadian Journal of Microbiology, 46(5):465-473.
Nancharaiah Y V, Reddy G K K, 2018. Aerobic granular sludge technology: mechanisms of granulation and biotechnological applications[J]. Bioresource Technology, 247:1128-1143.
Obaja D, Mace S, Mata-Alvarez J, 2005. Biological nutrient removal by a sequencing batch reactor (SBR) using an internal organic carbon source in digested piggery wastewater[J]. Bioresource Technology, 96(1):7-14.
Ouyang L, Wang K, Liu X, et al, 2020. A study on the nitrogen removal efficacy of bacterium Acinetobacter tandoii MZ-5 from a contaminated river of Shenzhen, Guangdong Province, China[J]. Bioresource Technology, 315:123888.
Pan Z, Zhou J, Lin Z, et al, 2020. Effects of COD/TN ratio on nitrogen removal efficiency, microbial community for high saline wastewater treatment based on heterotrophic nitrification-aerobic denitrification process[J]. Bioresource Technology, 301:122726.
Ren Y X, Yang L, Liang X, 2014. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium, Acinetobacter junii YB[J]. Bioresource Technology, 171:1-9.
Richardson D J, Wehrfritz J M, Keech A, et al, 1998. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification[J]. Biochemical Society Transactions, 26(3):401-408.
Schneider O, Sereti V, Machiels M A M, et al, 2006. The potential of producing heterotrophic bacteria biomass on aquaculture waste[J]. Water Research, 40(14):2684-2694.
Song T, Zhang X, Li J, et al, 2021. A review of research progress of heterotrophic nitrification and aerobic denitrification microorganisms (HNADMs)[J]. Science of The Total Environment, 801:149319.
Sun H, Yang Z, Wei C, et al, 2018. Nitrogen removal performance and functional genes distribution patterns in solid-phase denitrification sub-surface constructed wetland with micro aeration[J]. Bioresource Technology, 263:223-231.
Tsujino S, Uematsu C, Dohra H, et al, 2017. Pyruvic oxime dioxygenase from heterotrophic nitrifier Alcaligenes faecalis is a nonheme Fe(II)-dependent enzyme homologous to class II aldolase[J]. Scientific Reports, 7(1):1-8.
Tsukuda S, Christianson L, Kolb A, et al, 2015. Heterotrophic denitrification of aquaculture effluent using fluidized sand biofilters[J]. Aquacultural Engineering, 64:49-59.
Uygur A, Kargi F, 2004. Salt inhibition on biological nutrient removal from saline wastewater in a sequencing batch reactor[J]. Enzyme and Microbial Technology, 34(3-4):313-318.
Wang H, Li J, Wang B, et al, 2020. Deciphering pollutants removal mechanisms and genetic responses to ampicillin stress in simultaneous heterotrophic nitrification and aerobic denitrification (SHNAD) process treating seawater-based wastewater[J]. Bioresource Technology, 315:123827.
Xi H, Zhou X, Arslan M, et al, 2022. Heterotrophic nitrification and aerobic denitrification process: Promising but a long way to go in the wastewater treatment[J]. Science of The Total Environment, 805:150212.
Xia L, Li X, Fan W, et al, 2020. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. ND7 isolated from municipal activated sludge[J]. Bioresource technology, 301:122749.
Xu N, Liao M, Liang Y, et al, 2021. Biological nitrogen removal capability and pathways analysis of a novel low C/N ratio heterotrophic nitrifying and aerobic denitrifying bacterium (Bacillus thuringiensis strain WXN-23)[J]. Environmental Research, 195:110797.
Yan Y, Lu H, Zhang J, et al, 2022. Simultaneous heterotrophic nitrification and aerobic denitrification (SND) for Nitrogen Removal: A Review and Future Perspectives[J]. Environmental Advances, 9: 100254.
Yang J R, Wang Y, Chen H, et al, 2019a. Ammonium removal characteristics of an acid-resistant bacterium Acinetobacter sp. JR1 from pharmaceutical wastewater capable of heterotrophic nitrification-aerobic denitrification[J]. Bioresource technology, 274:56-64.
Yang L, Wang X H, Cui S, et al, 2019b. Simultaneous removal of nitrogen and phosphorous by heterotrophic nitrification-aerobic denitrification of a metal resistant bacterium Pseudomonas putida strain NP5[J]. Bioresource Technology, 285:121360.
Yang Z, Zhou Q, Sun H, et al, 2021. Metagenomic analyses of microbial structure and metabolic pathway in solid-phase denitrification systems for advanced nitrogen removal of wastewater treatment plant effluent: A pilot-scale study[J]. Water Research, 196:117067.
Yao S, Ni J, Chen Q, et al, 2013. Enrichment and characterization of a bacteria consortium capable of heterotrophic nitrification and aerobic denitrification at low temperature[J]. Bioresource Technology, 127:151-157.
Yao Z, Yang L, Wang F, et al, 2020. Enhanced nitrate removal from surface water in a denitrifying woodchip bioreactor with a heterotrophic nitrifying and aerobic denitrifying fungus[J]. Bioresource Technology, 303:122948.
Zhang M, Li A, Yao Q, et al, 2020a. Nitrogen removal characteristics of a versatile heterotrophic nitrifying-aerobic denitrifying bacterium, Pseudomonas bauzanensis DN13-1, isolated from deep-sea sediment[J]. Bioresource Technology, 305:122626.
Zhang M, Pan L, Liu L, et al, 2020b. Phosphorus and nitrogen removal by a novel phosphate-accumulating organism, Arthrobacter sp. HHEP5 capable of heterotrophic nitrification-aerobic denitrification:Safety assessment, removal characterization, mechanism exploration and wastewater treatment[J]. Bioresource Technology, 312:123633.
Zhang S, Sun X, Fan Y, et al, 2017. Heterotrophic nitrification and aerobic denitrification by Diaphorobacter polyhydroxybutyrativorans SL-205 using poly (3-hydroxybutyrate-co-3-hydroxyvalerate) as the sole carbon source[J]. Bioresource Technology, 241:500-507.
Zhang Y, Shi Z, Chen M, et al, 2015. Evaluation of simultaneous nitrification and denitrification under controlled conditions by an aerobic denitrifier culture[J]. Bioresource Technology, 175:602-605.
Zhao B, He Y L, Zhang X F, 2010. Nitrogen removal capability through simultaneous heterotrophic nitrification and aerobic denitrification by Bacillus sp. LY[J]. Environmental technology, 31(4):409-416.
Zhao K, Tian X, Li H, et al, 2019. Characterization of a novel marine origin aerobic nitrifying-denitrifying bacterium isolated from shrimp culture ponds[J]. Aquaculture Research, 50(7):1770-1781.
Zheng H Y, Liu Y, Gao X Y, et al, 2012. Characterization of a marine origin aerobic nitrifying-denitrifying bacterium[J]. Journal of Bioscience and Bioengineering, 114(1):33-37.
(责任编辑 张俊友 熊美华)
Research Progress on Heterotrophic Nitrification-Aerobic Denitrification
Bacteria in the Denitrification of Mariculture Wastewater
ZHOU Peng1,2, LIU Ying2,3, MU Xin‐ting2, SU Xin2, WU Ying‐hai4, HAN Rui2
(1. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, P.R. China;
2. Key Laboratory of Environment Controlled Aquaculture, Dalian Ocean University,
Dalian 116023, P.R. China;
3. College of Biosystems Engineering and Food Science, Zhejiang University,
Hangzhou 310058, P.R. China;
4. College of Marine and Civil Engineering, Dalian Ocean University,
Dalian 116023, P.R. China)
Abstract:Heterotrophic nitrification-aerobic denitrification (HN-AD) technology can simultaneously produce nitrification and denitrification under aerobic conditions, a significant advantage for the biological denitrification of marine aquaculture wastewater. In this study, we reviewed recent research on the isolation and screening HN-AD bacteria in seawater, the denitrification pathway and mechanism of HN-AD bacteria, and the key functional genes and enzymes guiding denitrification. The effects of primary environmental factors (carbon source, carbon-nitrogen ratio, dissolved oxygen, nitrogen source, temperature, pH and emerging contaminants) on nitrogen removal by HN-AD bacteria were also summarized. Finally, prospects for future research were discussed for optimizing the biological denitrification of marine aquaculture wastewater. Promising research directions include obtaining high-efficiency denitrification strains by conventional and molecular methods, elucidating the mechanism of nitrogen removal using a multi-omics approach, and clarifying the molecular mechanism of environmental factors affecting HN-AD bacteria. Our study provides a reference for the practical application of HN-AD bacteria in treating wastewater from mariculture.
Key words: mariculture wastewater; denitrification bacteria; biological mechanism; environmental factors; process parameter
收稿日期:2022-08-22 修回日期:2023-08-17
基金项目:国家自然科学基金项目(32273186);国家重点研发计划项目(2019YFD0900501);辽宁省科学技术计划项目(2021JH2/10200012);大连市支持高层次人才创新创业项目(2020RQ111);设施渔业教育部重点实验室开放课题项目(202211)。
作者简介:周鹏,1979年生,女,硕士,研究方向为水处理微生物。E-mail:zpzpzzq@163.com
通信作者:韩蕊。E-mail:hanrui@dlou.edu.cn
