盐碱水中地衣芽孢杆菌抑制铜绿微囊藻生长研究
2023-04-29周成夷么宗利来琦芳袁春营高鹏程陆建学李燕周凯刘一萌孙真
周成夷 么宗利 来琦芳 袁春营 高鹏程 陆建学 李燕 周凯 刘一萌 孙真

摘要:基于菌藻平衡原理控制蓝藻,可降低盐碱地养殖池塘铜绿微囊藻(Microcystis aeruginosa)对养殖生物的危害。在实验室条件下,研究了盐碱水中地衣芽孢杆菌(Bacillus licheniformis)对铜绿微囊藻生长的抑制效果并探索其抑藻途径。结果显示,在碳酸盐碱度6.4 mmol/L、盐度3.5、pH 8.9的盐碱水中,地衣芽孢杆菌对初始密度为1.0×106、6.0×106、20×106 个/mL的铜绿微囊藻均有明显抑制作用,抑制率分别达到51.8%、71.1%、65.7%;地衣芽孢杆菌无菌滤液对铜绿微囊藻生长也表现出显著的抑制效果,其中无菌滤液加入量为实验水体2%时的抑制效果最好,培养6 d后藻密度仅为4.5×106 个/mL,处理组叶绿素a含量较对照组降低了58.8%,与铜绿微囊藻光合作用相关的PSBA1和PSBD1基因表达下降,光合作用途径受到抑制;盐碱水中地衣芽孢杆菌对铜绿微囊藻具有较好的抑制效果。
关键词:地衣芽孢杆菌;铜绿微囊藻;藻类抑制;无菌滤液;盐碱水
中图分类号:X835 文献标志码:A 文章编号:1674-3075(2023)06-0136-06
我国有4 600 万hm2盐碱水域,遍及19个省(区、市),主要分布在东北、华北、西北内陆地区以及长江以北沿海地带;因其水质类型多,水化学组成复杂,绝大部分长期以来处于荒置状态,发展盐碱地水产养殖,合理利用盐碱水资源,不仅能够拓展渔业发展空间,对于盐碱地的生态治理也有重要意义(来琦芳等,2021)。由于盐碱水高pH、高碳酸盐碱度、高离子系数以及水质类型多的特点,盐碱池塘极易暴发蓝藻水华,在水产养殖过程中控制蓝藻成为丞待解决的水质问题。
藻类通过光合作用为养殖水体提供充足的O2,但也会大量消耗水体中的CO2以及HCO3-,引起碳酸盐体系失去平衡,导致水体pH升高,造成水环境恶化与水体功能下降(张小倩等,2017;Dos Santos et al,2020)。在盐碱池塘养殖中,部分藻类会对养殖生物造成损害,如铜绿微囊藻(Microcystis aeruginosa)、三毛金藻(Prymnesiacee)以及裸甲藻(Gymnodinium aerucyinosum)等,铜绿微囊藻是盐碱地蓝藻水华的主要来源之一(许海等,2019)。在养殖进程中,三毛金藻引起养殖鱼类发病后很难治愈,因此常采用防治办法,其中定期施用EM菌、光合细菌等是有效措施(石伟,2011)。裸甲藻属于甲藻纲,喜高pH值、高温,且大量繁殖后易形成红褐色藻华,危害水生动物,在盐碱池塘防治中,常采用定期施加微生态制剂以保持水质,或施用三氯异氰尿酸消毒,同时补充有益菌等方法(孙炜等,2018)。铜绿微囊藻暴发可产生大量毒性较强的毒素,破坏生态系统结构与平衡,造成养殖水环境pH升高,危害养殖生物(苏发文等,2016)。水环境中一些细菌对藻类有抑制作用,这类细菌被称作抑藻菌或溶藻菌,能够在很大程度上改变藻类群落结构(傅丽君等,2021)。有研究表明,淡水中的短短芽孢杆菌(张小倩等,2017)、枯草芽孢杆菌(Liu et al,2019)、放线菌(李汉全等,2015)等对铜绿微囊藻有良好的抑制效果;海洋溶藻细菌DHQ25的培养上清液能够通过抑制藻类光系统来裂解塔玛亚历山大藻(Zhang et al,2014);海杆菌属D-2对米氏凯伦藻有高效的抑制作用(杜文俊等,2021);而关于盐碱水中菌抑藻的研究鲜有报道。
目前,盐碱地水产养殖缺乏有效的蓝藻处理方法,其中物理方法工作量大、且维持时间较短;而化学法容易留下残留,污染养殖水体,对养殖生物的生长不利。地衣芽孢杆菌(Bacillus licheniformis)是一种革兰氏阳性兼性厌氧菌,在生长代谢中不仅能产生多种抗菌物质,同时能够抑制病原微生物的生长并改良水质。有研究发现,在淡水环境中的地衣芽孢杆菌能够对铜绿微囊藻的生长产生抑制效果,并控制其暴发(Liu et al,2019)。本文通过探究盐碱水环境中地衣芽孢杆菌对铜绿微囊藻的抑制效果,以期为盐碱地水产养殖控制蓝藻暴发提供基础数据,为盐碱水质调控提供新途径。
1 材料与方法
1.1 实验材料
实验用地衣芽孢杆菌为经盐碱水筛选后保存的菌株,将未筛选的地衣芽孢杆菌菌粉加入到盐碱水LB液体培养基中,30℃恒温培养24 h,取1 mL加入到新的液体培养基中,重复筛选3次。取筛选培养后的菌液5 mL配置稀释液,于盐碱水LB固体培养基中涂布分离单株菌,将所得纯菌株低温保存。
铜绿微囊藻藻种来源于中国科学院淡水藻种库(编号:FACHB-905),将所得藻种在BG-11培养基中逐步扩大培养,以满足实验所需。地衣芽孢杆菌采用LB培养基培养(曹礼等,2018);铜绿微囊藻采用BG-11培养基培养(邱森森等,2018);实验所用培养基均采取121℃灭菌20 min。
预实验发现地衣芽孢杆菌在盐碱水中能正常生长,且10 h后达到指数生长期,为7.1×106 CFU/mL。为了保证实验结果的可靠性,在预实验阶段采用7.1×106 CFU/mL的地衣芽孢杆菌进行多次重复实验,取得较好效果,所得抑制率均大于50%。
实验所用盐碱水均模拟河北盐碱水的水质组成进行配置,碳酸盐碱度6.4 mmol/L、pH 8.9、盐度3.5,主要离子组成见表1。
1.2 铜绿微囊藻培养和生长测定
1.2.1 微藻培养 将铜绿微囊藻转接入1 L的三角烧瓶内,在恒温光照培养箱中培养,光暗周期为12 h:12 h,光照强度2 500 lx,温度为(25±1)℃。
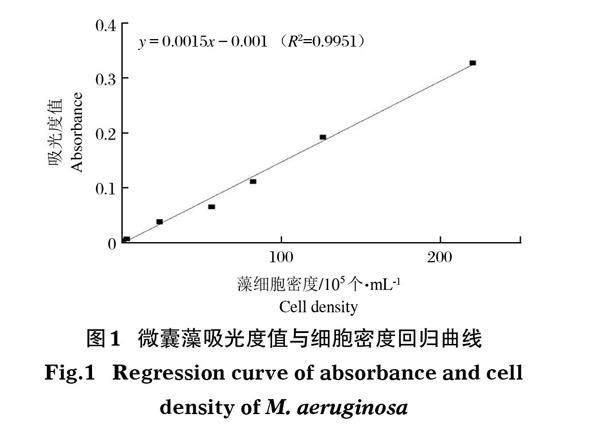
1.2.2 回归曲线 取1 mL指数生长期的铜绿微囊藻,参照马欠等(2019)方法绘制吸光度值和藻细胞密度(0、0.3[×]105、0.68[×]105、3.2[×]105、2.4[×]106、8.2[×]106、2.2[×]107 个/mL)回归曲线。所得回归曲线用于计算水体中铜绿微囊藻的藻细胞密度(图1)。
1.3 地衣芽孢杆菌抑藻实验
蓝藻水华时,藻细胞密度一般在10×106 个/mL(李颖等,2014),据此设置1×106、6×106、20×106 个/mL共3个藻细胞密度实验组。在250 mL锥形瓶中加入含有不同密度铜绿微囊藻藻液的配置盐碱水100 mL,实验组加入地衣芽孢杆菌,浓度为7.1×106 CFU/mL,对照组不加菌。实验设3个平行,通气培养7 d,每隔3 d测定铜绿微囊藻吸光度,根据生长曲线计算铜绿微囊藻藻细胞密度。藻抑制率(苏跃龙等,2014)计算如下:
IR = (1 - Nt/Mt)×100% ①
式中:IR为抑制率,Nt为处理组第t天藻细胞密度值,Mt为对照组第t天藻细胞密度值。
1.4 地衣芽孢杆菌无菌滤液抑藻实验
1.4.1 滤液制备 将浓度7.1×106 CFU/mL地衣芽孢杆菌菌液冷冻离心(日立CF15R)10 000 r/min,4 ℃离心10 min后收集上清液,用0.22 ?m滤膜过滤后得到无菌滤液,低温保存(Akiyama et al,2001)。
1.4.2 抑藻实验 在250 mL锥形瓶中加入含有106 个/mL铜绿微囊藻藻液的配置盐碱水100 mL,实验组分别按体积比0.5%、1%、2%加入地衣芽孢杆菌无菌滤液。在恒温光照培养箱中通气培养7 d,每隔3 d检测实验组和对照组中藻细胞密度,实验设置3个平行。
1.5 铜绿微囊藻叶绿素a含量测定
根据抑藻实验结果,在实验组中加入2%无菌滤液共培养7 d,每隔3 d测量实验组溶液叶绿素a含量。叶绿素a提取方法采用丙酮提取-反复冻融法(李孟珂等,2019),采用分光光度法测量铜绿微囊藻中叶绿素a的含量,计算公式如下:
C = 0.0604×A632-4.5224×A649+13.2969A665-1.7453×A696 ②
式中:C为叶绿素a含量,A632、A649、A665、A696分别为632、649、665、696 nm的吸光度值。
1.6 地衣芽孢杆菌对铜绿微囊藻光合基因表达
实验在250 mL锥形瓶中进行。为了探究地衣芽孢杆菌无菌滤液对铜绿微囊藻中与光合作用有关的PSBA1和PSBD1基因表达的影响,将铜绿微囊藻(初始密度为106 个/mL)与地衣芽孢杆菌的无菌滤液(加入量为2%体积)进行共培养,每隔3 d进行取样,每次取样体积为50 mL。
1.6.1 总RNA提取 取50 mL的共培养液3 000 r/min 离心10 min,弃去上清。用TaKaRa Mini-BEST通用RNA提取试剂盒(中国大连)操作方法提取藻类RNA。
1.6.2 反转录合成cDNA 以铜绿微囊藻RNA为模板,根据RNA浓度测定结果,使用 PrimeScriptTM RT Master Mix(Perfect Real Time)(TaKaRa)反转录试剂盒合成cDNA。
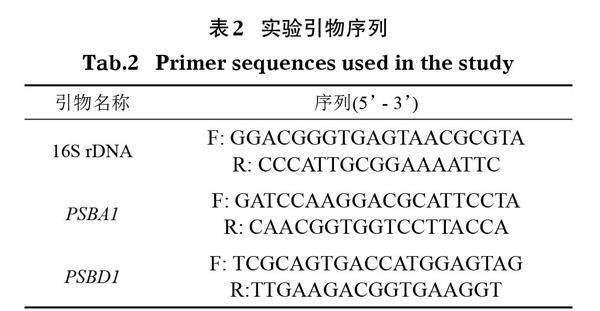
1.6.3 荧光定量PCR 采用TB Green premix Ex TaqTM(Tli RnaseH Plus)(TaKaRa) 试剂盒在CFX96 Real Time PCR Detection System(Bio-Rad) 上进行荧光定量PCR分析。每个样品重复3次,引物序列如表2。内参基因为16S rDNA基因,采用2-△△Ct法计算基因表达相对量(Zhang et al,2020)。
1.7 数据分析
统计数据表示为平均值±标准差(Mean±SD)。所有数据符合正态分布并通过方差齐性检验。采用单因素方差分析(One-way ANOVA)各组别间差异,LSD法进行多重比较,显著性水平为P<0.05,统计分析使用SPSS 25.0软件。
2 结果
2.1 地衣芽孢杆菌与铜绿微囊藻生长
在初始藻密度为1×106、6×106、20×106 个/mL组加入地衣芽孢杆菌,铜绿微囊藻生长均出现抑制现象,处理第6天,3个组别抑制率分别为51.8%、71.1%、65.7%(图2)。处理第3天,3个组别抑藻率出现显著性差异(P<0.05)。其中,6×106 个/mL密度组抑藻率最高,达到了53.2%;其次为20×106 个/mL组,抑制率为42.3%;1×106 个/mL组最低,仅34.1%。3个组别在第6天对铜绿微囊藻的生长抑制作用与第3天趋势一致。地衣芽孢杆菌对3种密度下铜绿微囊藻的抑制率在第6天均超过50%,抑制效果显著。
不加无菌滤液的对照组,藻细胞密度快速上升(图3),第6天达到了2.2×107个/mL;加入无菌滤液的实验组铜绿微囊藻生长受到显著抑制,其中2%实验组抑制效果最好,培养6 d后藻密度仅为4.5×106个/mL;0.5%处理组藻密度为1.13×107 个/mL,1%处理组藻密度为7.2×106 个/mL。
2.2 地衣芽孢杆菌与铜绿微囊藻叶绿素a含量
地衣芽孢杆菌无菌滤液对铜绿微囊藻叶绿素a含量也有显著抑制效果(图4)。相同培养条件下,实验组叶绿素a含量在第3天就出现抑制效果,相比对照组显著减少,对照组在第6天达到了1.7 mg/L(P<0.05);而加入无菌滤液的实验组,叶绿素含量在第6天为0.7 mg/L,仅为对照组的58.8%,表现出显著的抑制效应(P<0.05)。
2.3 地衣芽孢杆菌与铜绿微囊藻光合作用基因表达
地衣芽孢杆菌无菌滤液抑制了铜绿微囊藻中光合作用相关PSBA1基因与PSBD1基因表达(图5)。实验组的PSBA1基因表达在第3天开始出现显著下降(P<0.05),仅为对照组的49.5%,在第6天有所恢复,但仍显著低于对照组(P<0.05);实验组的PSBD1基因表达则从第3天开始一直处于显著下降状态(P<0.05)。
3 讨论
3.1 地衣芽孢杆菌的抑藻途径与作用机制
抑藻菌对藻类的抑制途径有2种,一种是通过细胞间直接攻击抑制藻细胞;另一种是通过释放活性物质等间接攻击抑制藻细胞(杜青波等,2017)。本实验范围内,地衣芽孢杆菌抑藻途径属于间接抑制,其无菌滤液中含有的胞外活性物质能降低铜绿微囊藻叶绿素a含量,使PSBA1与PSBD1基因表达下降,推测其作用机制主要是通过影响光合作用中的光系统Ⅱ来抑制铜绿微囊藻生长。有研究发现,B1芽孢杆菌分泌的抑藻物质可以破坏球形棕囊藻细胞结构,损伤叶绿体,影响叶绿素a的合成(李蔷,2012),这也可能是地衣芽孢杆菌无菌滤液降低叶绿素a含量的原因之一;PSBA1基因和PSBD1基因是编码PS II反应中心的重要成分,与藻类的光合作用密切相关。Qian等(2010)研究发现,植物体中PSBA1和PSBD1基因表达下降能导致光合作用系统的电子传递链中断,最终影响CO2固定过程;此外,贾雯等(2013)研究发现,侧孢短芽孢杆菌抑藻活性物质的介入,导致铜绿微囊藻内光系统的D1蛋白被破坏,电子传递链受阻,从而抑制光合作用。微生物抑制藻类的机制,在生理水平上还包括细胞膜的损伤、脂质过氧化、影响藻体活性氧清除或光合作用相关酶的活性等(Zeng et al,2021);在分子水平上,包括阻碍参与呼吸作用以及细胞增殖相关基因的表达(林泽宏,2020)。
3.2 不同环境条件下地衣芽孢杆菌的抑藻效果
本次研究发现,指数生长期的地衣芽孢杆菌对1.0×106、6.0[×]106、20[×]106 个/mL铜绿微囊藻均表现出抑制作用,抑制率分别为51.8%、71.1%、65.7%,表明在盐碱水中地衣芽孢杆菌的抑藻效果明显;但当藻密度达到一定范围后,抑藻效果有一定程度降低,推测其通过释放胞外活性物质影响铜绿微囊藻生长,进而达到抑藻效果。铜绿微囊藻是极易暴发的蓝藻,当前缺乏有效防控方法。以环境友好的微生物控制池塘藻类暴发,近年来受到了广泛关注,芽孢杆菌(许艳婷等,2018)、酵母菌(陈明华,2019)等微生物对藻类均有一定的抑制效果。淡水环境中地衣芽孢杆菌Sp34对铜绿微囊藻抑制率达39.6%~75.2%(Liu et al,2019);枯草芽孢杆菌的抑制率在50%~60%,但在pH大于8的碱性环境下,枯草芽孢杆菌的生长受到显著影响(程新等,2017)。以菌抑藻为盐碱池塘防控铜绿微囊藻提供了新途径。对比田照辉等(2021)淡水培养基中的芽孢杆菌4 h进入指数生长期,本研究耗时10 h,表明盐碱水环境对地衣芽孢杆菌生长存在一定的影响,浓度可达到106 CFU/mL,说明地衣芽孢杆菌对盐碱水环境有较强的耐受适应能力,今后应加强对耐盐碱性抑藻菌株的筛选。
本实验范围内,与菌液对比,无菌滤液抑藻效果更为明显,抑藻率最高可达79.5%。比较不同体积比的抑藻效果,2%在抑藻绝对量上具有优势,而0.5%在抑藻相对量上具有优势。因此,在养殖生产中还需要进一步确定适宜的无菌滤液浓度。
参考文献
曹礼,张学虹,赵惠蓉,等, 2018. 响应面法优化盐碱土中所得一株细菌的培养条件[J]. 中国酿造, 37(2):91-94.
陈明华,2019. 微生物发酵液对赤潮藻生长的影响[D]. 福州:福建师范大学.
程新,李昆太,黄林, 2017. 一株枯草芽孢杆菌的生长特性及抑藻效果研究[J]. 生物技术通报, 33(7):120-125.
杜青波,崔昊,蒲红宇, 2017. 利用溶藻菌控制危害性蓝藻的研究进展[J]. 现代农业科技, (4):168-169.
杜文俊,冯燕楼,安莹,等, 2021. 米氏凯伦藻抑藻菌的分离鉴定及抑制效应[J]. 曲阜师范大学学报(自然科学版), 47(2):101-105
傅丽君,林潇雨,杨磊,等, 2021. 溶藻细菌HSY-03对赤潮异弯藻抗氧化系统的影响[J]. 生态毒理学报, 16(3):302-309.
贾雯,黄翔鹄,李长玲,等,2013. 侧孢短芽孢杆菌溶藻活性代谢产物对虾池颤藻的溶藻效果[J]. 水产学报, 37(3):465-472.
来琦芳,么宗利,高鹏程,等, 2021. 盐碱水环境与增养殖种类[M]. 北京:中国农业出版社.
李汉全,张炳火,杨建远,等, 2015. Streptomyces eurocidicus JXJ 0089对铜绿微囊藻的抑制[J]. 江苏农业学报, 31(5):1037-1044.
李孟珂,夏运生,单壮壮,等, 2019. 三株蓝藻附着细菌多样性及其对铜绿微囊藻增殖的影响[J]. 云南大学学报(自然科学版), 41(6):1238-1245.
李蔷,2012. 溶藻细菌的分离鉴定及其胞外活性物质对球形棕囊藻的溶藻特性研究[D]. 广州:暨南大学.
李颖,施择,张榆霞,等, 2014. 关于用藻密度对蓝藻水华程度进行分级评价的方法和运用[J]. 环境与可持续发展, 39(2):67-68.
林泽宏,2020. 赤潮异弯藻暴露于芽孢杆菌属B1菌胞外溶藻粗提物的生理和代谢响应机制研究[D]. 广州:暨南大学.
马欠,邓春暖,郭锋锋,等,2019. 光照对小球藻和铜绿微囊藻生长及叶绿素荧光的影响[J]. 西安文理学院学报(自然科学版), 22(4):73-77.
邱森森,胡修俊,朱凤蒙,等, 2018. 地下芽孢杆菌ZDC-01抑菌效果及其防效研究[J]. 现代农业科技, (13):97-98,102.
石伟,2011. 盐碱地区三毛金藻病的防治技术[J]. 科学养鱼, (9):78.
苏发文,来琦芳,么宗利,等, 2016. 铜绿微囊藻和小球藻对水环境pH的影响[J]. 中国水产科学, 23(6):1380-1388.
苏跃龙,王正芳,2014. 不同水生植物抑藻效果及机理研究[J]. 环境科学导刊, 33(6):15-22.
孙炜,李春岭,蔡敬,2018. 盐碱水池塘防治裸甲藻危害实例[J]. 河北渔业, (8):39-40.
田照辉,徐绍刚,董颖,等, 2021. 6株芽孢杆菌的分离鉴定和生物学特性[J]. 江苏农业科学, 49(13):157-161.
许海,陈丹,陈洁,等,2019. 氮磷形态与浓度对铜绿微囊藻和斜生栅藻生长的影响[J]. 中国环境科学, 39(6):2560-2567.
许艳婷,宋瑞雪,田聪琦,等,2018. 抑藻菌株Bacillus sp.hsn 03分离鉴定及其对铜绿微囊藻的抑制效果与特征[J]. 微生物学通报, 45(12):2592-2602.
张小倩,张炜,卢亚萍,等, 2017. 短短芽孢杆菌发酵液对铜绿微囊藻的抑制效应[J]. 南京农业大学学报, 40(4):625-631.
Dos Santos J A, Soares C M, Bialetzki A, 2020. Effects of pH on the incubation and early development of fish species with different reproductive strategies[J]. Aquatic Toxicology, 219(3):105-112.
Liu J Y, Yang C Y, Chi Y X, et al, 2019. Algicidal characterization and mechanism of Bacillus licheniformis Sp34 against Microcystis aeruginosa in Dianchi Lake[J]. Journal of Basic Microbiology, 59(11):1112-1124.
Qian H, Yu S, Sun Z, et al, 2010. Effects of copper sulfate, hydrogen peroxide and N-phenyl-2-naphthylamine on oxidative stress and the expression of genes involved photosynthesis and microcystin disposition in Microcystis aeruginosa[J]. Aquatic Toxicology, 99(3):405-412.
Zeng Y D, Wang J Y, Yang C Y, et al, 2021. A Streptomyces globisporus strain kills Microcystis aeruginosa via cell-to-cell contact[J]. Science of the Total Environment, 769:144489.
Zhang H J, Lv J L, Peng Y, et al, 2014. Cell death in a harmful algal bloom causing species Alexandrium tamarense upon an algicidal bacterium induction[J]. Applied Microbiology and Biotechnology, 98(18):7949-7958.
Zhang S F, Han B B, Wu F X, et al, 2020. Quantitative proteomic analysis provides insights into the algicidal mechanism of Halobacillus sp. P1 against the marine diatom Skeletonema costatum[J]. Science of the Total Environment, 717:137048.
(责任编辑 万月华)
Growth Inhibition of Microcystis aeruginosa by Bacillus licheniformis
in Saline-Alkaline Water
ZHOU Cheng‐yi1,2, YAO Zong‐li2, LAI Qi‐fang2, YUAN Chun‐ying1, GAO Peng‐cheng2,
LU Jian‐xue2, LI Yan2, ZHOU Kai2, LIU Yi‐meng2, SUN Zhen2
(1. Tianjin University of Science and Technology School of Oceanography and Environment,
Tianjin 300457, P.R. China;
2. Key Laboratory of Aquaculture on Saline-Alkaline Land , Ministry of Agriculture and Rural Affairs,
East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Fishery Engineering
Technology Research Center for Saline-Alkaline Waters, Shanghai 200090, P.R. China)
Abstract:Cyanobacteria such as Microcystis aeruginosa are the primary source of algal blooms in saline-alkaline ponds and endanger aquaculture organisms. Microbe-based algae control has attracted attention because of potential effectiveness, species specificity, and eco-friendliness. Previous research has shown that Bacillus licheniformis can inhibit M. Aeruginosa growth in fresh water. In this study, the growth inhibition of M. aeruginosa by B. licheniformis and its inhibition mechanism were investigated under laboratory conditions. We aimed to provide basic data for the control of cyanobacteria blooms in saline-alkaline aquaculture and propose a feasible method for regulating the quality of saline-alkaline water. In this study, there were two groups of experiments. One group was set as follows: three treatments with initial M. aeruginosa concentrations of 1×106, 6×106, and 20×106 cells/mL, and an initial concentration of B. licheniformis of 7.1×106 CFU/mL. The second group of experiments was set as follows: three treatments with an initial M. aeruginosa concentration of 1×106 cells/mL, and cell-free filtrates of B. licheniformis solution at concentrations of 0.5%, 1% and 2%. Each treatment was run in triplicate with a control, and the experiment lasted seven days. Cell density and absorbance of M. aeruginosa in each treatment was determined every three days. Growth of M. aeruginosa was significantly inhibited by B. licheniformis in saline-alkaline water under experimental conditions: carbonate alkalinity, 6.4 mmol/L; pH, 8.9 and salinity, 3.5. The inhibition rates of M. aeruginosa at initial M. aeruginosa concentrations of 1×106 cells/mL, 6×106 cells/mL and 20×106 cells/mL were, respectively, 51.8%, 71.1% and 65.7%, with normal M. aeruginosa growth in the control. The cell-free filtrate of B. licheniformis also showed a strong inhibitory effect on the growth of M. aeruginosa, and was most pronounced at the highest concentration (2%),with the M.aeruginosa concentration of 4.5×106 cells/mL after culture for 6 d. At a filtrate concentration of 2%, the chlorophyll-a content in the experimental group was 58.8% lower than that in the control group, a significant reduction. B. licheniformis affected the expression of key M. aeruginosa genes involved in photosynthesis, such as PSBA1 and PSBD1, with significant downward regulation. In conclusion, B. licheniformis was found to inhibit M. aeruginosa photosynthesis in saline-alkaline water, consequently inhibiting growth.
Key words:Bacillus licheniformis; Microcystis aeruginosa; algae inhibition; cell-free filtrate; saline-alkaline water
收稿日期:2022-04-14 修回日期:2023-07-03
基金项目:国家重点研究计划(NO.2020YFD0900400);中央级公益性科研院所基本科研业务费专项(2021XT04,2020TD52)。
作者简介:周成夷,1996年生,男,硕士研究生,研究方向为盐碱地水质调控。E-mail:530495074@qq.com
通信作者:来琦芳,1970年生,女,研究员,主要从事盐碱地水产养殖研究。E-mail:laiqf@ecsf.ac.cn
