中国丁型肝炎的研究发展史
2023-04-29刘慧敏毛青
刘慧敏 毛青
摘要:自二十世纪七十年代发现丁型肝炎病毒(HDV)伊始,中国学者即开始针对HDV及丁型肝炎进行了大量的研究。本文通过查询中国科技期刊各大数据平台及我国学者在国外PubMed数据库期刊发表的相关文献,从历史发展的视角,全面分析总结了我国有关HDV及丁型肝炎从基础到临床的研究历程和科学发现。历年来,我国学者从检测技术方法建立、感染动物模型构建、核酶功能及应用、临床诊断与表现等方面开展了广泛研究。四十年来的研究成果,为进一步研究HDV的病毒学特征、感染机制、免疫应答与损伤、丁型肝炎的临床病理变化和抗病毒治疗奠定了基础。
关键词:丁型肝炎; δ肝炎病毒; 中国
Research history of hepatitis D in China
LIU Huimin, MAO Qing. (Chongqing Key Laboratory of Infectious Disease Research, Institute of Infectious Diseases of PLA, Southwest Hospital, Army Medical University, Chongqing 400038, China)
Corresponding author:
MAO Qing, qingmao@tmmu.edu.cn (ORCID:0000-0003-3138-2104)
Abstract:
Since the discovery of hepatitis D virus (HDV) in the 1970s, Chinese scholars have started to conduct extensive studies on HDV and hepatitis D (HD). By searching for related articles published on the platforms of Chinese scientific and technological journals and the journals in PubMed database by Chinese scholars, this article comprehensively analyzes and summarizes the advances and scientific findings in HDV and HD by Chinese scholars from basic to clinical research from the perspective of historical development. Over the past years, Chinese scholars have conducted extensive research on the establishment of detection techniques and methods, the construction of infected animal models, the function and application of ribozymes, and clinical diagnosis and manifestation. The research findings in the past 40 years have laid a foundation for further research on the virological characteristics, infection mechanism, and immune response and injury of HDV, the clinicopathological changes of HD, and related antiviral treatment.
Key words:
Hepatitis D; Hepatitis Delta Virus; China
1970年,意大利都灵学者在严重的慢性乙型肝炎患者中发现了一种新型免疫产物。1977年,δ因子被Rizzetto等[1]第一次正式报道。1978年,美国国立卫生研究院开始进行相关研究,发现δ因子与一种新型病毒颗粒相关。1980年,丁型肝炎病毒(hepatitis D virus, HDV)被正式命名[2]。随后,为进一步了解HDV,国内外学者展开了大量的基础实验和临床研究。在此简要阐述我国丁型肝炎的研究史。
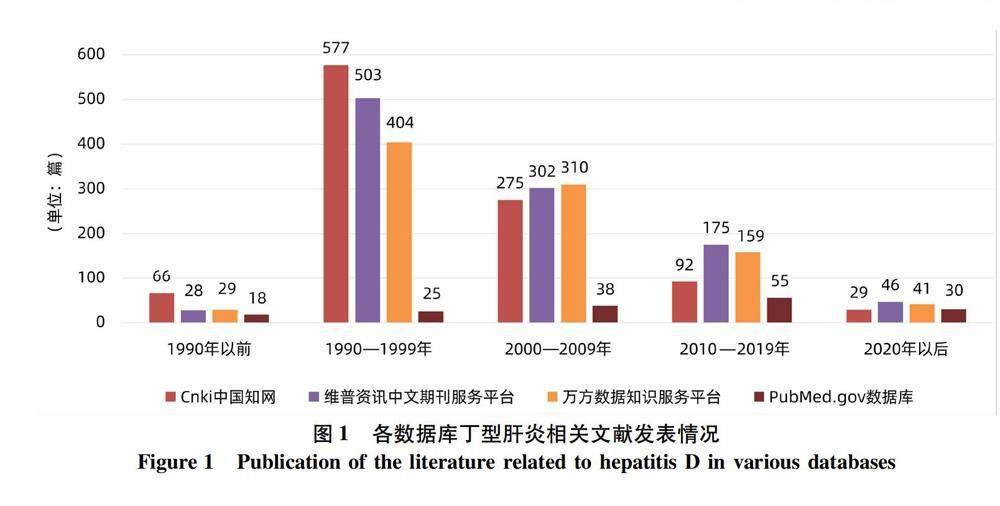
截至2023年2月20日,分析各期刊数据平台(图1)显示,中国知网数据库-期刊-主题,检索“丁型肝炎”,来源类别选择“全部期刊”,检索到2 581条结果,中文文献1 039篇,包括基础医学117篇,临床医学719篇,以及其他学科类203篇,其中最早的期刊文献发表于1985年[3]。维普资讯中文期刊服务平台-任意字段,检索“丁型肝炎”,结果为1 054篇文献,其中医药卫生1 009篇,包括基础医学225篇,临床医学784篇,检索到最早的期刊文献发表于1987年[4]。万方数据知识服务平台-期刊论文-万方智搜,检索“丁型肝炎”結果943篇文献,其中医药卫生798篇,包括基础医学158篇,临床医学640篇,检索到最早的期刊文献发表于1986年[5]。分析PubMed数据库,检索“Hepatitis delta, Chinese”,结果为166篇文献,最早是我国台湾学者在1984年发表的两篇临床报道[6-7]。
1 HDV的基础研究发展
二十世纪七八十年代,国外学者在HBsAg阳性携带者中发现了HDV,成熟的HDV颗粒在电镜下呈球形,直径35~37 nm,浮密度1.24~1.25 g/cm3[2]。HDV基因组由大小约1.7 kb的单链环状负链RNA组成,较已知动物RNA病毒的基因组小,但比高等植物的类病毒大。HDV基因组的结构特点与类病毒的卫星RNA有许多相似之处,其RNA序列的特点是G+C含量高达60%[8],分子内易互补形成稳定的二级结构。其3′端无多聚腺苷,不含逆转录酶。HDV RNA分子序列中的第793~839核苷酸能与第1~839核苷酸广泛互补,61%的核苷酸形成碱基对,另6%为G-U配对形成棒状结构。3个高度保守区域为659~772、847~966以及1 267~1 348,这些区域可作为聚合酶链式反应(PCR)的靶基因序列应用于临床诊断。此外,研究发现HDV在实验感染的动物肝脏有双链RNA复合物存在,且存在两种滚动循环方式——正链和负链各自滚动与剪切,复制后能自身剪切与连接。HDV的蛋白质成分包括中心的丁型肝炎抗原(HDAg)和外膜的HBV的表面蛋白。HDV外膜由94% HBsAg、1%前S1与5%前S2蛋白构成,与HBV的22 nm小圆颗粒相似[9]。因此,HDV被认为是一种依赖于HBV的缺陷病毒。随后,国内学者[10]发现,国外基因工程表达的HDAg与我国人群血清中HDAg在空间结构上存在差异。1987年开始,国内学者从开始利用动物模型[11],到之后H1δ9细胞[12]、HepG2.9706细胞[13]等,围绕HDV的蛋白质多肽结构[14]、反义寡脱氧核苷酸[15]、核酶[16-18]展开了大量的基础实验,并进行相关方法学的探索。
1.1 免疫学检测方法的建立 早在1987年以前[19],国内已有学者开始应用聚丙烯酰胺凝胶电泳和免疫印迹法检测慢性HDV感染者血清中的HDAg,提高了检测方法的敏感度。并且,发现两种多肽抗原,大小分别约24 kD和27 kD。有学者[20]认为24 kD多肽片段是HDV复制的表达结果,能产生直接的细胞毒作用,这种作用是HDV感染时产生广泛细胞损伤的重要因素。27 kD多肽片段则起抑制HDV基因复制的作用,导致自限性感染的发生。随后,利用免疫印跡法证实了HDAg与HDV RNA密切相关。免疫印迹法的敏感度和特异度均好于酶联免疫法(ELISA)。但是,免疫印迹法技术相对复杂,且探针使用放射性同位素标记,存在放射性缺点等,限制其广泛应用[21]。1987年Pohl等[22]研制出人源性抗-HDV单克隆抗体,使检测抗-HDV或抗-HDV-IgM的ELISA试剂盒得到普及,并广泛应用于国内的流行病调查及诊断。二十世纪九十年代,国内的检测技术仍以ELISA和放射免疫法为主。
1.2 基因检测技术的建立 二十世纪九十年代,cDNA克隆建立的核酸分子杂交试验突破了当时HDV感染诊断的瓶颈[19]。PCR是二十世纪八十年代中期开始发展起来的体外核酸扩增技术。它具有特异、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;PCR原理是模拟自然复制将目的DNA片段快速扩增,便于观察。为提高HDV诊断的准确性,逆转录聚合酶链式反应(RT-PCR)技术被应用于HDV RNA扩增,并针对扩增产物进一步进行核酸杂交或测序[23]。反转录巢式PCR(RT-neste PCR)技术提高了HDV RNA检测敏感度和特异度。实时定量反转录PCR(RT-qPCR)是通过Ct值和标准曲线对核酸定量分析,其中应用荧光物质作为标记来判断核酸扩增的情况。RT-qPCR根据荧光物质的不同分为探针法和染料法。二十世纪九十年代正处于放射性探针及非放射性探针技术的发展阶段,敏感度、特异度仍需进一步提高,加之HDV有8种基因亚型,其HDV RNA检测结果存在一定差异。该技术主要应用于肝细胞内的核酸检测,当时未能普及[24]。近年,随着RT-qPCR流程的简化,从而降低了污染,节约了时间,精简了实验成本。微滴式数字PCR(ddPCR)实现了对病毒核酸的绝对定量,其敏感度和特异度均高于RT-qPCR,标本用量少;但技术复杂、成本高。近年已有建立ddPCR检测HDV RNA的研究报道[25],至今尚未广泛应用。环介导等温扩增技术是在60~65 ℃等温条件下,利用2~3对特异性引物与聚合酶循环合成DNA,已建立了检测HDV-1型的方法[26],为不同基因亚型的检测奠定了基础。随着分子生物学技术的发展,研究者开始尝试应用基因芯片技术,希望能为HDV的诊断提供一种快速、敏感、高效的方法[27-28]。
1.3 HDV感染动物模型研究 二十世纪八十年代,国内缺乏体外组织培养HDV系统,对HDV致病性、生物特性和免疫血清学的研究主要依靠于建立动物模型[11]。根据理论推测,认为能被提供HDV胞膜蛋白的嗜肝病毒所感染的动物,均可成为HDV的宿主。1984年,Ponzetto等[29]首次成功构建了土拨鼠肝炎病毒(WHV)模型,用感染HDV的黑猩猩血清成功感染了WHV感染过的土拨鼠,并将人类来源的HDV接种到慢性感染WHV的土拨鼠中。其血清学模式与之前在人类和黑猩猩感染中观察到的相似。在血清和肝组织中瞬时检测到δ抗原,随后血清转化为抗δ抗体。在急性HDV感染期间,土拨鼠的血清和肝细胞WHV标志物受到抑制。血清中WHV DNA的抑制仅在δ抗原阳性时明显,肝细胞中WHV标志物的抑制时间更长,在δ抗原转阴后的一段时间内,仍持续存在。肝组织学分析表明,实验性HDV感染土拨鼠急性肝炎的发生与肝细胞携带的WHV抗原丢失和再现相关。因此,乙型肝炎样病毒可能为HDV的复制提供了必要的辅助功能,土拨鼠模型适合于HDV病毒学和病理学方面的研究应用。相关研究[11]指出鸭乙型肝炎病毒也可以对HDV提供辅助。除了价格昂贵的黑猩猩动物模型以外,土拨鼠动物模型、北京鸭动物模型均可应用于HDV的相关研究[30]。此后,HDV感染的动物模型也成为HDV相关研究的热点之一。
二十世纪九十年代,以实验动物模型为载体,国内迎来了HDV相关研究的热潮。黑猩猩作为灵长类动物,可成为HDV的天然宿主。相关实验可模拟两种状态,即HBV/HDV联合感染和慢性HBsAg携带状态下接种HDV阳性血清的重叠感染,按照上述两种感染模式感染黑猩猩,宿主黑猩猩主要呈4种反应类型[11]。其中,两种反应类型均为联合感染时出现,但都为急性自限性过程。一种是肝细胞内HBcAg与HDAg同时阳性,经约10周左右的潜伏期,出现一过性的转氨酶高峰,达到中度或更为严重的肝脏炎症;另一种为HBcAg与HDAg依次在肝组织中分别呈阳性表达,与之对应的表现是转氨酶出现两个峰值,两峰的间隔时间10周左右。第三种反应类型为重叠感染时发生,是最为严重的一种,常见慢性化、进行性发展,可在数月或数年内死亡。但一般而言,黑猩猩的肝脏病变较人类感染时轻。第四种反应由HDV再次感染所致,尚未在人群中发现。但在国内,黑猩猩因受保护、数量少、研究成本高等因素使得应用受限。我国以树鼩为动物模型对HDV在体内的复制、表达,以及感染后肝组织的病理等也展开了研究[31]。树鼩感染HDV后导致的丁型肝炎的病理与人类极为相似,可呈现不同的疾病类型。实验[31]观察10只联合感染的树鼩,1周后出现不同程度的气球样变、点状或灶状性坏死、炎细胞浸润,之后发展不一。其中3只自愈,1只呈急性肝衰竭,6只慢性化。5只重叠感染的树鼩,肝脏病变分两个阶段,单纯感染HBV时,肝脏病变轻,重叠HDV后病变明显进展,均呈现慢性化。然而,树鼩是野生动物,无法人工繁殖,且品系不纯,从而使应用受阻。此外,尽管已证实土拨鼠动物模型可用于HDV病理学的研究,但因其为远交系动物,基因差异大,因此限制了土拨鼠在HDV感染研究中的应用。期间,国内外学者[32]先后尝试利用小鼠动物模型作为替代。从1993年开始,研究者尝试将HDV感染的土拨鼠血清用以感染成年CB17小鼠和重症免疫缺陷的CB-17-SCID小鼠,小鼠的肝细胞可一过性地检测出HDV基因组RNA和反义基因组RNA,以及HDAg的表达,但10~20天被彻底清除。该实验仅短时感染的原因与WHV合成的表面蛋白差异有关。1994年,为解决HDV种属特异性限制,多个研究小组尝试利用转基因技术建立HDV转基因小鼠模型[32]。此模型虽可用于HDAg功能的研究,但始终不适用于病理相关研究。1995年,有学者[33]开始研究水动力注射小鼠模型,此模型具有健全的免疫应答,操作简单,可用于基因突变等研究。但存在HDV侵入过程缺失、HDV清除快、水动力注射过程中可导致肝损伤的缺点。此阶段的小鼠模型研究,为下一阶段研究腺病毒转染小鼠、肝脏人源化小鼠、人钠离子牛磺胆酸共转运蛋白转基因小鼠、牛磺胆酸钠共转运多肽(sodium taurocholate co-transporting polypeptide, NTCP)人源化小鼠等功能性小鼠模型奠定了基础[34]。推动了二十一世纪对HDV生命周期、感染机制等的进一步研究。
1.4 核酶功能及应用研究 1988年,在HDV基因组中首次发现核酶,其包含两条具有自我剪切功能的配对RNA链,即基因链(位于688~689核苷酸)和抗基因链(位于903~904核苷酸)[19]。核酶是具有活性的RNA分子,可针对靶位点特异性剪切RNA。HDV核酶具有催化功能活性的主要是二级结构,但不同于类病毒、拟病毒以及高等植物卫星病毒的核酶,不是锤头状结构和发夹状結构。二十世纪九十年代,学者提出不同的HDV核酶模型[35],其中包括三叶草样结构、茎和发夹结构以及假结样结构等。比较公认的是假结样结构,其包含4个螺旋,从切点5′至3′端依次为Ⅰ、Ⅱ、Ⅲ、Ⅳ,螺旋Ⅲ在自我剪切中发挥最关键作用,螺旋Ⅱ对核酶的催化作用影响最小。核酶在体内的功能还受到二价阳离子的调控,已证实核酶在Mg2+、Ga2+等条件下可发挥活性[36]。HDV核酶在细胞内通过“双滚环”机制完成复制,新生产的RNA再由基因或反基因酶剪切成单体。二十世纪九十年代末,国内学者对HDV(但不仅限于HDV)的核酶展开了大量研究。有学者[36]认为敲除核酶相应的核苷酸位点,可阻止RNA在细胞内的滚动复制,为后期抗病毒药物的研发提供了思路。亦有研究者[37]将HDV核酶的结构进行改建,并应用于其他RNA病毒的剪切,在实验中成功剪切HCV RNA。截至本世纪,学者通过计算机分析,认识到HDV的核酶是HBV单链RNA,单链RNA在折叠过程中受到“假结”的影响,折叠存在快、慢两条路径[38]。
2 HDV的临床研究发展
我国丁型肝炎的相关临床研究早期即与国际接轨,早在二十世纪八十年代就开始了流行病学研究。1984年,许健音[39]报道224例HBsAg阳性患者的血清抗-HDV检出率为2%。郝连杰[9]报道武汉地区111例HBsAg阳性患者的肝组织内HDAg阳性检出率为8.9%;孙南雄[40]报道,江苏地区抽样检测HBsAg阳性患者中HDAg阳性检出率为2.6%。1990—1999年达到了丁型肝炎文献发表的高峰阶段,2000年以后HDV研究热潮逐渐消退(图1),国内对丁型肝炎的重视程度不足。2016年以前,国家卫生健康委员会官方网站中的全国法定传染病报告缺少丁型肝炎的相关数据[41]。
丁型肝炎是由HDV引起的一种人群普遍易感的传染病,肝脏为主要靶器官[42]。与HBV传播途径一致,以血液、体液,以及不洁性生活史或母婴垂直传播为主。HDV分为重叠感染和联合感染两种形式[43]。重叠感染是以HDV/HBV的形式感染HBV慢性感染者。90%急性HDV重叠感染者可发生慢性化,仅10%可能自愈。在90%慢性化的HDV重叠感染者中肝病病情可向纤维化、肝硬化,甚至肝细胞癌发展。联合感染以HDV/HBV形式传染健康者。90% HDV/HBV联合感染者可自发清除病毒,仅5%可出现严重的肝脏疾病,随后出现暴发性肝衰竭,或慢性化,逐渐发展至肝硬化、肝细胞癌。
2.1 诊断方法 检测血清HDV RNA是诊断HDV感染的最可靠方法,但前文提到HDV基因组G+C含量高,PCR技术难度大,虽有一些研究建立PCR检测HDV RNA的报道,但至今国内仍无商品化试剂。在我国,丁型肝炎的筛查以HDAg或抗-HDV-IgM/IgG的商品化试剂应用为主。然而,HDAg、抗-HDV-IgM和抗-HDV-IgG出现阳性的概率并不恒定,会随HDV感染时间的变化而改变。无论是急性丁型肝炎(重叠感染或联合感染),还是慢性丁型肝炎,在抗病毒治疗前HDV RNA阳性率相对稳定。因此,仅仅以HDAg、抗体作为诊断依据,存在漏诊与误诊的可能,需进一步评估HDV RNA。已有研究[44]显示,检测血清抗-HDV-IgG阴性的225例转氨酶升高的HBsAg阳性患者,其HDV RNA的阳性率达到4.9%。而近年国内部分研究团队报道的HDV感染率差异较大,可能与检测方法有关。庄辉院士团队[45]报道了一项3 131例患者的研究,包括10个省市,其中仅内蒙、新疆、北京和湖南存在阳性病例,血清抗-HDV-IgG的检出率分别为1.81%、0.88%、0.28%、1.00%。牛俊奇教授团队[46]报道了一项9 863例患者的研究,包括11个省,血清抗-HDV-IgG总检出率为1.37%,HDV RNA的检出率为1.31%;其中内蒙古、新疆地区血清抗-HDV-IgG阳性检出率分别为13.94%、3.89%。
2.2 临床特征 HDV/HBV慢性感染者与单一HBV感染相比,更容易加快促进肝病的进展,发生肝硬化、肝癌的风险明显增加[47-48]。HDV慢性感染约90%会发展为慢性肝炎,发生肝衰竭、肝硬化、肝癌等终末期肝病,其发生不良结局的风险较乙型肝炎明显增加。1988—1998年,国内纵向临床研究证实,经血清学和/或肝组织检测证实为HDV/HBV感染的507例患者中,92例慢加急性肝衰竭的病死率为66.3%,显著高于同期22例HBV单一感染的慢加急性肝衰竭住院患者的病死率(22.7%)[49]。1995年,国内横断面研究[50]也证实在肝癌、肝硬化等终末期肝病患者的肝组织中,其HDAg的检出率高于急性乙型肝炎和其他非特异性肝组织改变患者。2022年,毛青教授团队[51]总结了10年丁型肝炎的临床资料,发现入院后28天HDV/HBV慢性感染者有81.53%发展为终末期肝病,其中慢加急性肝衰竭占48.89%,肝细胞癌占33.33%,肝硬化占25.58%,慢性重度肝炎占18.92%。2022年,段钟平教授团队[52]报道丁型肝炎在慢性HBV相关性肝病中的阳性检出率结果显示,慢加急性肝衰竭为5.9%,肝纤维化为2.3%,肝细胞癌为2.2%。2022年鲁晓擘教授团队[53]报道的新疆地区264例HBV感染者的临床研究结果显示,慢性乙型肝炎患者HDV血清学标志物阳性检出率为13.46%,HBV相关肝硬化和肝癌患者HDV血清学标志物阳性检出率为12.43%,肝衰竭患者HDV血清学标志物阳性检出率为20.83%。因此,丁型肝炎加重肝脏疾病已得到临床研究的证实,早诊断、早治疗非常重要。
2.3 治疗进展 国外各肝病权威指南[54-56]推荐长效干扰素(PEG-IFNα)为目前唯一治疗慢性丁型肝炎的药物,但疗效不佳[57]。而且,由于干扰素相关副作用,不适用于重症和终末期肝病患者。很长一段时间,由于抗HDV治疗药物的缺失,使得HDV临床治疗受限。随着对HDV感染宿主的生命周期有了更深入的了解,研究[58]发现HDV通过HBsAg包膜糖蛋白附着于宿主细胞,通过NTCP转运进入肝细胞从而感染宿主细胞。相关药物研究[59]针对这一靶点,竞争性地与NTCP结合,从而阻止病毒进入尚未感染的肝细胞。同样,HDV感染宿主的生命周期的其他环节也可作为抗病毒的靶点[60]。例如,抑制HBsAg亚病毒颗粒的合成,进而防治HDV的释放;以及干扰HDAg的法尼基化,从而干扰HDV的装配等。
3 小结与展望
从二十世纪八十年代开始,我国学者针对HDV进行了大量的基础实验和临床研究,为深入了解HDV的生物学特点、致病机制,以及临床研究的进一步发展奠定了基础。但是,存在早期的文章质量不高、临床研究大多为回顾性研究、病理研究较少、国内缺乏病毒生物学的相关研究等不足。随着时间的推移,我国HDV基础研究的实验方法学以及丁型肝炎临床研究水平逐年推进,丁型肝炎日益受到重视。近年,随着分子生物学技术的提高,对HDV了解的更加深入,在临床流行病学、实验室诊断和相关药物的研发方面取得了进展。未来,有望在HDV的分子诊断技术、发病机制以及新药研发方面获得突破。期待敏感度和特异度较高的ddPCR方法能更快、更广泛地应用于临床检测HDV RNA,以提高丁型肝炎临床筛查的准确性。抗HDV治疗的新药上市,为HDV感染者带来了希望,也为我国丁型肝炎的规范化诊疗管理提供了保障。
参考文献:
[1]RIZZETTO M, CANESE MG, ARIC S, et al. Immunofluorescence detection of new antigen-antibody system (delta/anti-delta) associated to hepatitis B virus in liver and in serum of HBsAg carriers[J]. Gut, 1977, 18(12): 997-1003. DOI: 10.1136/gut.18.12.997.
[2]RIZZETTO M, HOYER B, CANESE MG, et al. delta Agent: association of delta antigen with hepatitis B surface antigen and RNA in serum of delta-infected chimpanzees[J]. Proc Natl Acad Sci U S A, 1980, 77(10): 6124-6128. DOI: 10.1073/pnas.77.10.6124.
[3]LU WL. Hepatitis δ factor: Hepatitis D[J]. Foreign Med Sci (InternMed), 1985, 12(3): 133-134.
陸玮伦. δ肝炎因子: 丁型病毒性肝炎[J]. 国外医学(内科学分册), 1985, 12(3): 133-134.
[4]LI QX, REN ZY. Advances in the research of hepatitis virus[J]. Chin J Nature, 1987, 10(10): 768-772.
李秋香, 任中原. 肝炎病毒的研究进展[J]. 自然杂志, 1987, 10(10): 768-772.
[5]LIANG LT. Hepatitis D (hepatitis δ)[J]. Med J Natl Defend Forces Northwest China, 1986(4): cover three, cover four.
梁烈庭. 丁型肝炎(δ肝炎)[J]. 西北国防医学杂志, 1986(4): 封三, 封四.
[6]CHEN DS, LAI MY, SUNG JL. Delta agent infection in patients with chronic liver diseases and hepatocellular carcinoma—an infrequent finding in Taiwan[J]. Hepatology, 1984, 4(3): 502-503. DOI: 10.1002/hep.1840040324.
[7]GOVINDARAJAN S, LEE SD, TONG MJ, et al. Prevalence of delta agent among Chinese in Taiwan and Los Angeles[J]. J Med Virol, 1984, 14(1): 33-37. DOI: 10.1002/jmv.1890140106.
[8]SHARMEEN L, KUO MY, DINTER-GOTTLIEB G, et al. Antigenomic RNA of human hepatitis delta virus can undergo self-cleavage[J]. J Virol, 1988, 62(8): 2674-2679. DOI: 10.1128/JVI.62.8.2674-2679.1988.
[9]HAO LJ. Hepatitis D virus infection[J]. Jiangsu Med J, 1989(5): 265-266.
郝连杰. 丁型肝炎病毒感染[J]. 江苏医药, 1989(5): 265-266.
[10]SHAO LJ, ZHAN MY. Advances in the research for Molecular biology of hepatitis D virus[J]. Chin J Public Health, 1992, 11(5): 313-315, 320.
邵立军, 詹美云. 丁型肝炎病毒分子生物学的研究进展[J]. 中国公共卫生学报, 1992, 11(5): 313-315, 320.
[11]ZHANG YY, HAO LJ. Recent development of studies for experimental infection and animalmodel of Hepatitis D virus [J]. Foreign Med Sci (Epidemiol Loimol), 1989(2): 71-73.
张永源, 郝连杰. 丁型肝炎病毒实验感染与动物模型研究近况[J]. 国外医学(流行病学传染病学分册), 1989(2): 71-73.
[12]LI HW, MAO Q, LI QF. Inhibitory effect of replication and expression of HDV by antisense oligonucleotides in H1δ9 cell[J]. Chin J Hepatol, 1999, 7(1): 13. DOI: 10.3760/j.issn:1007-3418.1999.01.006.
李宏文, 毛青, 李奇芬. 反义寡核苷酸对H1δ9细胞中丁型肝炎病毒基因复制与表达的抑制作用[J]. 中华肝脏病杂志, 1999, 7(1): 13. DOI: 10.3760/j.issn:1007-3418.1999.01.006.
[13]GUO HZ, MAO Q, LI QF, et al. Preliminary studies on the intracellular inhibiting activity of HDV ribozymes against HCV RNA[J]. J Third Milit Med Univ, 2004, 26(11): 960-962. DOI: 10.3321/j.issn:1000-5404.2004.11.008.
郭煥珍, 毛青, 李奇芬, 等. HepG2.9706细胞内HDV核酶对HCV RNA抑制活性的初步研究[J]. 第三军医大学学报, 2004, 26(11): 960-962. DOI: 10.3321/j.issn:1000-5404.2004.11.008.
[14]LI QF, ZHENG H, WU CQ, et al. Application of synthetic 27 oligopeptide of HDV antigen for detecting serum anti-HD in HBV infected subjects in Chongqing [J]. Chin J Intern Med, 1994, 33(4): 237-240.
李奇芬, 郑红, 吴纯清, 等. 应用丁型肝炎病毒27肽抗原检测丁型肝炎病毒抗体[J]. 中华内科杂志, 1994, 33(4): 237-240.
[15]MAO Q, WANG SQ, LI QF, et al. Antiviral effect of an antisense phosphorothioate oligodeoxynucleotides complementary to the nucleotides seqience of genomic HDV ribozyme[J]. Immunol J, 1996, 12(1): 5-8.
毛青, 王升启, 李奇芬, 等. 反义寡脱氧核苷酸抗丁型肝炎病毒的作用[J]. 免疫学杂志, 1996, 12(1): 5-8.
[16]MAO Q. Research Advance of hepatitis D virus ribozyme[J]. Foreign Med Sci (Epidemiol Loimol), 1995, 22(5): 216-219.
毛青. 丁型肝炎病毒核酶研究进展[J]. 国外医学(流行病学传染病学分册), 1995, 22(5): 216-219.
[17]MAO Q, WANG SQ, LI QF, et al. Reverse transcription “nested” polymerase chain reaction for detection of HDV RNA in serum samples[J]. Chin J Med Lab Sci, 1996, 19(2): 83-85.
毛青, 王升启, 李奇芬, 等. 聚合酶链反应检测血清丁型肝炎病毒核酸[J]. 中华医学检验杂志, 1996, 19(2): 83-85.
[18]MAO Q, WANG SQ, LI QF, et al. Inhibition of genomic HDV ribozyme activity by antisense oligodeoxynucleotides[J]. Chin Med J, 1996, 76(1): 30-33.
毛青, 王升启, 李奇芬, 等. 反义寡脱氧核苷酸抑制丁型肝炎病毒基因链核酶活性的作用[J]. 中华医学杂志, 1996, 76(1): 30-33.
[19]WAN H. Laboratory diagnosis of hepatitis D virus infection[J]. J Guangxi Med Univ, 1995, 12(1): 168-171.
万红. 丁型肝炎病毒感染的实验室诊断[J]. 广西医科大学学报, 1995, 12(1): 168-171.
[20]CHAO M, HSIEH SY, TAYLOR J. Role of two forms of hepatitis delta virus antigen: evidence for a mechanism of self-limiting genome replication[J]. J Virol, 1990, 64(10): 5066-5069. DOI: 10.1128/JVI.64.10.5066-5069.1990.
[21]BUTI M, ESTEBAN R, JARDI R, et al. Chronic delta hepatitis: detection of hepatitis delta virus antigen in serum by immunoblot and correlation with other markers of delta viral replication[J]. Hepatology, 1989, 10(6): 907-910. DOI: 10.1002/hep.1840100602.
[22]POHL C, BAROUDY BM, BERGMANN KF, et al. A human monoclonal antibody that recognizes viral polypeptides and in vitro translation products of the genome of the hepatitis D virus[J]. J Infect Dis, 1987, 156(4): 622-629. DOI: 10.1093/infdis/156.4.622.
[23]LIU BY, RAO HY. Research progress on the detection method of hepatitis D[J]. Chin J Hepatol, 2022, 30(10): 1022-1025. DOI: 10.3760/cma.j.cn501113-20221019-00504.
劉百怡, 饶慧瑛. 丁型肝炎检测方法研究进展[J]. 中华肝脏病杂志, 2022, 30(10): 1022-1025. DOI: 10.3760/cma.j.cn501113-20221019-00504.
[24]NIU JZ, GUO KJ, EDWARDS P, et al. Application of Digoxigenin-labeled RNA probe in hepatitis D virus nucleic acid hybridization[J]. Virologica Sin, 1992, 7(2): 160-165.
牛建章, 郭可謇, EDWARDS P, 等. 异羟基洋地黄毒甙元(Digoxigenin)标记的RNA探针在丁型肝炎病毒核酸杂交中的应用[J]. 中国病毒学, 1992, 7(2): 160-165.
[25]XU L, ZHANG X, CAO Y, et al. Digital droplet PCR for detection and quantitation of hepatitis delta virus[J]. Clin Transl Gastroenterol, 2022, 13(7): e00509. DOI: 10.14309/ctg.0000000000000509.
[26]WANG C, SHEN X, LU J, et al. Development of a reverse transcription-loop-mediated isothermal amplification (RT-LAMP) system for rapid detection of HDV genotype 1[J]. Lett Appl Microbiol, 2013, 56(3): 229-235. DOI: 10.1111/lam.12039.
[27]TAN WJ, ZHAN MY, YI YJ, et al. Screening, cloning and analysis of gene heterogeneity of antigen coding region for HDV cDNA in different regions and populations in China[J]. Virologica Sin, 1996, 11(3): 244-250.
谭文杰, 詹美云, 易炎杰, 等. 中国不同地区和人群HDV cDNA的筛选、克隆及抗原编码区基因异质性的分析[J]. 中国病毒学, 1996, 11(3): 244-250.
[28]SUN ZH, ZHENG WL, ZHANG B, et al. Preparation of the microarray for detecting hepatitis D virus[J]. J The First Military Med Univ, 2004, 24(1): 44-46, 49. DOI: 10.3321/j.issn:1673-4254.2004.01.013.
孙朝晖, 郑文岭, 张宝, 等. 基因芯片技术检测丁型肝炎病毒的研究[J]. 第一军医大学学报, 2004, 24(1): 44-46, 49. DOI: 10.3321/j.issn:1673-4254.2004.01.013.
[29]PONZETTO A, COTE PJ, POPPER H, et al. Transmission of the hepatitis B virus-associated delta agent to the eastern woodchuck[J]. Proc Natl Acad Sci U S A, 1984, 81(7): 2208-2212. DOI: 10.1073/pnas.81.7.2208.
[30]JIN ZH, YANG B, YANG XA, et al. Hepatitis D virus marmota monax woodchuck hepatitis virus[J]. Chin J Virol, 1990, 6(1): 74-76.
金志宏, 杨波, 杨小昂, 等. 丁型肝炎病毒感染东方土拔鼠的实验研究[J]. 病毒学报, 1990, 6(1): 74-76.
[31]LI QF, MAO Q, WU CQ, et al. Pathological observation of the liver on experimental hepatitis in tupaiae [J]. Chin J Hepatol, 1996, 4(4): 210-213.
李奇芬, 毛青, 吴纯清, 等. 树鼩实验性丁型肝炎的病理观察[J]. 中华肝脏病杂志, 1996, 4(4): 210-213.
[32]GUILHOT S, HUANG SN, XIA YP, et al. Expression of the hepatitis delta virus large and small antigens in transgenic mice[J]. J Virol, 1994, 68(2): 1052-1058. DOI: 10.1128/JVI.68.2.1052-1058.1994.
[33]POLO JM, LIM B, GOVINDARAJAN S, et al. Replication of hepatitis delta virus RNA in mice after intramuscular injection of plasmid DNA[J]. J Virol, 1995, 69(8): 5203-5207. DOI: 10.1128/JVI.69.8.5203-5207.1995.
[34]ZHOU ZM, LI WH. Research progress on animal models of hepatitis D infection[J]. Chin J Viral Dis, 2021, 11(6): 431-437. DOI: 10.16505/j.2095-0136.2021.0055.
周忠敏, 李文輝. 丁型肝炎病毒感染动物模型的研究进展[J]. 中国病毒病杂志, 2021, 11(6): 431-437. DOI: 10.16505/j.2095-0136.2021.0055.
[35]WU HN, WANG YJ, HUNG CF, et al. Sequence and structure of the catalytic RNA of hepatitis delta virus genomic RNA[J]. J Mol Biol, 1992, 223(1): 233-245. DOI: 10.1016/0022-2836(92)90728-3.
[36]YUE YC, MAO Q. Hepatitis D virus ribozyme and its application[J]. Foreign Med Sci (Microbiol), 1999, 22(3): 3-5.
于乐成, 毛青. 丁型肝炎病毒核酶及其应用[J]. 国外医学(微生物学分册), 1999, 22(3): 3-5.
[37]YU YC, GU CH, MAO Q, et al. Reconstruction of hepatitis D virus ribozymes and their ability to trans-cleave hepatitis C virus RNA[J]. Chin J Hepatol, 2001, 9(3): 157-159. DOI: 10.3760/j.issn:1007-3418.2001.03.010.
于乐成, 顾长海, 毛青, 等. 丁型肝炎病毒核酶结构改建及其对丙型肝炎病毒RNA的剪切活性[J]. 中华肝脏病杂志, 2001, 9(3): 157-159. DOI: 10.3760/j.issn:1007-3418.2001.03.010.
[38]ZOU YJ, ZHANG XL, LIAO K. Backtracking search for the folding pathway of the hepatitis delta virus ribozyme[J]. J Pingxiang Univ, 2020, 37(3): 79-84. DOI: 10.3969/j.issn.1007-9149.2020.03.016.
邹彦娟, 张小龙, 廖昆. 回溯搜索丁型肝炎病毒核酶的折叠路径[J]. 萍乡学院学报, 2020, 37(3): 79-84. DOI: 10.3969/j.issn.1007-9149.2020.03.016.
[39]XU JY. Detection of δ antigen and anti-δ antibody in north China[J]. Chin J Microbiol Immunol, 1984, 4(2): 127-129. DOI: 10.3760/cma.j.issn.0254-5101.1984.02.120.
许健音. 我国北方一些地区δ抗原及其抗体的检测[J]. 中华微生物学和免疫学杂志, 1984, 4(2): 127-129. DOI: 10.3760/cma.j.issn.0254-5101.1984.02.120.
[40]SUN NX. A preliminary report on the status of hepatitis D infection in Jiangsu Province[J]. J Nanjing Med Coll, 1987, 7(3): 173.
孙南雄. 江苏省D型肝炎感染状况的研究初报[J]. 南京医学院学报, 1987, 7(3): 173.
[41]Bureau of Disease Control, Prevention and Control, 2015 National Epidemic Situation of Statutory Infectious Diseases[EB/OL]. http://www.nhc.gov.cn/jkj/s6873/201602/b9217ba14e17452aad9e45a5bcce6b65.shtml.
疾控预防控制局. 2015年全国法定传染病疫情概况[EB/OL]. http://www.nhc.gov.cn/jkj/s6873/201602/b9217ba14e17452aad9e45a5bcce6b65.shtml.
[42]HUGHES SA, WEDEMEYER H, HARRISON PM. Hepatitis delta virus[J]. Lancet, 2011, 378(9785): 73-85. DOI: 10.1016/S0140-6736(10)61931-9.
[43]MIAO Z, ZHANG S, OU X, et al. Estimating the global prevalence, disease progression, and clinical outcome of hepatitis delta virus infection[J]. J Infect Dis, 2020, 221(10): 1677-1687. DOI: 10.1093/infdis/jiz633.
[44]WU S, ZHANG Y, TANG Y, et al. Molecular epidemiology and clinical characteristics of hepatitis delta virus (HDV) infected patients with elevated transaminases in Shanghai, China[J]. BMC Infect Dis, 2020, 20(1): 565. DOI: 10.1186/s12879-020-05275-1.
[45]
LIU YM, GUO XP, ZHANG HM, et al. An investigation of hepatitis D virus infection among patients with chronic hepatitis B virus infection in some regions of China[J]. J Clin Hepatol, 2023, 39(4): 795-803. DOI: 10.3969/j.issn.1001-5256.2023.04.009.
刘玉梅, 郭小平, 张慧敏, 等. 我国部分地区慢性HBV感染者HDV感染情况调查[J]. 临床肝胆病杂志, 2023, 39(4): 795-803. DOI: 10.3969/j.issn.1001-5256.2023.04.009.
[46]ROGGENBACH I, CHI X, LEMPP FA, et al. HDV seroprevalence in HBsAg-positive patients in China occurs in hotspots and is not associated with HCV mono-infection[J]. Viruses, 2021, 13(9): 1799. DOI: 10.3390/v13091799.
[47]DA BL, HELLER T, KOH C. Hepatitis D infection: from initial discovery to current investigational therapies[J]. Gastroenterol Rep (Oxf), 2019, 7(4): 231-245. DOI: 10.1093/gastro/goz023.
[48]XUE F, WEI L. Summary for hepatitis D research reports from EASL 2022[J]. Chin J Hepatol, 2022, 30(10): 1120-1123. DOI: 10.3760/cma.j.cn501113-20221019-00500.
薛峰, 魏來. 2022年欧洲肝病学会年会关于慢性丁型肝炎研究的进展[J]. 中华肝脏病杂志, 2022, 30(10): 1120-1123. DOI: 10.3760/cma.j.cn501113-20221019-00500.
[49]GU XH, LI QF, WANG YM. Analysis of clinical characteristics of 507 cases of Hepatitis with HDV infection[J]. J Third Milit Med Univ, 2000, 22(2): 185-188. DOI: 10.3321/j.issn:1000-5404.2000.02.026.
顾小红, 李奇芬, 王宇明. 507例HDV感染肝炎患者临床研究[J]. 第三军医大学学报, 2000, 22(2): 185-188. DOI: 10.3321/j.issn:1000-5404.2000.02.026.
[50]ZHAO GR, HUANG XX, ZHAO DT. Prevalence of hepatitis D in China[J]. J Clin Hepatol, 1995, 11(4): 179-180.
赵国瑞, 黄宪希, 赵大同. 国内丁型肝炎流行概况[J]. 临床肝胆病杂志, 1995, 11(4): 179-180.
[51]LIU HM, TAN ZX, YANG J, et al. Prevalence and clinical characteristics of hepatitis D in Southwest of China[J]. Chin J Exp Clin Virol, 2022, 36(1): 85-91. DOI: 10.3760/cma.j.cn112866-20210611-00096.
刘慧敏, 谭朝霞, 杨京, 等. 中国西南地区丁型肝炎的流行状况与临床特征分析[J]. 中华实验和临床病毒学杂志, 2022, 36(1): 85-91. DOI: 10.3760/cma.j.cn112866-20210611-00096.
[52]ZHOU HB, REN F, CHEN Y, et al. HDV infection in chronic hepatitis B virus infected patients with different disease phases in China[C]. 32nd annual meeting of the Asian-Pacific Association for the Study of the Liver. Taipei, 2023.
[53]ZHENG RJ, TANGNUER·TLF, DENG ZR, et al. Sero-epidemiological characteristics of the hepatitis D virus infection among hepatitis B virus infected-patients at a single center in Xinjiang region[J]. Chin J Hepatol, 2022, 30(10): 1044-1049. DOI: 10.3760/cma.j.cn501113-20220406-00169.
郑嵘炅, 唐努尔·塔拉甫, 邓泽润, 等. 新疆地区单中心乙型肝炎病毒感染者中丁型肝炎病毒感染的血清流行病学特点[J]. 中华肝脏病杂志, 2022, 30(10): 1044-1049. DOI: 10.3760/cma.j.cn501113-20220406-00169.
[54]SARIN SK, KUMAR M, LAU GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update[J]. Hepatol Int, 2016, 10(1): 1-98. DOI: 10.1007/s12072-015-9675-4.
[55]European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398. DOI: 10.1016/j.jhep.2017.03.021.
[56]TERRAULT NA, LOK A, MCMAHON BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599. DOI: 10.1002/hep.29800.
[57]ABDRAKHMAN A, ASHIMKHANOVA A, ALMAWI WY. Effectiveness of pegylated interferon monotherapy in the treatment of chronic hepatitis D virus infection: A meta-analysis[J]. Antiviral Res, 2021, 185: 104995. DOI: 10.1016/j.antiviral.2020.104995.
[58]YAN H, ZHONG G, XU G, et al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus[J]. Elife, 2012, 1: e00049. DOI: 10.7554/eLife.00049.
[59]KOH C, DA BL, GLENN JS. HBV/HDV coinfection: A challenge for therapeutics[J]. Clin Liver Dis, 2019, 23(3): 557-572. DOI: 10.1016/j.cld.2019.04.005.
[60]LOUREIRO D, CASTELNAU C, TOUT I, et al. New therapies for hepatitis delta virus infection[J]. Liver Int, 2021, 41 Suppl 1: 30-37. DOI: 10.1111/liv.14838.
收稿日期:
2023-02-15;錄用日期:2023-03-16
本文编辑:葛俊
