杨树和栓皮栎日光诱导叶绿素荧光及光能利用率的比较*
2023-04-26程向芬任成昊张劲松胡美均蒋丽娅胡海洋乔永胜
程向芬,任成昊,张劲松,胡美均,蒋丽娅,胡海洋,黄 辉**,乔永胜
杨树和栓皮栎日光诱导叶绿素荧光及光能利用率的比较*
程向芬1,2,任成昊3,张劲松1,2,胡美均1,2,蒋丽娅4,胡海洋5,黄 辉1,2**,乔永胜6
(1.中国林业科学研究院林业研究所/国家林业和草原局林木培育重点实验室,北京 100091;2.河南黄河小浪底地球关键带国家野外科学观测研究站,济源 459007;3.青岛农业大学机电工程学院,青岛 266109;4.河南农业大学林学院,郑州 450002;5.北京林业大学生态与自然保护学院,北京 100083;6.国有济源市南山林场,济源 459000)
为探究杨树与栓皮栎光合光能利用率(LUEp)和荧光光能利用率(LUEf)关系的日内变化及种间差异,从光能分配的角度进一步深入理解日光诱导叶绿素荧光(SIF)与总初级生产力(GPP)的关系,以典型落叶阔叶林树种杨树(×)和栓皮栎(BI.)幼苗为对象,在相同土壤水分和养分条件下,观测研究不同树种SIF、净光合速率(Pn)与LUEp/LUEf对光合有效辐射(PAR)响应的异同。结果表明:(1)SIF受PAR驱动,二者呈显著正相关关系,杨树和栓皮栎线性拟合决定系数(R2)分别为0.965和0.973,且杨树具有更高的LUEf;Pn随PAR的增加逐渐饱和,杨树光饱和点明显高于栓皮栎,分别为998.59和674μmolCO2·m−2·s−1。(2)杨树和栓皮栎Pn均随着SIF的增大呈先上升变化,之后杨树的Pn逐渐饱和,栓皮栎则缓慢下降。(3)LUEp与LUEf呈显著负线性相关关系,LUEp/LUEf随光强的增加呈指数型逐渐下降趋势,变化规律及大小在树种间不存在明显差异。研究结果说明,在日内随PAR的升高,LUEf变化较小,而LUEp则下降明显,光能分配向碳固定的比例下降,因此,Pn在强光下饱和,SIF与GPP在日内尺度表现出指数型相关关系,且该指数型关系在树种间一致。
日光诱导叶绿素荧光;净光合速率;光能利用率;光合有效辐射
光合作用是绿色植物吸收光能,将二氧化碳和水同化为自身有机物的过程,是生态系统碳收入的唯一途径和碳循环过程的开始,因此,准确评估植物的光合作用对研究全球生态系统能量与物质循环具有重要意义[1]。日光诱导叶绿素荧光(SIF)是光合反应中心接收太阳光能后发射的波长更长的光信号[2]。作为光合作用的伴生产物,SIF包含植被的生理、生化等信息,在准确评估光合作用的实际状态时具有较强的机理优势[3−4],为探测植被总初级生产力(GPP)提供了新的思路[5−6]。
光能利用率(LUE)是连接光吸收和碳固定、理解荧光与光合作用关系的关键参数,根据能量耗散途径的不同,可分为光合光能利用率(LUEp)和荧光光能利用率(LUEf)。GPP与SIF关联性的变化受到吸收的光合有效辐射(APAR)与LUEp/LUEf(光合光能利用率与荧光光能利用率的比值)的共同调节[4],对LUEf与LUEp关联性的认识不足是已有研究对SIF-GPP经验线性关系缺乏机理理解的重要原因[7]。研究LUEp和LUEf关联性及其对光强的响应过程,可从光能分配的角度加强对SIF-GPP的认识,该响应过程受到生长阶段、环境条件及植物光合能力的影响[7−9]。Yang等[8]研究温带混交林冠层SIF-GPP关联性时发现,LUEp与LUEf呈正相关关系,且LUEp与LUEf均随APAR的上升而升高。Miao等[7]研究发现,大豆LUEp与LUEf呈负相关关系,与对玉米的研究结果一致[9],且LUEp随APAR的上升而下降,LUEf则上升。Verma等[10]基于卫星遥感数据对草地植被进行研究,结果表明,草地植被LUEp与LUEf呈正相关关系,且LUEp与LUEf均随APAR的上升而上升。可见,物种间LUEp与LUEf的关系还存在较大争议,还需针对更多不同光合特性的植物开展研究。且目前相关研究多集中在LUEp与APAR的关系,而LUEf对APAR的响应及LUEp与LUEf关系的研究还较为缺乏。
杨树(×)是世界上分布最广、适应性最强的树种,主要分布在北半球温带及寒温带,遍及东北、西北、华北和西南等地,是人工林造林面积排名第二的树种,在中国人工林发展中具有重要的地位[11]。栓皮栎(BI.)在世界各地广泛栽种,在中国分布于西北、华北、华中、华南和西南地区,是暖温带地区地带性植被的主要落叶阔叶林树种之一[12]。相对杨树,栓皮栎光合生长速率较低[13−14]。为了从光能分配的角度加强对SIF-GPP的认识,了解不同生长速率树种之间LUEp/LUEf的异同性,本研究选择杨树和栓皮栎作为对象,在土壤水分及养分相同的状态下,分析探究不同树种之间LUEp、LUEf及LUEp/LUEf对PAR响应的异同性,以期为进一步加深对GPP和SIF的关联机制的认知水平,为生态环境建设决策的制定提供理论依据。
1 材料与方法
1.1 试验设计
试验在河南黄河小浪底地球关键带国家野外科学观测研究站内进行,试验材料为杨树扦插幼苗(1a生,树高1.2±0.05m)和栓皮栎实生苗(5a生,树高1.5±0.05m),两种试验材料均处于幼龄期,不同树种的林龄选择是出于树高和冠幅能够实现冠层SIF(日光诱导叶绿素荧光)的测量需求。每个树种选择生长均匀一致的6株作为试验材料。SIF观测日期为2021年7月14日,净光合速率(Pn)测量日期为2021年7月13−14日,观测期间天气晴朗,测量前一个月保持土壤体积含水量在20%~25%。
1.2 指标测定
1.2.1 冠层光谱
冠层光谱的采集采用多通道叶绿素荧光自动观测系统(AutoSIF-1,北京),该系统包含一台高分辨率光谱仪(QE65,Ocean Optics,USA)、电子快门及分析仪。光谱仪光谱范围640−805nm,光谱分辨率0.31nm,信噪比1000:1。三根光纤连接在光谱仪的一端,一根安装有余弦校正器并朝向天空用来采集向下太阳辐射,另两根裸光纤朝向冠层采集不同树种冠层发射的向上SIF,视场角为25°。采集的光谱信号在分析仪中进行收集处理。
设备安装在自制钢架顶部,裸光纤安装的垂直高度为2.5m,水平间隔为1.5m,方向垂直向下,正下方分别放置6盆杨树与栓皮栎,光纤距离冠层分别为1.3m和1m,保证视野内无其他物体干扰。光纤通道间的转换由电子快门控制,测量时先采集一次向下辐照度,然后采集地物1号通道中杨树冠层辐射亮度,之后采集一次向下辐照度,最后采集地物2号通道栓皮栎冠层辐射亮度为一次测量周期,进而计算冠层反射率等光谱信号,受外界光强影响,通道间采集时间间隔为7~50s,测量周期为15~120s。
SIF信号值的反演是基于荧光对夫琅禾费暗线吸收光谱“井”的填充作用实现的,对比填充后与填充前的暗线吸收深度,可以将SIF从反射率信号中反演出来[15−16]。为了减少叶片内部及冠层对SIF信号重吸收作用带来的影响,选取波长位于近红外峰值附近的760nm处的SIF进行分析。本研究采用基于辐射量度的SFM(spectral fitting method)反演算法[17],该算法假定“井”内外的反射率与SIF发射量和波长满足泰勒公式[18]。
1.2.2 光合参数
每个树种随机选择3棵进行光合作用测定,采用便携式光合仪(Li-6400XT,LI−COR,USA)测定杨树与栓皮栎的Pn及光响应曲线,测量Pn时选择2cm×3cm透明叶室,采用开放式气路,叶室温度为28±1℃,CO2浓度约为(380±5)μmol·mol−1,气体流速设置为500μmol·s−1。光响应曲线测定选择Li-6400-02B LED红蓝光源叶室,共设置16个PAR梯度,分别为2000、1800、1500、1200、1000、900、800、700、600、500、400、300、200、100、50和0μmol·m−2·s−1。每个PAR下适应180~300s后进行测定。测定时间在10:00−11:30及14:30−15:30,每棵选取3片完全展开的叶片,每个树种共9片,将9片叶片在对应光强下的Pn取平均值,作为该光强下对应树种的Pn。由于测量周期较长,因此,选择连续两天进行光合参数的测量,前后两天具有相似的天气条件。
根据叶子飘[19]植物光合作用对光响应的直角双曲线修正模型对平均后的Pn进行拟合,来模拟获得光响应曲线的光饱和点(LSP)和最大净光合速率(Pnmax)[20],即
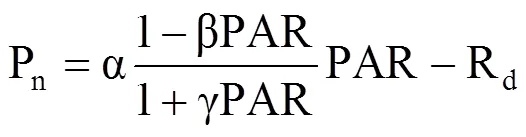
式中,Pn为净光合速率(μmol·m−2·s−1);PAR为光合有效辐射(μmol·m−2·s−1);α为初始量子效率(μmolCO2·μmol−1photons),Rd为暗呼吸速率(μmol·m−2·s−1),二者分别为PAR小于200 μmol·m−2·s−1时测量点拟合曲线的斜率与截距,Pn为0时对应的PAR值为植物的光补偿点(LCP);β为光抑制系数,γ为光饱和系数,均为修正系数。对式(1)积分并取值为0可获得LSP及对应的Pnmax,即
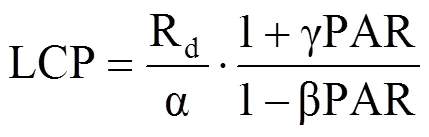
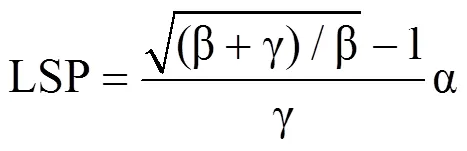
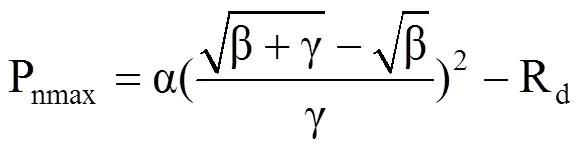
式中,Pnmax表示最大净光合速率(μmol·m−2·s−1),LSP为光饱和点(μmol·m−2·s−1),LCP表示光补偿点(μmol·m−2·s−1)。
1.2.3 光合有效辐射
光合有效辐射传感器(LI−190SB,LI−COR,USA)安装在空旷处,避免视野内其它物体遮挡,在日内测量光量子通量密度(PPFD,μmol·m−2·s−1),测量波段范围400−700nm。根据光响应曲线测量时采用的PAR梯度对测得的PAR进行分级,以便与Pn进行比较。在分级时,舍去PAR<25μmol·m−2·s−1时的数据。取相邻梯度的均值作为划分不同梯度的阈值,将上限划入相应等级,如:当PAR对应1200μmol·m−2·s−1时,其为取值范围(1100,1350]内PAR的平均值。
1.3 光能利用率计算
Monteith[21]基于光能吸收与植被生产力的关系,提出了估算GPP的LUEp模型,即
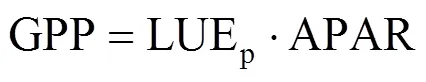
式中,LUEp为光合光能利用率(μmolCO2·μmol photon−1),代表了光能转换为生产力的效率,APAR为吸收的光合有效辐射(μmol·m−2·s−1)。借鉴 Monteith的思路,Berry等[22]提出了LUEf公式,即
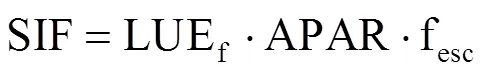
式中,LUEf为荧光光能利用率(又称荧光量子产率,μmol photon@760nm·μmol−1photon@ 400–700 nm),LUEf是连接光系统中的光能分配与冠层发射的SIF的关键参数[23],将为解释SIF-GPP关系提供机理支撑。fesc为冠层荧光逃逸系数(fluorescence escape ratio,fesc),本研究中试验材料冠层结构较简单,因此将fesc视为1[23]。综合以上得
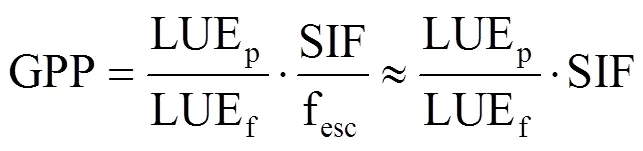
可见,光合作用和荧光发射量可以通过光能利用率相互转换。基于叶片尺度净光合速率和冠层SIF的测量,假设叶片上大部分的入射PAR均被吸收[24−25],吸收的光合有效辐射比例(FPAR)≈1,可得
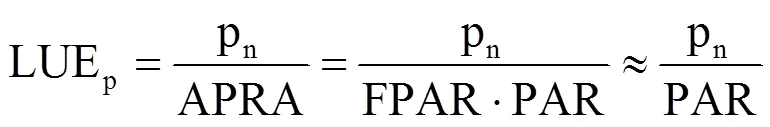
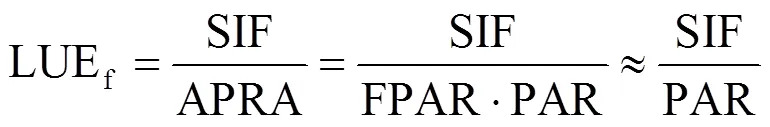
1.4 数据处理
依据同步测量的PAR等级对SIF进行平均,得到不同PAR等级下的SIF值,并进一步与光合参数进行分析。采用Python 3.7.4对SIF原始数据进行提取及计算,R 4.1.2统计软件进行皮尔逊相关性检验及单因素方差分析,P<0.01为极显著相关。采用Origin 2018绘图软件进行图表绘制。
2 结果与分析
2.1 两树种SIF和Pn对PAR响应的比较
2.1.1 日光诱导叶绿素荧光(SIF)
由图1可见,SIF的变化受PAR的驱动,二者具有极显著线性相关关系(P<0.01),SIF随PAR增大逐渐上升。线性拟合决定系数(R2)分别为0.965和0.973,均方根误差(RMSE)分别为1.410和1.278,杨树在PAR大于1000μmol·m−2·s−1时(图1a)、栓皮栎在PAR大于1200μmol·m−2·s−1时(图1b),数据点分布于拟合线上方。线性拟合斜率即LUEf在树种间存在明显差异,杨树的斜率大于栓皮栎,分别为9.604×10−4和8.001×10−4,表明在相同的辐射条件下,杨树的荧光发射量大于栓皮栎,杨树具有更高的LUEf。
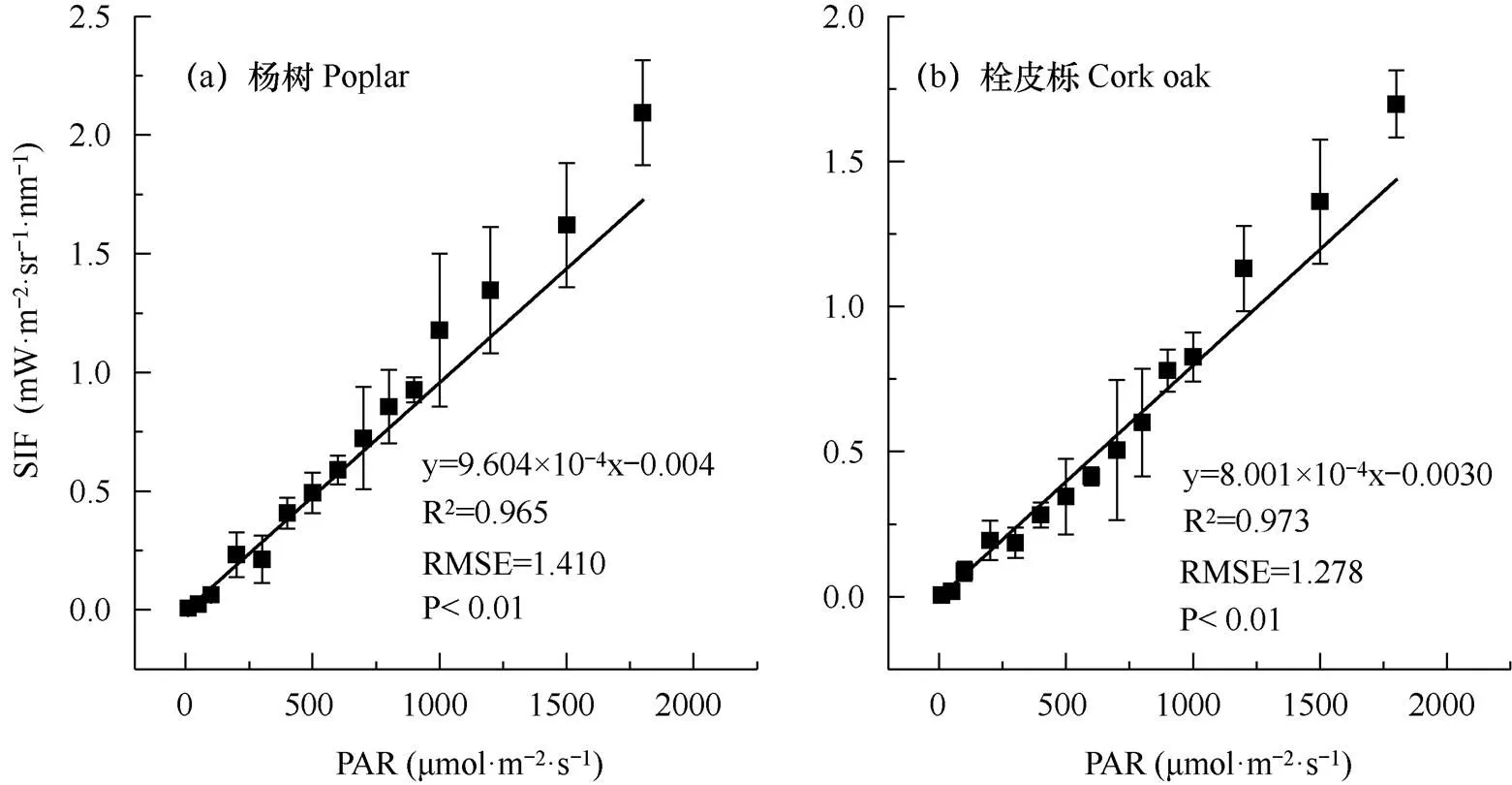
图1 两树种日光诱导叶绿素荧光(SIF)对光合有效辐射(PAR)的响应
注:2021年7月14日观测,短线表示标准误差。黑色实线代表线性拟合结果,方程为线性拟合方程,R2为拟合决定系数,RMSE为均方根误差。下同。
Note: Observation was on July 14, 2021, the bar is the standard error. The black solid line represents the linear regression, the equation is the linear fitting models, R2is the coefficient of determination, RMSE is the root mean square error. The same as below.
2.1.2 净光合速率(Pn)
从图2可知,杨树、栓皮栎在PAR分别低于500μmol·m−2·s−1和300μmol·m−2·s−1时,Pn对PAR的响应较为敏感,随PAR的增大快速上升,之后Pn随PAR上升的趋势逐渐变缓。在PAR高于500μmol·m−2·s−1时,栓皮栎Pn随PAR的升高出现持续下降的现象,表明较高的PAR对光合作用产生了抑制作用;杨树在PAR大于2000μmol·m−2·s−1时,Pn出现降低现象。
表1表明,LSP和LCP在树种之间存在明显差异,杨树和栓皮栎分别为998.59、674μmol·m−2·s−1和26.61、11.74μmol·m−2·s−1,杨树的LSP明显高于栓皮栎。杨树的最大光合速率(Pnmax)高于栓皮栎,分别为10.17和6.16μmolCO2·m−2·s−1。
2.2 两树种SIF与Pn关系的比较
由图3可见,杨树和栓皮栎Pn均随着SIF的增大先上升后达到饱和或下降,在SIF分别低于0.5和0.25mW·m−2·sr−1时,随SIF的增大快速上升,之后杨树Pn保持不变,栓皮栎Pn下降明显。Pn对SIF的响应与Pn对PAR的响应模式一致,是由于SIF与PAR具有较好的线性相关关系,较高的SIF对应较高的PAR,因此栓皮栎Pn下降明显,而杨树并未表现出明显的降低现象。
2.3 两树种LUEp/LUEf对PAR响应的比较
由图4可见,杨树和栓皮栎LUEp与LUEf之间均存在显著负线性相关关系(P<0.01)。随着LUEf的增大,LUEp持续降低,线性拟合具有较高的决定系数(R2),杨树和栓皮栎分别为0.74和0.86。杨树的LUEp下降速率高于栓皮栎。
如图5所示,LUEp/LUEf与PAR的关系在两个树种间较为一致,均随PAR的增大呈下降趋势,最大值出现在PAR最低时。PAR小于500μmol·m−2·s−1时,LUEp/LUEf下降趋势较陡,之后下降趋势变缓,PAR对LUEp/LUEf影响的敏感性减弱。除在PAR为50μmol·m−2·s−1时,栓皮栎的LUEp/LUEf高于杨树,其它情况下二者无明显差异。在生长季,白天PAR小于100μmol·m−2·s−1仅出现在日出或日落时刻附近,该时段太阳高度角较低,影响冠层上方传感器观测SIF,在数据分析中常被舍去。因此,分析基于塔基或卫星的SIF和GPP产品时,可忽略该时段的观测数据,故可认为,杨树和栓皮栎的SIF-GPP线性经验关系的斜率可能是相同的。结合LUEp/LUEf与PAR的关系及晴天PAR的日变化规律,LUEp/LUEf的日变化呈“倒U”型。LUEp/LUEf对PAR的响应模式为非线性,因此,二者的竞争关系受到PAR的调节,表现出了植物光合反应中心在光能调节分配策略上的适应性。
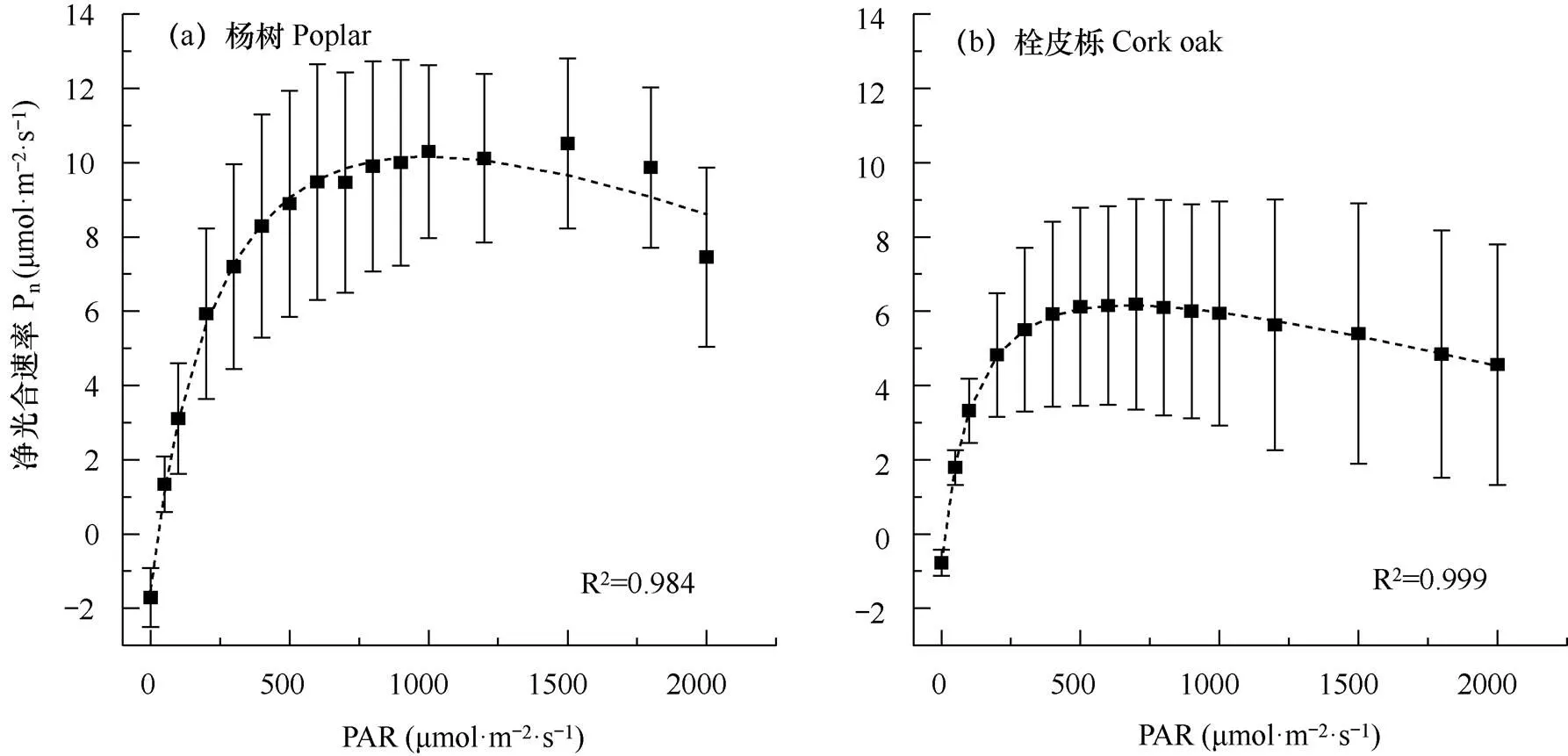
图2 两树种光合作用−光响应曲线
注:虚线为直角双曲线修正拟合模型。
Note:The dotted line is the fitting modified rectangular hyperbolic model. Pnis net photosynthetic rate.

表1 两树种最大净光合速率(Pnmax)、光饱和点(LSP)及光补偿点(LCP)的对比

图3 两树种SIF与净光合速率(Pn)的关系
注:虚线为指数拟合回归。
Note: The dotted line is the exponential fitting regression.
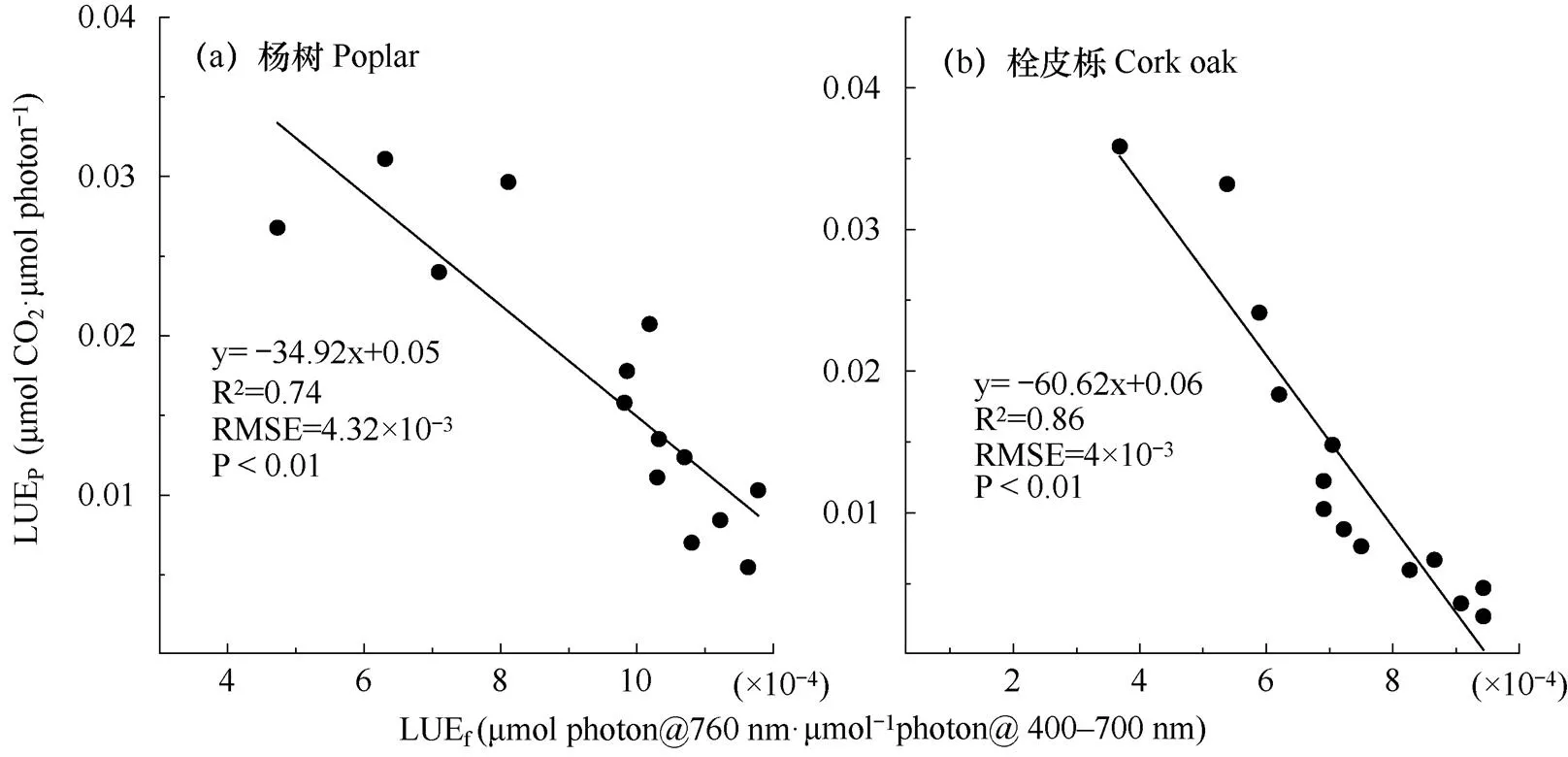
图4 两树种光合光能利用率(LUEp)与荧光光能利用率(LUEf)的关系
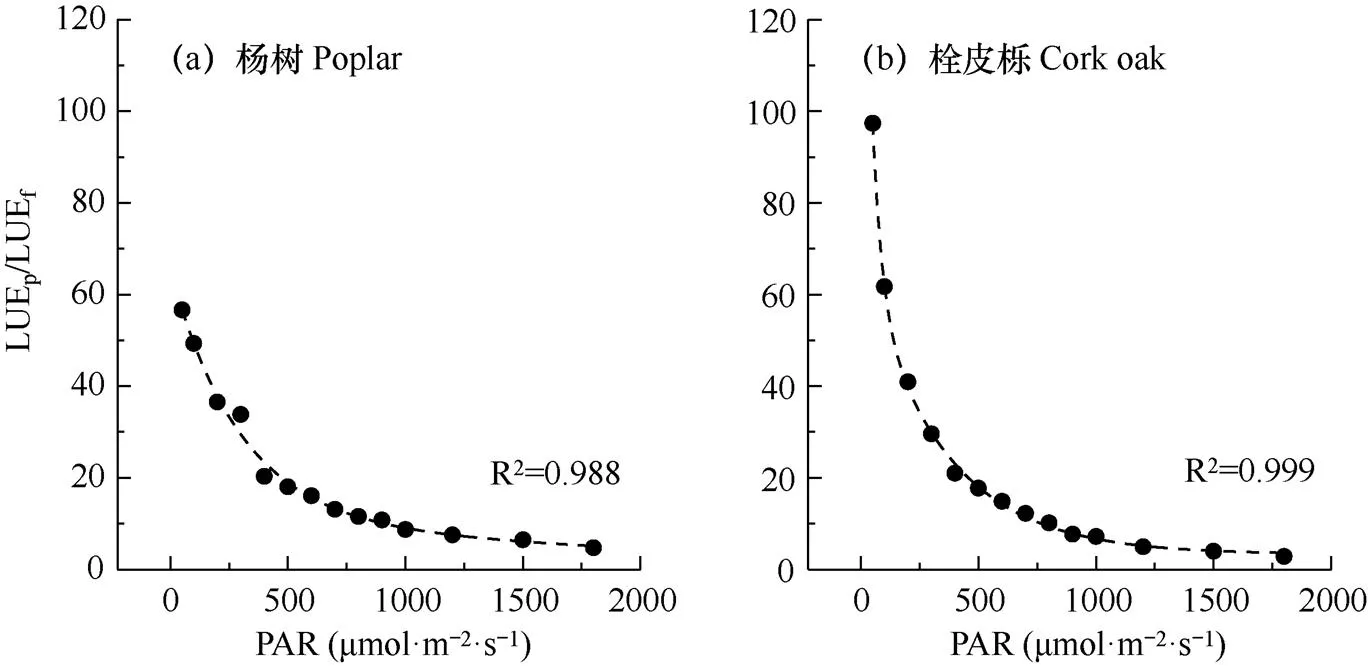
图5 两树种LUEp/LUEf对PAR的响应
3 讨论与结论
3.1 讨论
SIF随PAR的增加持续增加,二者呈较好的线性关系,并未出现明显的饱和现象。作为植物生长活动的能量来源,PAR对Pn的高低和SIF的发射量有直接作用[26]。APAR是地面观测SIF的关键驱动因子[23, 27],二者良好的相关性已经在多种生态系统中得到了证实[8, 28−29]。
杨树与栓皮栎在光合能力上存在明显差异,从光合生理角度,Pn可以直接反映单位叶面积的物质生产能力,是衡量植物生产速率的有效指标[30],杨树具有更高的Pn、LSP和Pnmax。从植物形态角度,杨树具有更大的全株总叶面积,根系发达,更有利于幼苗的生长[31]。在本研究中,随着PAR的增大,杨树与栓皮栎Pn均逐渐饱和,而SIF则继续增长,是由于受到最大羧化速率的限制[32],SIF与Pn之间的关系在日内是非线性的。因此本研究发现LUEp对光强敏感度较高,随PAR的升高逐渐下降,而LUEf对光的敏感度较低,日内变化较小[33−34]。可知,较高的光强未造成SIF的下降,仅造成对Pn的抑制[35]。二者线性关系的解耦是由于光合作用过程由光反应与暗反应构成,其中SIF仅参与了光反应中的光能吸收与传递过程,与电子传递链效率相关,而暗反应则是吸收CO2固定有机物的过程,因此,SIF的发射量仅与光反应过程有关[36]。
在强光下,叶片吸收过多的光后,为了避免光损伤,将多余的光能以荧光或热的形式释放,因此,荧光量子产率即LUEf随光强增加[5],胁迫条件下的非光化学猝灭(nonphotochemical quenching,NPQ)的升高是调节二者关系的关键因素[37];另一方面,强光伴随的高温条件会造成气孔关闭,胞内CO2含量的降低会造成光呼吸的增加[38],引起光合“午休”现象,因此光合光能利用率下降,进一步造成SIF与Pn线性关系的解耦,解耦的根本原因则是光反应与暗反应的不同步。已有研究证明抑制光合作用的不同过程会造成SIF与Pn关联性的变化,如施加除草剂抑制电子传递链时,SIF发射量将会迅速增加[29],而通过脱落酸及诱导栓塞关闭气孔,光合作用的降低并未与SIF的下降同步[39]。
LUE定义为吸收的光子用于不同耗散途径的摩尔数。当入射辐射和NPQ假定恒定时,LUEp和LUEf由于对相同吸收光的竞争而呈负相关关系。因此,由于消除了PAR的影响,LUEp和LUEf的变化特征能更好地解释反应中心的生化过程[20]。本研究发现了日内随光强增大呈上升趋势的LUEf和下降趋势的LUEp等现象,而在温带混交林的研究结果发现,日间尺度上,LUEp和LUEf均随PAR的降低逐渐下降,二者为正相关关系,证明SIF信号与光合作用的关系在日内与日间存在较大差异。日内尺度上冠层参数的变化可以忽略不计,因此,LUEp和LUEf的关系仅受光强调节,季节尺度上,LUEp随植被物候和植物对各种环境因素的响应而变化,LUEp与LUEf的显著正相关关系表明,LUEf也对这些因素的变化做出反应,因此LUEp与LUEf表现为正相关关系[8]。
在光系统水平上,弱光和无胁迫情况下,吸收的大部分能量被光化学途径有效利用,因此,光系统色素天线吸收的光能被快速传递给光反应的电子传递链,此时光合光能利用率较高,荧光量子产率较低[40],随着光强的增加,反应中光系统II(PSII)中电子受体和电子传递链逐渐趋于光饱和,吸收的光能以荧光形式重发射的比例增加,进一步导致荧光量子产率增加。这些快速荧光动力学反映了PSII电子受体对LUEp/LUEf的影响[41]。
本研究表明,树种在SIF及LUEp/LUEf对PAR的响应模式上具有一致性,种间差异集中体现在光合作用速率上。杨树具有更高的光合速率,与其较高的生长速率相吻合,且生长速率更高的树种其LUEf也较高,这与先前的研究结果不同[42−43]。以往研究通过对C3植物小麦和C4植物玉米的对比试验发现,种间的差异主要集中在GPP上,但SIF和LUEf则在小麦和玉米间差异较小,因此玉米的LUEp/LUEf大于小麦[44],在大豆(C3植物)与玉米的对比中也得到了类似的结果,这主要是由于C3植物光系统中部分电子用于光呼吸[33],Pn饱和导致Pn与SIF之间存在非线性关系,而在玉米上则呈严格线性关系[42]。针对两种C4植物的比较发现,芒草在高温高辐射条件下NPQ升高,LUEf明显降低,SIF在午间下降并削弱了SIF-GPP关系,导致相比于玉米更低的SIF-GPP线性关系的斜率[43]。本研究并未发现杨树和栓皮栎LUEp/LUEf的显著差异,可能是在观测期间,植物受到的瞬时胁迫并未造成LUEf的明显下降。杨树和栓皮栎为落叶阔叶林树种,属于相同植物功能型,本研究观测了幼苗期杨树和栓皮栎在SIF、LUEp、LUEf等方面的异同性,未来应从不同植物功能型树种及其不同林龄等角度,进行进一步研究,以更深入地认识光能利用率对SIF和生产力关联性的调节作用。
3.2 结论
Pn对SIF增大的非线性响应是由于LUEp和LUEf在日内受光强调节的结果,随光强的增加,LUEp逐渐下降,Pn在强光下逐渐饱和;而LUEf略有增加,SIF随光强增加持续增大,因此,Pn随SIF增加表现出逐渐增大直至饱和的现象,该现象在杨树与栓皮栎间保持一致。LUEp和LUEf呈负相关关系,表明SIF与Pn对吸收光能存在竞争作用,在弱光下,大部分吸收光能用于碳固定,而随着光强增加,该比例逐渐下降。相比栓皮栎,生长速率较高的杨树有更高的LUEp和LUEf。
[1] 刘杨杨,李俊,于强,等.甘蔗叶片光合 CO2响应参数分析及其品种间差异[J].中国农业气象,2019,40(10):637-646.
Liu Y Y, Li J, Yu Q, et al. Sugarcane leaf photosynthetic CO2responses parameters and their difference among varieties [J].Chinese Journal of Agrometeorology,2019,40 (10):637- 646.(in Chinese).
[2] Baker N R.Chlorophyll fluorescence:a probe of photosynthesis in vivo[J].Annual Review of Plant Biology,2008, 59: 89-113.
[3] Xiao J,Chevallier F,Gomez C,et al.Remote sensing of the terrestrial carbon cycle:a review of advances over 50 years[J].Remote Sensing of Environment,2019,233:111383.
[4] Porcar-Castell A,Tyystjärvi E,Atherton J,et al.Linking chlorophyll a fluorescence to photosynthesis for remote sensing applications:mechanisms and challenges[J].Journal of Experimental Botany,2014,65:4065-4095.
[5] Wassink E C.Chlorophyll fluorescence and photosynthesis[J]. Advances in Enzymology and Related Areas of Molecular Biology,2006(11): 91-199.
[6] Sun Y,Frankenberg C,Wood J D,et al.OCO-2 advances photosynthesis observation from space via solar-induced chlorophyll fluorescence[J].Science,2017,358:5747.
[7] Miao G,Guan K,Yang X,et al.Sun-induced chlorophyll fluorescence, photosynthesis, and light use efficiency of a soybean field from seasonally continuous measurements[J]. Journal of Geophysical Research:Biogeosciences,2018,123: 610-623.
[8] Yang X,Tang J,Mustard J F,et al.Solar-induced chlorophyll fluorescence that correlates with canopy photosynthesis on diurnal and seasonal scales in a temperate deciduous forest[J].Geophysical Research Letters,2015,42:2977-2987.
[9] Damm A,Elber J,Erler A,et al.Remote sensing of sun-induced fluorescence to improve modeling of diurnal courses of gross primary production (GPP)[J].Global Change Biology,2010,16:171-186.
[10] Verma M,Schimel D,Evans B,et al.Effect of environmental conditions on the relationship between solar-induced fluorescence and gross primary productivity at an OzFlux grassland site[J].Journal of Geophysical Research: Biogeosciences, 2017,122:716-733.
[11] 王明援,刘宁,李波,等.不同光强对6个欧美杨无性系苗期生长及光合特性的影响[J].林业科学研究,2020,33(1): 123-130.
Wang M Y,Liu N,Li B,et al.Effects of light intensity on the growth and photosynthetic characteristics of six×clones at seedling stage[J].Forest Research, 2020,33(1):123-130.(in Chinese).
[12] 周建云,林军,何景峰,等.栓皮栎研究进展与未来展望[J]. 西北林学院学报,2010(3):43-49.
Zhou J Y,Lin J,He J F,et al.Review and perspective on Quercus variabilis research[J].Journal of Northwest Forestry College,2010(3):43-49.(in Chinese).
[13] 尹伟伦.不同种类杨树苗木的生长和光合性能的比较研究Ⅱ:净光合速率、光呼吸和Hill反应等光合性能指标[J].北京林业大学学报,1983(2):41-56.
Yin W L.A comparative study on growth and photosynthetic activity of different kinds of poplar seedlingsⅡ: net photosynthetic rate, photorespiration and hill reaction as indices for breeding clones[J].Journal of Beijing Forestry University,1983(2):41-56.(in Chinese).
[14] 王鑫,同小娟,张劲松,等.太行山南麓栓皮栎人工林光合作用对土壤呼吸的影响[J]. 北京林业大学学报,2021,43(1): 66-76.
Wang X,Tong X J,Zhang J S,et al.Effects of photosynthesis on soil respiration ofplantation in southern Taihang Mountain of northern China[J].Journal of Beijing Forestry University,2021,43(1):66-76.(in Chinese).
[15] Liu L,Zhan Y,Wang J,et al.Detecting solar-induced chlorophyll fluorescence from field radiance spectra based on the Fraunhofer line principle[J].IEEE Transactions on Geoscience and Remote Sensing,2005,43:827-832.
[16] Zhang Z,Wang S,Qiu B,et al.Retrieval of sun-induced chlorophyll fluorescence and advancements in carbon cycle application[J].Journal of Remote Sensing,2019,23:37-52.
[17] Meroni M,Rossini M,Guanter L,et al.Remote sensing of solar-induced chlorophyll fluorescence:review of methods and applications[J].Remote Sensing of Environment, 2009,113:2037-2051.
[18] Lu X,Liu Z,Zhao F,et al.Comparison of total emitted solar-induced chlorophyll fluorescence (SIF) and top- of-canopy (TOC) SIF in estimating photosynthesis[J]. Remote Sensing of Environment,2020,251:112083.
[19] 叶子飘.光合作用对光和CO2响应模型的研究进展[J].植物生态学报,2010,34(6):727-740.
Ye Z P.A review on modeling of responses of photosynthesis to light and CO2[J].Chinese Journal of Plant Ecology,2010, 34(6):727-740.(in Chinese).
[20] 李理渊,李俊,同小娟,等.不同光环境下栓皮栎和刺槐叶片光合光响应模拟[J].应用生态学报,2018,29(7): 2295- 2306.
Li L Y,Li J,Tong X J,et al.Simulation on photosynthetic light-responses of leaves of Quercus variabilis and Robinia pseudoacacia under different light conditions[J].Chinese Journal of Applied Ecology,2018,29(7):2295-2306.(in Chinese).
[21] Monteith J L.Solar radiation and productivity in tropical ecosystems[J].The Journal of Applied Ecology,1972(9): 747.
[22] Berry J,Frankenberg C,Wennberg P,et al.New methods for measurement of photosynthesis from space[C]//Presented at the 2013 NASA Terrestrial Ecology Science Team Meeting, 2013, La Jolla,CA,April 30-May 2, 2013.
[23] Yang K,Ryu Y,Dechant B,et al.Sun-induced chlorophyll fluorescence is more strongly related to absorbed light than to photosynthesis at half-hourly resolution in a rice paddy[J].Remote Sensing of Environment, 2018,216:658- 673.
[24] 程占慧,刘良云.基于叶绿素荧光发射光谱的光能利用率探测[J].农业工程学报,2010,26(2):74-80.
Cheng Z H,Liu L Y.Detection of vegetation light by using efficiency based on chlorophyll fluorescence spectrum[J]. Transactions of the CSAE,2010,26(2):74-80.(in Chinese)
[25] Liu L,Zhang Y,Jiao Q,et al.Assessing photosynthetic light-use efficiency using a solar-induced chlorophyll fluorescence and photochemical reflectance index[J]. International Journal of Remote Sensing,2013,34:4264- 4280.
[26] Mohammed G H,Colombo R,Middleton E M,et al.Remote sensing of solar-induced chlorophyll fluorescence (SIF) in vegetation:50 years of progress[J].Remote Sensing of Environment,2019,231:111177.
[27] Chang C Y,Wen J,Han J,et al.Unpacking the drivers of diurnal dynamics of sun-induced chlorophyll fluorescence (SIF):canopy structure,plant physiology,instrument configuration and retrieval methods[J].Remote Sensing of Environment, 2021,265:112672.
[28] 张鑫,刘雷震,赵文慧,等.冬小麦日光诱导叶绿素荧光的日变化规律探究[J].北京师范大学学报, 2018,54(5): 650-658.
Zhang X,Liu L Z,Zhao W H,et al.Diurnal variation of solar-induced chlorophyll fluorescence of winter wheat[J]. Journal of Beijing Normal University,2018, 54(5):650- 658.(in Chinese).
[29] Cheng X,Zhou Y,Hu M,et al.The links between canopy solar-induced chlorophyll fluorescence and gross primary production responses to meteorological factors in the growing season in deciduous broadleaf forest[J].Remote Sensing,2021,13:2363.
[30] 张瑶,杨再强,姜雨函,等.低温寡照条件下黄瓜叶片光合作用减弱的机理分析[J].中国农业气象,2022,43(4):285-294.
Zhang Y,Yang Z Q,Jiang Y H,et al.Mechanism analysis on photosynthetic attenuation in cucumber leaves under low temperature and weak light condition[J].Chinese Journal of Agrometeorology,2022,43(4):285-294.(in Chinese)
[31] Liu Z,Jia G,Yu X.Variation of water uptake in degradation agroforestry shelterbelts on the North China Plain[J]. Agriculture,Ecosystems & Environment,2020,287:106697.
[32] Kim J,Ryu Y,Dechant B,et al.Solar-induced chlorophyll fluorescence is non-linearly related to canopy photosynthesis in a temperate evergreen needle leaf forest during the fall transition[J].Remote Sensing of Environment,2021,258: 112362.
[33] Gu L,Han J,Wood J D,et al.Sun-induced Chl fluorescence and its importance for biophysical modeling of photosynthesis based on light reactions[J].New Phytologist, 2019,223: 1179-1191.
[34] Liu Y,Chen J M,He L,et al.Non-linearity between gross primary productivity and far-red solar-induced chlorophyll fluorescence emitted from canopies of major biomes[J]. Remote Sensing of Environment,2022, 271:112896.
[35] Pinto F,Damm A,Schickling A,et al.Sun-induced chlorophyll fluorescence from high-resolution imaging spectroscopy data to quantify spatio-temporal patterns of photosynthetic function in crop canopies[J].Plant Cell and Environment, 2016,39:1500-1512.
[36] Schreiber U,Bilger W,Neubauer C.Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis[C]//Schulze E D,Caldwell M M.Ecophysiology of photosynthesis.Berlin:Springer,1995:49-70.
[37] Martini D,Sakowska K,Wohlfahrt G,et al.Heatwave breaks down the linearity between sun-induced fluorescence and gross primary production[J].New Phytologist,2022,233: 2415-2428.
[38] Helm L T,Shi H,Lerdau M T,et al.Solar-induced chlorophyll fluorescence and short-term photosynthetic response to drought[J].Ecological Applications,2020,30(5):e02101.
[39] Marrs J K,Reblin J S,Logan B A,et al.Solar-induced fluorescence does not track photosynthetic carbon assimilation following induced stomatal closure[J]. Geophysical Research Letters,2020,47:2020GL087956.
[40] Dau H.Molecular mechanisms and quantitative models of variable photosystem Ⅱ fluorescence[J]. Photochemistry and Photobiology,1994,60:1-23.
[41] Brody S S,Rabinowitch E.Excitation lifetime of photosynthetic pigments in vitro and in vivo[J].Science,1957,125:16-17.
[42] He L,Magney T,Dutta D,et al.From the ground to space: using solar-induced chlorophyll fluorescence to estimate crop productivity[J].Geophysical Research Letters,2020,47: 2020GL087474.
[43] Wu G,Guan K,Jiang C,et al.Attributing differences of solar-induced chlorophyll fluorescence (SIF)-gross primary production (GPP) relationships between two C4 crops:corn and miscanthus[J].Agricultural and Forest Meteorology, 2022, 323: 109046.
[44] Liu L,Guan L,Liu X.Directly estimating diurnal changes in GPP for C3 and C4 crops using far-red sun-induced chlorophyll fluorescence[J].Agricultural and Forest Meteorology, 2017,232: 1-9.
Comparison of Solar-induced Chlorophyll Fluorescence and Light Use Efficiency between Poplar and Cork Oak
CHENG Xiang-fen1,2, REN Cheng-hao3, ZHANG Jin-song1,2, HU Mei-jun1,2, JIANG Li-ya4, HU Hai-yang5, HUANG Hui1,2, QIAO Yong-sheng6
(1. Research Institute of Forestry, Chinese Academy of Forestry/Key Laboratory of Tree Breeding and Cultivation of National Forestry and Grassland Administration, Beijing 100091,China; 2. Henan Xiaolangdi Earth Critical Zone National Research Station on the Middle Yellow River, Jiyuan 459007; 3. School of Electrical and Mechanical Engineering, Qingdao Agricultural University, Qingdao 266109; 4. College of Forestry, Henan Agricultural University, Zhengzhou 450002; 5. School of Ecology and Nature Conservation, Beijing Forestry University, Beijing 100083; 6. State Owned Nanshan Forest Farm of Jiyuan City, Jiyuan 459000)
Light use efficiency (LUE) is a key parameter connecting light absorption and carbon fixation and understanding the relationship between fluorescence and photosynthesis.Based on the absorbed energy dissipation pathways, LUE can be divided into light use efficiency of photosynthetic (LUEp) and light use efficiency of fluorescence (LUEf). The relationship between LUEpand LUEfof poplar and cork oak and the differences between species were explored in this study, to better understand the mechanism links between solar-induced chlorophyll fluorescence (SIF) and gross primary productivity (GPP) in deciduous broadleaf forests. In this study, the poplar (×) and cork oak (BI.) seedlings were used as the objects to measure the divergences in SIF and net photosynthetic rate (Pn) under the same soil moisture and nutrient conditions, to explore the responses of LUEp/LUEfto photosynthetically active radiation (PAR). The results showed that, (1) SIF was driven by incident PAR, SIF and PAR were significantly positively correlated. The coefficient of determination (R2) of poplar and cork oak were 0.965 and 0.973, respectively, and LUEfwas higher in poplar. Pngradually increased with increasing PAR. The light saturation point (LSP) of poplar was significantly higher than that of cork oak, which were 998.59 and 674 μmolCO2·m−2·s−1, respectively. (2) Pnfirst increased with the increasing SIF, and then the Pnof poplar was gradually saturated, while that of cork oak continued to slowly increase. (3) LUEpand LUEfshowed significant negative linear correlation, and LUEp/LUEfdecreased exponentially with increasing PAR, there was no significant difference in the change pattern and amplitude between tree species. During the daytime, with the increase of PAR, LUEfchanged slightly, while LUEpdecreased significantly, and the proportion of light energy allocation to carbon assimilation decreased. Therefore, Pnsaturated under high light intensity, SIF and GPP showed exponential correlation in intraday scale, and the exponential relationship was consistent across tree species.
Solar-induced chlorophyll fluorescence; Net photosynthetic rate; Light use efficiency; Photosynthetically active radiation
10.3969/j.issn.1000-6362.2023.04.004
程向芬,任成昊,张劲松,等.杨树和栓皮栎日光诱导叶绿素荧光及光能利用率的比较[J].中国农业气象,2023,44(4):295-304
2022−05−06
科技基础资源调查专项(2021FY100701)
黄辉,副研究员,博士,主要从事森林生态系统结构与功能研究,E-mail:huanghui@caf.ac.cn
程向芬,E-mail:chengxf@caf.ac.cn
