IAA 对黄精种子萌发及生理特性的影响
2023-04-22岳贺伟李连珍王雨情王溶溶魏俊杰苌建峰
岳贺伟,李连珍,王雨情,王溶溶,刘 旸,魏俊杰,苌建峰
(河南农业大学 农学院,河南 郑州 450046)
黄精为百合科植物滇黄精(Polygonatum kingianumColl.et Hemsl.)、黄 精(Polygonatum sibiricumRed.)或多花黄精(Polygonatum cyrtonemaHua)的干燥根茎,具有滋肾润肺、补脾益气的功效[1],为药食同源的中药材品种[2],被广泛应用于药品、食品和保健品等。黄精药材供应以往主要依赖野生资源,近年来随着市场需求日益增大,野生资源呈现逐渐减少趋势[3],人工栽培成为解决黄精资源短缺的重要途径。目前,黄精的人工繁殖方式主要是采用块茎繁殖和种子繁殖,块茎繁殖在生产过程中存在品种易退化、成本高且繁殖系数低等问题[4],生产上更趋向于种子繁殖,但黄精种子存在严重休眠和自然萌发率低等现象[5-6],给种子育苗造成了极大障碍。因此,打破黄精种子休眠、缩短种子萌发时间、提高种子发芽率是攻克黄精种子育苗技术障碍的重要环节。
打破种子休眠常用的方法有种皮去除、层积处理、外源激素及化学试剂处理等,其中,外源激素打破种子休眠具有高效、便捷等优点。生长素是第一个被发现的植物激素,是植物体内一种重要的信号分子,几乎调控植物生长发育的所有方面,包括形态建成和对环境变化的响应等[7]。生长素中最重要的化学物质为吲哚乙酸(IAA)。前人研究表明,IAA作为一种植物生长调节剂,低浓度能有效破除植物种子休眠[8-9],高浓度则抑制种子萌发[10],适宜浓度的外源IAA 处理还能够有效促进种子的萌发及幼苗生长[11]。关于不同浓度IAA 对黄精种子萌发及其生理特性影响的研究鲜有报道。鉴于此,拟通过设置不同质量浓度的IAA 处理,观察其对黄精种子萌发和生理特性的影响,探讨打破黄精种子休眠及促进其生长发育的适宜IAA 质量浓度,为黄精优质种苗繁育提供理论基础和科学依据。
1 材料和方法
1.1 试验材料
黄精种子于2021 年10 月购自河南省三门峡市卢氏县宏运农贸中药材合作社。挑选籽粒饱满、无霉变、无病虫害、表面无疤痕、颜色及大小一致的种子用作试验材料。IAA 纯度≥98%,购自北京索莱宝科技有限公司。
1.2 试验设计
黄精种子用清水清洗后,用3% H2O2消毒15 min,蒸馏水冲洗3 次。将消毒后的黄精种子分为4 组,根据浸泡液IAA 质量浓度的不同分别标记为T1(50 mg/L)、T2(100 mg/L)、T3(200 mg/L),蒸馏水浸泡的标记为CK。4 组黄精种子浸泡24 h 后,用清水冲洗3 次,吸干表面水分,播种于穴盘(37 cm×27 cm)营养土中。每组2 个穴盘,每穴盘320 粒种子,覆土1 cm 左右。每组为1 个处理,每个处理设置3 个重复。穴栽后立即进行光照培养,25 ℃恒温,在光照/黑暗为12 h/12 h 条件下培养,及时补充水分,保持土壤湿润。每个处理随机标记1个穴盘,观察记载发芽数,定期测定生理指标。
1.3 指标测定
种子萌发率测定:从穴栽第2周开始每隔3 d定期观察萌发率,萌发和出苗期限设定60 d,将突破种皮的下胚轴长度超过种子自身长度的视为萌发,统计萌发率,直到不再有新的种子萌发即止。
种子萌发率=萌发粒数/种子总粒数×100%。
农艺性状指标测定:调查主根长、侧根数、种球直径。取样日期为种子处理后60 d。
干质量测定:在种子处理后60 d,每个处理随机取10 颗长势一致的发芽的种子,称鲜质量后,80 ℃烘至恒质量,称干质量并记录,设置3次重复。
营养物质含量测定:蛋白质含量测定采用考马斯亮蓝法[12];可溶性糖和淀粉含量测定采用苯酚法[13];脂肪含量测定采用索氏提取法[14];脂肪酶活性测定采用碱式滴定法。
抗氧化酶活性及丙二醛(MDA)含量测定:超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法;过氧化物酶(POD)活性测定采用比色法;MAD 含量测定采用硫代巴比妥酸法;过氧化氢酶(CAT)活性测定采用H2O2法[15]。
1.4 数据处理
采用Excel 2019 和SPSS 25.0 等软件对数据进行处理和分析;采用Pearson积矩相关系数法对黄精种子生理生化指标进行相关性分析;采用主成分分析法(Principal component analysis)筛选反映黄精种子萌发信息的主要生理生化指标。
2 结果与分析
2.1 IAA对黄精种子萌发及生长的影响
由图1 可知,处理后第15 天黄精种子开始萌发,处理后第18 天进入快速萌发期,处理后第27 天种子萌发率趋于稳定。种子萌发率在处理15 d 以后,各处理均表现为T2>T3>T1>CK,且T1、T2、T3 与CK 差异显著(P<0.05)。处理后第33 天,T1、T2、T3分别比CK提高52.82%、174.98%、68.05%。
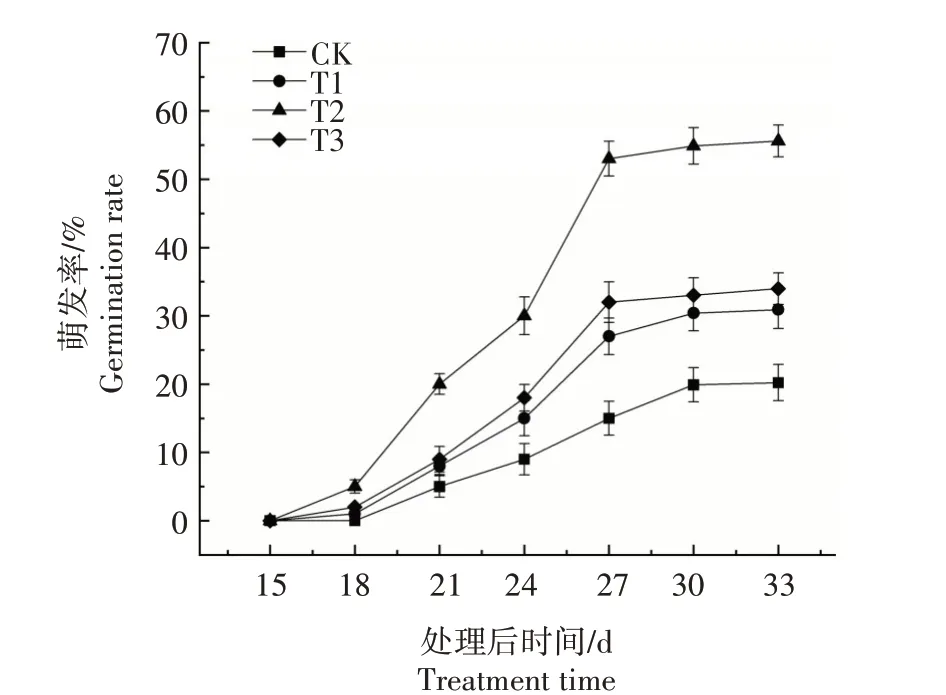
图1 IAA对黄精种子萌发率的影响Fig.1 Effect of IAA on seed germination rate of Polygonatum sibiricum Red.
由表1 可知,经IAA 溶液处理后,黄精种球直径、主根长和干质量均高于CK,且与CK 差异显著。其中,T2 处理种球的侧根数、主根长和干质量均显著高于其他处理。

表1 IAA对黄精种子生长量的影响Tab.1 Effect of IAA on seed growth of Polygonatum sibiricum Red.
2.2 IAA对黄精种子抗氧化酶活性及MDA含量的影响
由图2 可知,在整个种子萌发过程中,IAA 处理的种子其POD、SOD 和CAT 活性均显著(P<0.05)高于CK。POD 活性呈先上升后下降的趋势,在处理后第22天达到最高,此时T1、T2、T3分别比CK 提高16.36%、30.12%、14.07%。其中,T2 处理在整个种子萌发过程中均显著(P<0.05)高于其他处理。
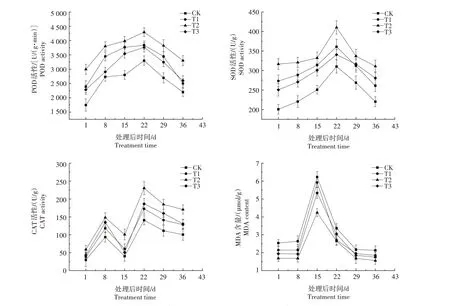
图2 黄精种子萌发过程中抗氧化酶活性及MDA含量变化Fig.2 Change of antioxidant enzyme activity and MDA content in Polygonatum sibiricum Red.seeds during germination
SOD 活性表现出先上升后下降的趋势,在处理后的前15 d 缓慢上升,之后迅速增加,在处理后第22 天达到最高,此时T1、T2、T3 分别比CK 提高16.36%、32.33%、9.79%。其中,T2 处理在整个种子萌发过程中均显著(P<0.05)高于其他处理。
CAT 活性整体表现为先上升后下降,再上升再下降的趋势,在处理后第22 天达到最高,此时T1、T2、T3 分别比CK 提高22.62%、63.43%、32.33%。其中,T2 处理在整个种子萌发过程中均显著(P<0.05)高于其他处理。
MDA 含量在处理8 d 以后快速增加,在处理后第15 天达到最高,之后快速下降,处理29 d 以后趋于稳定。整个种子萌发过程中各处理均表现为CK>T1>T3>T2。其中,T2处理在整个种子萌发过程中均与其他处理差异显著(P<0.05)。
2.3 IAA对黄精种子营养物质含量的影响
由图3 可知,黄精种子中淀粉含量在开始萌发后各处理均呈迅速下降趋势,处理22 d 之后逐渐稳定。淀粉含量在整个种子萌发过程中均表现为CK>T1>T3>T2;处理后第15天至第36天,T1、T2、T3与CK比较均差异显著(P<0.05)。
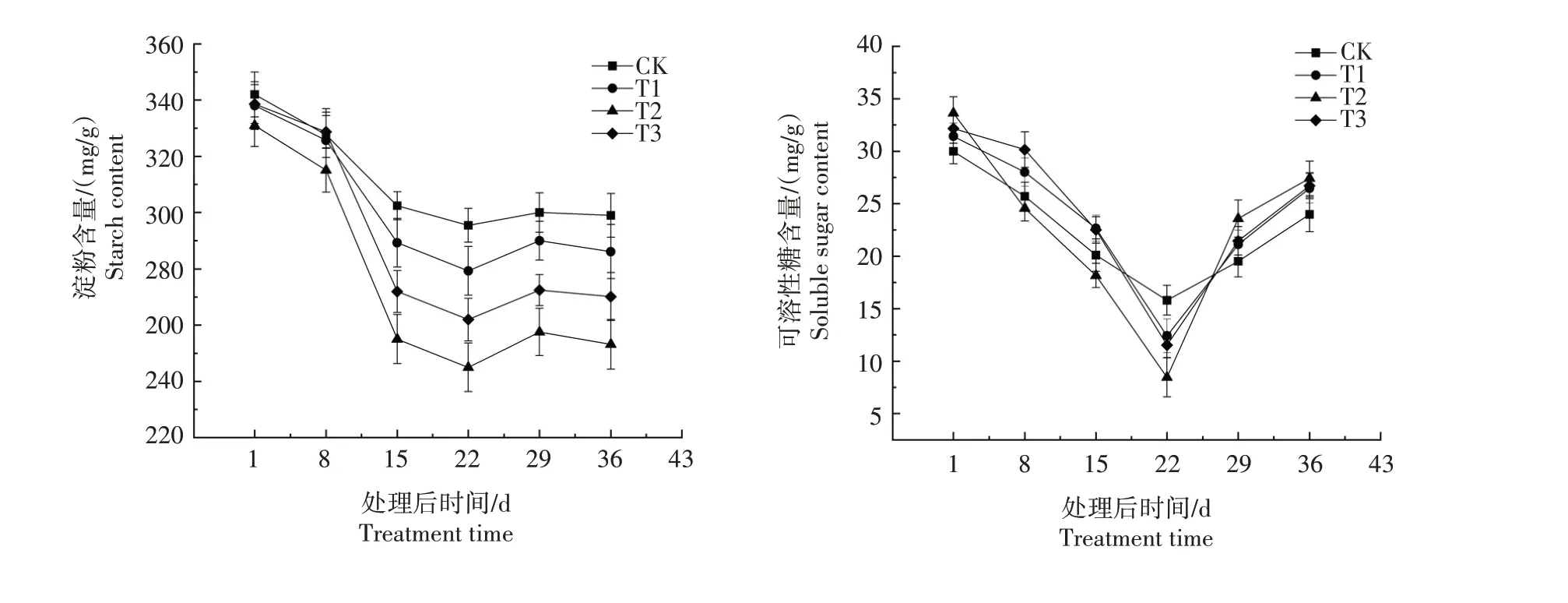
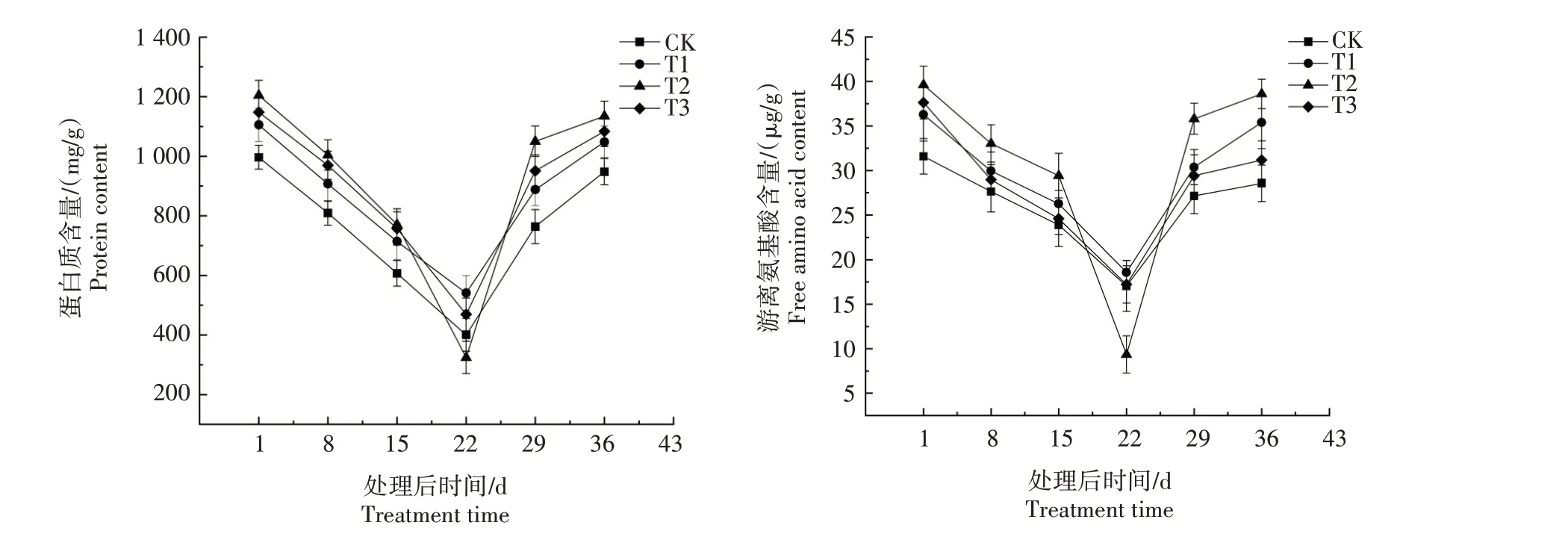
图3 黄精种子萌发过程中营养物质含量变化Fig.3 Change of nutrient content in Polygonatum sibiricum Red.seeds during germination
不同处理种子可溶性糖含量均呈现先下降后上升的趋势,均在处理后第22 天达到最低,之后迅速上升。处理后第22天,不同处理种子可溶性糖含量表现为CK 最高、T2 最低,二者均与T1、T3 差异显著(P<0.05)。在处理后第29 天和第36 天,不同处理均表现为T2 最高、CK 最低,二者均与T1、T3 差异显著(P<0.05)。
不同处理种子蛋白质含量均呈现先下降后上升趋势,在处理后第22天达到最低,之后迅速上升。在处理后第22天,不同处理种子蛋白质含量表现为T1>T3>CK>T2。处理后第29 天和第36 天,均表现为T2 最高,CK 最低,二者与其余2 个处理均差异显著(P<0.05)。不同处理种子游离氨基酸含量均呈现先下降后上升趋势,均在处理后第22 天达到最低,之后迅速上升。处理后第22天,不同处理游离氨基酸含量表现为T1>T3>CK>T2,且差异显著(P<0.05)。在处理后第29天和36天,表现为T2最高,CK 最低,二者均与其余2个处理差异显著(P<0.05)。
2.4 IAA对黄精种子脂肪含量和脂肪酶活性的影响
由图4 可知,黄精种子脂肪含量在整个种子萌发过程中呈现逐渐下降趋势,其中处理后第15天至22 天下降迅速。处理后第36 天不同处理种子脂肪含量表现为CK 最高,T2 最低,T1、T3 间差异不显著(P>0.05);其余时期表现为CK>T1>T3>T2,且各处理间差异显著(P<0.05)。
脂肪酶活性在整个种子萌发过程中呈现逐渐升高趋势,处理后第15天至第22天,T1、T2、T3处理迅速上升,CK 处理则逐渐趋于平缓。处理后第36天,T1、T2、T3 脂肪酶活性分别比CK 提高149.15%、175.42%、137.20%。处理后整个种子萌发过程中,脂肪酶活性均表现为T2最高,CK 最低,且二者均与T1、T3差异显著(P<0.05)。
2.5 黄精种子萌发期生理生化指标相关性分析
由表2 可知,淀粉含量与脂肪酶活性呈显著负相关关系;游离氨基酸含量与可溶性糖、蛋白质含量均呈极显著正相关关系,与POD 活性呈极显著负相关,与SOD 活性呈显著负相关关系;可溶性糖含量与蛋白质含量呈极显著正相关关系,与POD 活性呈负相关关系,与SOD 活性呈极显著负相关关系;蛋白质含量与SOD 活性呈极显著负相关关系,与POD 活性呈显著负相关关系;脂肪酶活性与CAT 活性呈显著正相关关系,与脂肪含量呈极显著负相关关系;脂肪含量与CAT 活性呈显著负相关关系。其余各指标间相关性不显著。
2.6 黄精种子萌发生理生化指标主成分分析
由表3 可知,5 个主成分特征值中前2 个主成分的特征值均大于1,累积贡献率达87.459%,可以用其进行黄精种子生理指标的主成分分析。
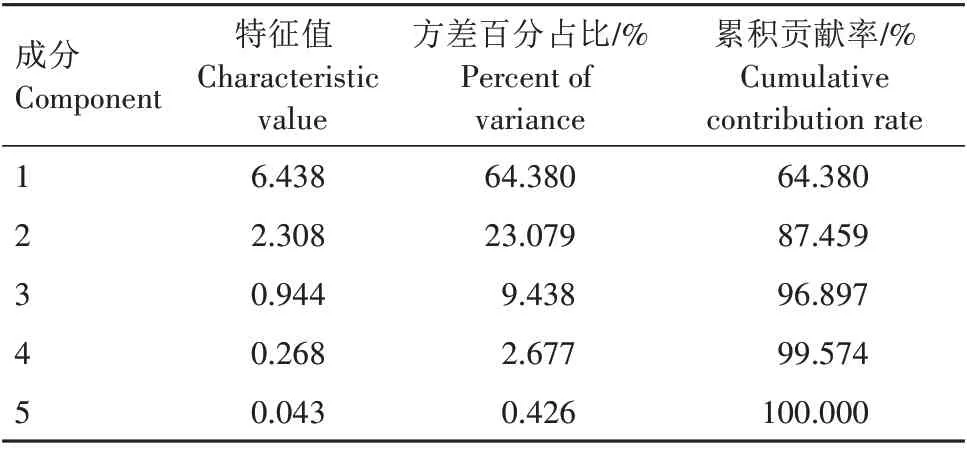
表3 成分特征值分布与累积贡献率分析Tab.3 Distribution and cumulative contribution rateanalysis of characteristic values of components
由表4 可知,主成分1 的特征向量中,因子得分系数绝对值较高的是淀粉含量、可溶性糖含量、游离氨基酸含量、蛋白质含量、POD 活性、SOD 活性、CAT 活性和脂肪酶活性。主成分2 的特征向量中,因子得分系数绝对值较高的是淀粉含量、游离氨基酸含量、蛋白质含量、脂肪含量、CAT 活性、MDA 含量和脂肪酶活性。由表3 可知,第一主成分反映原始数据信息量的64.380%,第二主成分为23.079%,综合考量,筛选淀粉含量、可溶性糖含量、游离氨基酸含量、蛋白质含量、POD 活性、SOD 活性、CAT 活性和脂肪酶活性作为反映黄精种子萌发与生长的主要指标。
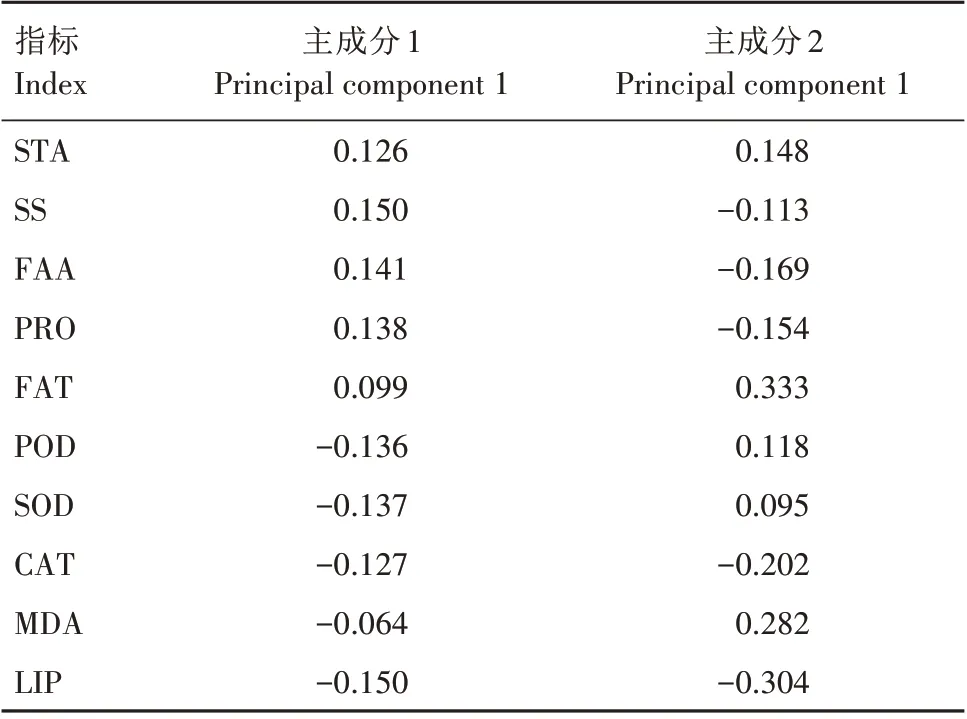
表4 主成分得分系数分析Tab.4 Analysis of score coefficient of main components
3 结论与讨论
3.1 IAA对黄精种子萌发及种球生长的影响
IAA 大多在植物顶端组织、新生叶片和萌发中的种子中合成,与脱落酸(ABA)协同调控和维持种子的休眠[16],ABA、赤霉素(GA)和IAA 之间的激素平衡可能是种子萌发差异的物质基础[17]。有研究表明,IAA、ABA 和活性氧之间的串扰在调节种子萌发、根系生长等方面起着关键作用[18],低浓度的IAA可促进植物的生长发育,浓度过高则会抑制植物的生长。IAA主要受其本身生物合成与分解代谢以及相关信号转导途径的调控,从而在种子休眠和萌发中发挥作用[7]。前人研究表明,适当浓度的IAA 能够促进燕麦[19]和文冠果[20]等植物种子的萌发。本研究结果表明,不同质量浓度的IAA 处理可以提高黄精种子萌发率,加快种球生长,促进根系发育。其中100 mg/L 的IAA 处理种子萌发率最高,主根长、侧根数和干质量等指标均优于其他处理。
3.2 IAA对黄精种子酶活性的影响
SOD、POD 和CAT 同为种子内重要的抗氧化酶,共同构成清除活性氧系统[21],能够阻止O-2、H2O2在细胞内积累。植物种子在萌发过程中会提高活性氧系统以改善种皮、珠孔的通透[22],而此时抗氧化酶活性也会相应提高,以保证种子正常萌发。前人研究表明,栀子种子[23]、火棘种子[24]等萌发过程中,抗氧化酶活性均有不同程度的提高,从而清除积累的活性氧。本研究结果表明,经不同质量浓度IAA处理后,SOD 与POD 的酶活性存在相似的变化趋势,在黄精种子萌发前期逐渐上升,第22 天达到最高,之后迅速下降,说明SOD 与POD 在萌发前期作用最强。CAT 在黄精种子萌发过程中呈现上升后下降,再上升再下降的趋势,在第22天达到最高,说明CAT 在种子萌发前期以及胚根突破种皮阶段发挥重要作用。其中,100 mg/L IAA 处理的黄精种子,SOD、POD 和CAT 活性在整个种子萌发过程中均显著高于其他处理。
MDA 可以作为反映膜脂过氧化程度的指标。植物在受到逆境胁迫时,会导致体内的活性氧自由基不断增加,从而引起MDA 含量增加[25]。本研究结果表明,MDA 含量在萌发前期趋于稳定,在IAA 处理后第15 天达到最高,之后逐渐降低并趋于稳定,这与刘文东等[26]关于白术种子变化规律的研究结果基本一致。IAA 处理后的黄精种子在整个萌发阶段,MDA 含量均低于对照,其中100 mg/L IAA 处理最低,且与其他处理差异显著。
3.3 IAA对黄精种子营养物质的影响
淀粉是种子萌发过程中能量代谢和物质代谢的基础。种子萌发和幼苗生长主要依赖于内源淀粉和可溶性糖降解[27]。氨基酸是结构蛋白、贮藏蛋白和酶类等的重要合成前体物质及降解组分,游离氨基酸含量变化是种子蛋白质代谢水平的重要指标。种子细胞调控酶通过蛋白质代谢途径调节相关酶的合成和降解[28],进而调控种子代谢进程。粗脂肪在种子的萌发前期,能够为种子提供一定的能量供应,又可以将脂肪酸转化为糖,以满足萌发后期生物膜的构建、信号转导体系及激素甾醇类物质的合成等[29]。种子萌发时,种子内脂肪酶活性增加,将脂肪分解为甘油和脂肪酸供组织细胞利用。前人研究表明,种子萌发前期营养物质快速消耗,为种子萌发提供必要的能量与物质基础[30-32]。本研究表明,黄精种子萌发过程中,淀粉、可溶性糖、蛋白质、游离氨基酸和脂肪含量在萌发前期均呈现下降趋势,第22 天以后,淀粉含量趋于平稳,可溶性糖、蛋白质和游离氨基酸含量逐渐上升,脂肪含量又有所下降。可见,黄精种子在萌发前期,体内营养物质分解代谢较快,能够为萌发及形成新的细胞形态提供能量。在IAA 处理后第22 天,100 mg/L IAA 处理的黄精种子中淀粉、可溶性糖、蛋白质、游离氨基酸和脂肪含量均显著低于其他处理。
3.4 IAA对黄精种子生理生化指标影响的评价分析
种子在萌发和生长过程中会受到多个因子影响,而各因子之间彼此关联,互相作用。本研究结果表明,黄精种子的萌发、生长与生理生化指标之间存在一定关联。通过成分特征值分布和主成分分析可知,本研究10个指标中,淀粉含量、可溶性糖含量、游离氨基酸含量、蛋白质含量、POD活性、SOD活性、CAT活性和脂肪酶活性等8个指标,可以作为反映黄精种子生长的主要指标。
综上所述,不同质量浓度的IAA 处理可以加速黄精种子体内脂肪、蛋白质和淀粉代谢,增加可溶性糖含量,提高POD、SOD和CAT酶活性,降低MDA含量,促进黄精种子萌发和种球生长,其中以100 mg/L IAA处理最优。
