MEBT/MEBO对糖尿病大鼠慢性创面组织miR-126a-3p表达及血管新生的影响
2023-04-18徐媛媛周安邦黄光京陈思蓉吴标良
徐媛媛,周安邦,黄光京,陈思蓉,吴标良
(1.右江民族医学院附属医院内分泌科,广西百色 533000;2.右江民族医学院研究生学院,广西百色 533000)
糖尿病慢性创面是由长期糖脂代谢紊乱等全身因素及创面周围神经病变、血管病变和感染等局部因素共同导致的难治性创面[1-2]。近来,研究者们发现血管新生过程受阻导致中断会使糖尿病慢性创面血液供应不足,严重影响创面机化进程,最终致使糖尿病慢性创面难以愈合[3],miR-126a-3p曾被称为miR-126-3p或miRNA-126,作为特异性内皮功能生物标志物,能动员造血干细胞并促进血管新生[4-6]。诸多研究证实,皮肤原位再生医疗技术(moist exposed burn therapy/moist exposed burn ointment,MEBT/MEBO)可调控炎症与免疫因子的分泌,加快成纤维细胞和新生毛细血管的增殖,抑制瘢痕组织的形成,在临床治疗糖尿病慢性创面中取得了良好疗效[7-9]。然而,基于miR-126a-3p调控研究MEBT/MEBO促进创面愈合机制十分罕见,因此,笔者从miR-126a-3p角度进一步探讨 MEBT/MEBO 促进糖尿病慢性创面愈合的分子机制,为 MEBT/MEBO 的临床推广提供更丰富的理论铺垫。
1 材料与方法
1.1 主要试剂及仪器湿润烧伤膏(MEBO,汕头市美宝制药有限公司);链脲佐菌素 (Streptozotocin,STZ)(北京索莱宝科技有限公司);三氯乙醛水合物(上海麦克林生化科技股份有限公司);miR-126a-3p、U6引物(广州复能基因有限公司);光学显微镜[尼康仪器(上海)有限公司];微量紫外/可见分光光度计[天根生化科技(北京)有限公司];伯乐T100 PCR仪(美国伯乐Bio-Rad公司);罗氏LightCycler96 1.0系统(德国罗氏诊断有限公司)。
1.2 实验动物将72 只7周龄,体重240~280 g,SPF级Wistar雄性大鼠作为受试对象。该动物购于长沙市天勤生物技术有限公司(许可证号:SCXK[湘]2019-0014)并喂养于右江民族医学院SPF级实验动物中心,环境清洁,温度23~25 ℃,喂养普通饲料,饮用清洁水源,隔天更换垫料。该实验方案已获得右江民族医学院动物伦理委员会批准(批号:2018051501)。
1.3 实验方法
1.3.1 实验分组及模型构建适应饲养1 周后开始实验,随机将所有在养的大鼠分配到对照组、模型组及MEBO组,每组24只。其中,模型组和MEBO组大鼠参照董方等人[10]实验性糖尿病大鼠建模方法,禁食16小时后腹腔注射 STZ 45 mg/kg,3天后观察大鼠一般情况并测量空腹血糖,出现多饮、多食、多尿等典型糖尿病症状并且血糖大于16.7 mmol/L则表明糖尿病模型构建成功。此时参照赵京禹等[11]全层皮肤缺损法构建大鼠慢性难愈合创面模型。将大鼠腹腔注射5%三氯乙醛水合物7 mL/kg麻醉,用印章在右侧背部印出直径为20 mm的圆形标记,并沿标记用无菌剪刀剪除其全层皮肤,建成糖尿病大鼠慢性难愈合创面模型。对照组大鼠正常进食饮水,腹腔注射5%三氯乙醛水合物7 mL/kg麻醉,用印章在右侧背部印出直径为20 mm的圆形标记,并沿标记用无菌剪刀剪除其全层皮肤,建成急性创面模型。
1.3.2 创面处理及血糖控制创面造模构建后立即给大鼠换药,早晚各1次;选用浓度为 0.02%呋喃西林抑菌溶液给各组大鼠清创;MEBO组大鼠依次覆盖 2 层MEBO纱布(0.2 g/cm2)及2层无菌干纱布并包扎固定;模型组和对照组覆盖2层生理盐水纱布及2层无菌干纱布并包扎固定。糖尿病大鼠若血糖值大于33.3 mmol/L则予以长效胰岛素皮下注射,每天2次,每次2~4 IU/kg,将血糖控制在16.0 mmol/L左右。
1.3.3 动物及创面肉眼观每天观察且记录所有在养大鼠一般情况及创面愈合情况。造模首次给药后,分别于治疗后第1天、第11天和第18天,随机在每组中抽取8只大鼠,固定后将刻度尺放置于大鼠创面边缘,并且用相机拍摄创面,将采集的图像上传至Image J软件并测量创面面积,利用公式计算创面愈合率。愈合率=(初始面积-未愈面积)/初始面积×100%。
1.3.4 创面组织标本采集及处理分别于治疗后第1天、第11天和第18天,每组随机选取8只大鼠,按上述方式麻醉大鼠后,距创缘 0.5 cm 处采集造模区整个创面及周围组织,而后将大鼠过量麻醉处死。将采集到的组织样品分为2份,一份放入无酶冻存管中并标记,迅速置于液态氮气中速冻,后保存到-80 ℃冰箱。另一份放入包埋盒中并标记,迅速浸泡于4%多聚甲醛固定液中。
1.3.5 创面组织病理学检测及血管计数将各组不同时间点大鼠组织标本固定18小时,再经梯度脱水、透明、浸蜡,并包埋制成蜡块备用。依次切片、烤片、脱蜡、水化后进行HE(hematoxylin and eosin)染色;镜下观察大鼠创面组织的炎症细胞浸润、成纤维细胞形态数量及毛细血管分布并行血管计数。
1.3.6 创面组织miR-126a-3p表达水平检测取第18天的模型组及MEBO组冻存标本置于经灭菌及冷却的研钵内,边研磨边加液氮,研成粉末状为止,然后转移至液氮冷却的EP管中暂存,按照 Trizol法提取总RNA,并取1 μL滴加到紫外分光光度计样品孔测定其浓度及纯度,将浓度大于500 ng/μL,A260/280比值在1.9~2.0内且A260/230比值大于2.0 的总RNA作为逆转录模板,按照All-in-OneTMmiRNA qRT-PCR Detection Kit 2.0(广州复能基因有限公司,QP115)说明书逆转录合成cDNA,然后以cDNA为模板进行qPCR。最终通过2-ΔΔCt法计算miR-126a-3p相对于U6表达量。

2 结 果
2.1 动物一般情况及创面肉眼观察结果成模后,对照组大鼠精神状态尚佳,进食饮水、大小便及活动均无异常;模型组及MEBO组大鼠全身状态均欠佳,两组大鼠均萎靡不振,嗜睡,多饮,多食,多尿,活动少,消瘦,毛发干枯凌乱无光泽。治疗后第 1 天,各组大鼠创面感染症状均不严重,但均晦暗,淤血,有少许出血、渗液及水肿,无新鲜肉芽肿生长。第 11 天,对照组大鼠创面红润洁净,大片状鲜红肉芽组织生成;模型组大鼠创面仍严重血肉模糊,污秽潮湿,肉芽组织几乎不可见。MEBO组大鼠创面较模型组清洁干燥,轻度水肿,少许粉红色肉芽颗粒形成。第 18 天,对照组大鼠创面已经愈合,且有毛发生长,毛发下可见条状瘢痕形成;模型组大鼠创面见少许粉红色肉芽颗粒形成。MEBO组大鼠创面见成片鲜红色新生肉芽组织。见图1。
2.2 不同时间点3组大鼠创面愈合率对比治疗后第11天及第18天,各组创面愈合率从大到小排列均是对照组、MEBO组、模型组,多重比较差异均有统计学意义(P均<0.001)。并且,治疗后第18天各组大鼠创面愈合率均高于第 11 天,对比差异有统计学意义(P均<0.001)。见表1。
2.3 病理形态学结果及新生毛细血管数量治疗后第 1 天,光镜下可见各组创面均出现鳞状上皮带状坏死,大量炎症细胞浸润,主要是中性粒细胞浸润,血管结构不完整,出血严重。治疗后第 11 天,镜下见对照组创面坏死组织被溶解吸收,炎症细胞消退,上皮细胞增生,大量新生毛细血管形成,成纤维细胞增生,形态不规则且排列不整齐;模型组创面仍有较多坏死组织,炎细胞浸润及出血均未明显减轻;MEBO 组创面炎症浸润较模型组轻,散在新生毛细血管及成纤维细胞生长。治疗后第18天,对照组创面再生出上皮组织,毛细血管管腔闭锁,大量胶原纤维蛋白整齐排列于创面底部。模型组创面炎症浸润较前减轻,散在新生毛细血管及成纤维细胞生长;MEBO 组创面坏死组织基本被吸收,炎症细胞消退,上皮细胞增生,较多新生毛细血管形成,形态不规则成纤维细胞增生(图2)。治疗后第18天模型组和MEBO组毛细血管数量相对于治疗后第1天均明显增加(P<0.001),但MEBO组毛细血管数量增加比模型组更明显(P<0.001)。见表2。
2.4 创面组织miR-126a-3p表达水平治疗后第 18 天,模型组和MEBO 组大鼠创面均有相当数量新生毛细血管生成,取第18天模型组及MEBO组冻存大鼠创面组织标本行qPCR实验,检测创面组织中miR-126a-3p的相对表达量。结果表明,与模型组相比,MEBO组创面组织中miR-126a-3p表达量显著增加(P<0.001)。见图3。
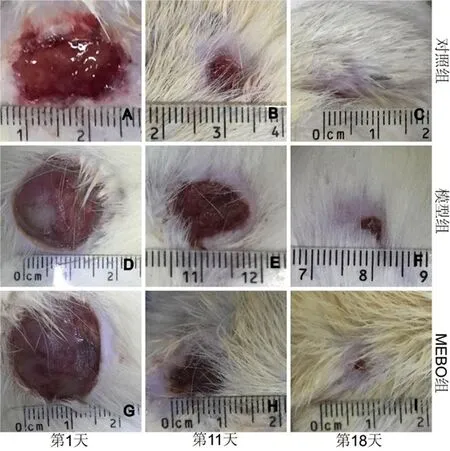
图1 不同时间点3组大鼠创面愈合情况对比图

表1 不同时间点3组大鼠创面愈合率对比

图2 不同时间点3组大鼠创面组织HE染色图(Bar=50 μm)
表2 不同时间点模型组和MEBO组大鼠毛细血管数量对比
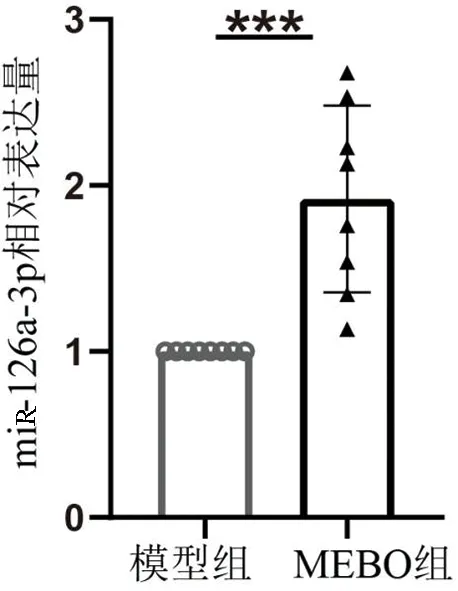
注:***表示P<0.001
3 讨 论
血管新生在创面的及时有效修复中扮演着十分关键的角色,新生的血管网形成,可给创面运送丰富的氧气和营养物质,促进创面修复[12]。目前研究发现,miR-126a-3p参与调节造血干细胞的血管再生和动员,是内皮细胞的功能和血管稳态的特异性生物标志物[4-6]。MEBO为 MEBT/MEBO的主要治疗药物,其通过调控创面炎症及免疫因子分泌,细胞增殖,新生血管形成及抑制瘢痕增生从而促进创面的无瘢痕修复,并在糖尿病足等多种慢性溃疡的临床治疗中取得一定疗效[13-14]。本研究试图通过肉眼观察大鼠创面大体病变,HE染色镜下了解创面组织病理形态及对新生毛细血管计数,qPCR检测组织miR-126a-3p表达量,进一步探讨MEBT/MEBO 促进糖尿病慢性创面血管新生的分子机制。
miRNA(microRNA,微小RNA)是一种内源性长度为22~25 nt的小RNA分子[15],它能够通过RISC复合体及其他RNA结合蛋白来调节mRNA的功能[16]。miRNA最常见的结合位点是靶向mRNA的3’-UTR。miRNA的表达失衡将会加快或者延缓血管新生进而影响糖尿病慢性溃疡愈合[17]。例如,在糖尿病小鼠创面模型中,分别抑制血管内皮生长因子和血管内皮生长因子-受体2 mRNA的miR15b 和miR200b均异常上调,抑制血管生成并延缓了糖尿病创面愈合。相反,抗miR15b和抗miR200b治疗改善了创面血管组织生长状况,加快了修复过程[18]。miR-126a-3p被归类为血管相关miRNA,能够特异性靶向萌芽相关蛋白1(sprouty-related protein1,SPRED-1)及3-磷酸激酶调节蛋白2(phosphatidylinositol-3-kinase regulatory subunit 2,PIK3R2)[19]。研究发现,miR-126a-3p 缺乏可导致血管破裂出血,提示miR-126a-3p在维持血管内皮功能稳定、血管壁完整、血管新生及创面愈合中发挥重要作用,被认为是一种高度特异性促血管新生标志物[20];miR-126a-3p 还能调控 PIK3R2/PI3K/AKT 通路,促进人脐静脉内皮细胞的生长及血管形成[21]。王琳[22]研究揭示,MEBT/MEBO可通过上调糖尿病足溃疡患者血清外泌体中miR-126a-3p的表达量,促进创面新生血管形成,改善糖尿病足溃疡创面的愈合质量。由此可见,miR-126a-3p 可能是个非常有潜力的糖尿病慢性创面治疗靶点。
在本研究中,比较治疗后第11和第18天的创面愈合率,发现对照组大鼠愈合速度明显快于模型组和MEBO组,而MEBO组大鼠愈合速度又明显快于模型组。此外,HE染色结果显示,对照组大鼠创面愈合质量明显优于MEBO组和模型组,而MEBO组大鼠愈合质量又明显优于模型组。治疗后第11天,对照组大鼠创面炎症细胞大幅消退,大量新生毛细血管形成,成纤维细胞及胶原纤维蛋白也开始增加,并在第18天完全再生出皮肤组织,而MEBO 组大鼠创面炎症细胞浸润仍然严重,且只有少量毛细血管萌芽及成纤维细胞生长,而模型组的则更少。治疗18天后MEBO组新增的毛细血管数量明显多于模型组。治疗后第18天,MEBO组创面组织中miR-126a-3p表达量也显著多于模型组。可见,与正常大鼠相比,糖尿病大鼠创面更加难以愈合,而MEBO可以加速糖尿病大鼠创面愈合速度并改善创面愈合质量。这可能与糖尿病大鼠创面miR-126a-3p表达不足,而MEBO可以刺激miR-126a-3p表达增加进而促进血管新生有关。
综上所述,MEBT/MEBO 可能通过提高创面组织中miR-126a-3p表达水平诱导血管新生,从而促进糖尿病慢性创面愈合。
