接种嗜水气单胞菌对水稻降解毒死蜱的影响及作用机制
2023-04-18马丽雅冯发运余向阳唐文伟
张 帆, 马丽雅, 冯发运, 余向阳,, 唐文伟*,, 葛 静*,
(1.广西大学 农学院,南宁 530000;2.江苏省农业科学院 省部共建国家重点实验室培育基地江苏省食品质量安全重点实验室,南京 210014)
毒死蜱 (chlorpyrifos,CPF) 是一种广谱且高效低毒的有机磷类杀虫、杀螨剂[1],作为高毒有机磷农药的重要替代品种,已广泛用于水稻、小麦、大豆、玉米和棉花等作物的害虫防控,但其实际利用率低,在自然环境中半衰期较长[2],容易在农作物和蔬菜中残留,从而影响农作物和蔬菜的生理代谢以及作物品质。张清智等[3]研究表明,不同浓度毒死蜱会对小白菜中抗氧化酶活性产生较明显的影响,表现为先下降后上升的趋势;沈燕等[4]发现,若过量使用毒死蜱,会导致植物体内过氧化物酶 (POD) 活性以及丙二醛 (MDA)和脯氨酸含量增加;商飞飞等[5]发现,毒死蜱可以导致韭菜和小白菜中可溶性蛋白及谷胱甘肽S-转移酶(GST)、谷胱甘肽过氧化物酶、酸性磷酸酯酶和碱性磷酸酯酶的活性发生变化。此外,毒死蜱还可以干扰人类黄体酮受体 (HPR),破坏正常的黄体酮信号传导途径,从而影响正常的妊娠过程[6],对人类和动物具有中度危害并具有致癌特性[7-8]。目前,研究人员已经在全球土壤、水体、沉积物和作物中检测到毒死蜱,在人乳、尿液、血液和其他人体液体中也检测到毒死蜱残留物[9]。显然,毒死蜱的大量使用对环境生态和人类健康已造成潜在威胁。
内生菌是指整个生命活动都在宿主各细胞间隙、组织和器官内,而不会对宿主产生严重危害和引起宿主产生排斥反应的微生物[10]。植物-内生菌的联合使用不仅能增强植物对有害物质的耐受能力,还能促进植物生长[11],提高植物自身的免疫能力。此外,内生菌还可以促进植物对土壤中污染物的吸收、富集、转化和利用,从而可以同时削减土壤环境中的污染物[12]。迄今为止,国内外文献已经报道很多株能够降解毒死蜱的细菌,其中包括:假单胞菌属 (Pseudomonas)[13-14]、肠杆菌属 (Enterobacter)[15]、芽孢杆菌属 (Bacillus)[16-17]、克雷伯氏菌属 (Klebsiella)[18]、副球菌属 (Paracoccus)[19]和黄杆菌属 (Flavobacterium) 等[20]。这些细菌绝大部分是从土壤、污泥、水等环境中分离得到的外生细菌,极少有关于降解毒死蜱的内生细菌的报道。内生降解细菌由于其自身的优势成为近年来研究的热点,Sun 等[21]从看麦娘中筛选到的内生细菌Staphylococcussp.BJ06,在 15 d 时可降解液体无机盐培养基 (MSM) 中56.0%的芘;Liu 等[22]从野生稻中筛选出一株Bacillus amyloliquefaciensL381,其在5 d 内降解了土壤中 96.1%的邻苯二甲酸二丁酯 (DBP);Zhang 等[23]从藨草中分离得到的Pseudomonas adaceaeJ4AJ,可对土壤中残留的柴油产生有效的降解;Ho 等[24]从香根草中筛选出的一株内生细菌Achromobacter xylosoxidansF3B,能以芳香族化合物为唯一碳源生长。本实验室前期从水稻中分离得到 5 株具有毒死蜱降解功能的内生菌,研究发现其对水稻中毒死蜱的降解具有一定的促进作用[25]。
本研究从受污染的水稻体内分离筛选获得一株对毒死蜱具有降解作用的内生嗜水气单胞菌ST6,并初步研究了该菌株对毒死蜱的降解特性、定殖水稻后对毒死蜱降解的影响以及作用机制,旨在为进一步研究植物-内生菌联合降解毒死蜱机理研究提供借鉴。
1 材料与方法
1.1 试剂与仪器
1.1.1 化学试剂 99%毒死蜱(chlorpyrifos, CPF)
标准品,购自上海安普实验科技股份有限公司;2.5%戊二醛固定液,购自上海麦克林生化科技有限公司;正己烷,购自北京迈瑞达科技有限公司;乙腈,购自德国 Merck 公司;次氯酸钠,购自天津市科密欧化学试剂有限公司;无水乙醇,购自上海久亿化学试剂有限公司;氯化钠,购自西陇科学股份有限公司;氨苄青霉素 (ampicillin)、卡那霉素 (kanamycin)、利福平抗生素 (rifampin)、氯霉素 (chloramphenicol)和四环素 (tetracycline),购自上海源叶生物科技有限公司;Yoshida 水稻营养液干粉,购自北京酷来搏科技有限公司。
1.1.2 培养基 无机盐液体培养基:取 3.0 g 磷酸二氢钾、0.1 g 七水硫酸镁、1.5 g 磷酸氢二钾、0.01 g 无水氯化钙、0.01 g 乙二胺四乙酸二钠、硝酸铵 2.0 g 和微量元素溶液 1 mL 于容量瓶中,用去离子水定容至 1 L,调节 pH 值为 7.0 ± 0.2,121 ℃ 高压蒸汽灭菌 20 min,备用。无机盐固体平板在上述液体培养基中加琼脂15 g/L,灭菌后备用。
LB 液体培养基:称取牛肉膏 5.0 g、蛋白胨10.0 g 和氯化钠 5.0 g 于容量瓶中,用去离子水定容至 1 L,调节 pH 值为 7.0 ± 0.2,121 ℃ 高压蒸汽灭菌 20 min,备用。LB 固体平板在上述液体培养基中加琼脂 15 g/L,灭菌后备用。
水稻营养液:称取营养液干粉 0.6 g 于容量瓶中,用去离子水定容至 1 L,调节 pH 值为 5.8 ± 0.2。
1.1.3 仪器设备 Agilent HP6890 气相色谱仪 (美国安捷伦科技公司);ZEISS EVO-LS10 扫描电子显微镜 (德国蔡司股份公司);Biotek EPOCH2全波长酶标仪 (美国伯腾仪器有限公司);CK-2000高通量样品磨样机 (北京托摩根生物有限公司);KDC-220HR 高速冷冻离心机 (安徽中科中佳科学仪器有限公司);JJ223BC 电子天平 (常熟市双杰测试仪器厂);激光共聚焦显微镜-UltraVIEW VoX(美国 Perkin Elmer 股份有限公司)。
1.2 毒死蜱降解菌的鉴定
菌落形态:取过夜培养的菌株在 LB 液体培养基上划线,置于30 ℃的恒温培养箱中培养 24 h,待菌落形成后,观察并记录其形态、大小、颜色。
细菌形态:菌株在 LB 液体培养基中振荡培养(30 ℃,180 r/min) 12 h,离心,收集菌体,用20 mmol/L 的 PBS 缓冲液 (pH 7.2~7.4) 清洗菌体3 次,每次 10 min,通过光学显微镜初步观察细菌的形态特征;然后,向菌体中加入终浓度 (质量分数) 为2.5% 的戊二醛,混匀后室温下浸泡过夜,于8000 r/min 下离心 5 min,弃去上清液,收集菌体,用乙醇进行梯度洗脱;最后用无水乙醇浸泡 3 次,每次 30 min,通过扫描电子显微镜观察菌株形态特征。
细菌 16S rRNA 基因测序委托北京擎科生物科技有限公司完成。将获得的 16S rRNA 菌株序列在NCBI 中进行 BLAST 分析,与 GenBank 数据库中的基因序列进行同源性比较分析。使用 MEGA7.0软件采用邻位连接法 (Neighbour Joining) 绘制系统发育树。
1.3 gfp 标记菌株的构建及其生物学特性
1.3.1 gfp 标记菌株的构建 使用三亲本杂交法[26]将绿色荧光蛋白 (green fluorescent protein,简称gfp) 导入内生菌 ST6:以菌株 gfp (100 mg/L 氨苄青霉素抗性) 为供体菌 (提供绿色荧光蛋白基因),大肠杆菌Escherichia coliH8bic PRK2013 (25 mg/L卡那霉素抗性) 为辅助菌,受体菌 ST6 通过低浓度四环素逐级诱导,获得30 mg/L 四环素抗性。将供体菌、辅助菌和受体菌分别接入含 100 mg/L 氨苄青霉素、25 mg/L 卡那霉素和30 mg/L 四环素的LB 液体培养基中,于30 ℃ 恒温摇床中培养,待菌液生长至对数期 (OD600nm值约为1.0) 后,分别吸取 1 mL 菌液至 2 mL 离心管中,于8000 r/min离心1 min,弃去上清液;另取 1 mL 无菌 LB 液体培养基,洗涤并重悬,再次离心后弃去上清液。各加500 μL LB 液体培养基。将3 种菌悬液于另一离心管中混匀后吸取100 μL,转移至中央置有直径约 3 cm 无菌滤纸的 LB 固体平板中,静置3~5 min,待滤纸被菌液润湿并初步固定后,用封口膜封口,倒置于 28 ℃ 恒温培养箱中培养2 d。第 3 天取出滤纸并放入含有10 mL 无菌 LB液体培养基的50 mL 离心管中,涡旋1 min,以便将滤纸上附着的菌体洗入 LB 液体培养基。吸取100 μL 菌悬液涂布于三抗平板 (含 100 mg/L 氨苄青霉素、25 mg/L 卡那霉素和 30 mg/L 四环素的LB 固体平板)。重复3 次。将平板倒置于30 ℃恒温培养箱中,2 d 后挑取三抗平板中生长的单菌落,划线纯化后使用激光共聚焦显微镜观察绿色荧光蛋白基因是否成功导入ST6。
1.3.2 菌株的生长曲线 将菌株接种于 50 mL LB
液体培养基中,在30 ℃、180 r/min 下振荡培养12 h,获得菌悬液,调节密度OD600nm为1.0 左右。将菌悬液按体积分数为1% 的接菌量接种于LB 液体培养基中,每隔2 h 测定1 次OD600nm值,连续测定24 h。以OD600nm值为纵坐标、时间为横坐标,绘制菌株生长曲线。
1.3.3 内生菌降解毒死蜱能力的测定 以 ST6、ST6-gfp 为供试菌株,开展体毒死蜱外降解试验。分别将菌株接种于 LB 液体培养基中,在30 ℃、180 r/min 下过夜培养后离心分离获取菌体,再用0.85%的无菌生理盐水冲洗 3 次,调整菌液 OD600nm值为 1.0,将 1 mL 上述菌液接种到 50 mL 无机盐液体培养基 (毒死蜱含量为10 mg/L) 中,于30 ℃、180 r/min 摇床中培养。设置 1 组不加菌液的无机盐液体培养基作为对照。每组处理重复 3 次。分别于0 (4 h)、3、6、9、12、15、21 d 取样,使用酶标仪测定无机盐液体培养基中的菌株密度,并按实验室之前的方法[27]检测无机盐液体培养基中毒死蜱的残留量。
1.4 菌株定殖验证
水稻选取江苏省农科院粮食作物研究所培育品种,南粳“5055”。根据之前的研究[28],使用次氯酸钠 (3%,5 min)、无菌水 (3~5 次) 和乙醇(75%,5 min) 对水稻种子表面进行灭菌。消毒后的种子在30 ℃避光催芽,将出芽状况相近的水稻种子转移至水培系统中继续培养,待生长至三叶一心期开始试验。
为了评估 ST6 在水稻组织内的定殖能力,将成功导入绿色荧光蛋白基因的菌株 ST6-gfp 接种到含有抗生素的 LB 液体培养基中,在 30 ℃、180 r/min 的摇床培养 12 h。将菌液转移至无菌离心管中,在4 ℃、6000 r/min 离心 5 min,弃去上清液。用灭菌的生理盐水重悬、洗菌,重复 3 次。使用生理盐水调整菌悬液浓度,使 OD600nm值为1.0 左右。选择长势一致的三叶一心期水稻,用去离子水冲洗水稻根部,冲洗后的水稻分为两部分:一部分浸入生理盐水中作为空白对照组,另一部分浸在 ST6-gfp 菌悬液中作为处理组。分别在处理 6 h 及 4 d 后采集水稻样品,采用徒手切片法制备植物组织玻片,通过激光共聚焦显微镜观察内生菌在水稻组织中是否定殖及分布情况。
将定殖完成的水稻植株转移到含有 100 mL 水稻培养液的 200 mL 玻璃瓶中,该培养液中含有10 mg/L 毒死蜱;另一组在相同条件下种植,但不含毒死蜱。所有处理设置 3 次重复。分别在0 (4 h)、1、3、6、10、15 和 21 d 采集水稻根和茎叶样品,回收菌株 ST6-gfp。分别称取 0.5 g 新鲜的根和茎叶于75%乙醇中浸泡 5 min,然后在 0.3% 次氯酸钠溶液中进行表面消毒,再用无菌蒸馏水洗涤 5 次。吸取最后一次的洗涤液 100 μL 均匀涂布在 LB 固体平板上,以验证灭菌效率。将消毒完成的水稻组织重新转移到灭菌的 10 mL 离心管中,加入两颗灭菌的研磨珠及 2 mL 无菌水,在600 r/min下研磨 15 min。吸取 50 μL 研磨液均匀涂布在含氨苄青霉素 (100 mg/L)、卡那霉素 (25 mg/L)和四环素 (30 mg/L) 的 LB 固体平板上,30 ℃下 培养1~2 d,通过计数 LB 板上的 CFU 来确定根和茎叶中菌株的数量。
1.5 内生菌定殖对毒死蜱降解的影响
配制含有 10 mg/L 的毒死蜱水稻营养液。选择长势一致的三叶一心期水稻,按照 1.4 节方法将菌株ST6-gfp 定殖到水稻中。试验设置 4 个处理:(A) 30 mL 水稻营养液;(B) 30 mL 水稻营养液加入 600 μL OD600nm值为1.0 的内生菌菌悬液;(C) 30 mL 水稻营养液加入一株未接菌水稻及600 μL 去离子水;(D) 30 mL 水稻营养液加入一株接菌水稻及 600 μL 去离子水。以上每组处理设置 3 个重复。分别于0 (4 h)、3、6、9、12、15、21 d 采集水稻样品,按照实验室之前的方法检测水稻培养液及整株水稻中毒死蜱的残留量[27]。
1.6 内生菌产吲哚-3-乙酸和促生长活性测定
通过体外和盆栽试验,研究了从水稻中分离的内生细菌对植物生长的促进作用。采用Salkowski比色法确定细菌产生吲哚-3-乙酸 (IAA) 的能力[29]。
盆栽试验选取长势一致的三叶一心期水稻植株,按照 1.4 节方法将菌株 ST6-gfp 定殖到水稻中。设置 4 个处理组:(A) 未接菌水稻;(B) 未接菌水稻但喷施50 mL、10 mg/L 的毒死蜱;(C) 接菌水稻;(D) 接菌水稻同时喷施50 mL、10 mg/L的毒死蜱。以上每组处理设置 3 个重复。于施药30 d 后采集水稻样品,每6 株水稻为一组,测定水稻的株高、鲜重以及叶绿素含量。
1.7 内生细菌定殖对水稻酶活性与MDA 含量的影响
称取 4000 g 土壤,分为均等的两份:一份配制成含有 20 mg/kg 毒死蜱的带药土壤,一份为不含毒死蜱的空白土壤。选取长势一致的三叶一心期水稻植株,按照 1.4 节方法将菌株 ST6-gfp 定殖到水稻中。设置 4 个处理:(A) 空白土壤中加入一株未接菌水稻;(B) 空白土壤中加入一株接菌水稻;(C) 带药土壤中加入一株未接菌水稻;(D) 带药土壤中加入一株接菌水稻。以上每组处理设置3 个重复。菌株按照 1.4 节方法定殖到水稻中,48 h后采集水稻样品。
酶活性的提取、测定和分析使用商业检测试剂盒 (南京建城生物工程研究所),根据商品的说明书开展试验。在冰水浴条件下将整株水稻研磨成粉,精准称取水稻粉末 0.5 g 放入 10 mL 的离心管中,加入 4.5 mL 生理盐水 (pH 7.4) 充分混匀,于4 ℃、3500 r/min 条件下离心 10 min。取上清液即为供试样品的酶源,低温保存、备用。
1.8 统计分析
采用 Excel 2016、GraphPadPrism 8.0 和 origin 2021 软件制图。采用 SPSS 25.0 进行数据统计分析,不同处理组间差异性比较采用单因素方差分析 (ANOVA) 或 Tukey's 多重比较法进行显著性检验。
2 结果与分析
2.1 ST6 菌株的鉴定
从受污染的水稻中成功分离筛选到一株具有毒死蜱降解活性的内生菌 ST6,菌落培养特征和扫描电镜结果如图1 所示。其形态学特征如下:菌株 ST6 能以毒死蜱为唯一碳源生长,革兰氏染色呈阴性。细胞杆状,无鞭毛,不能运动;在 LB平板菌落圆形,乳白色不透明,边缘整齐,中间隆起,较黏稠。
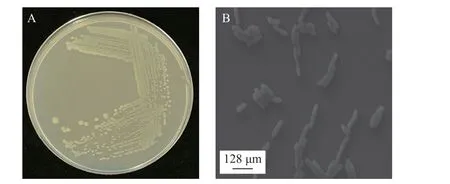
图1 菌株ST6 菌落形态 (A);菌株ST6 扫描电镜单菌形态 (B)Fig.1 Colony morphology of strain ST6 (A); the mono-bacterium morphology of strain ST6 under scanning electron microscopy (B)
通过将菌株 16S rRNA 序列与 Gen Bank 上其他 16S rRNA 序列进行 Blast 分析,发现菌株 ST6与嗜水气单胞菌Aeromonas hydrophila的相似性为100% (图2)。综合菌株形态特征以及 16S rRNA序列分析结果,初步鉴定菌株 ST6 为嗜水气单胞菌Aeromonas hydrophila。

图2 基于分离菌株ST6 与亲缘关系相近的菌株的16S rRNA 序列的邻接系统发育树Fig.2 Neighbor-joining phylogenetic tree based on the 16S rRNA gene sequences of strain ST6 and related strains
2.2 gfp 标记菌株的构建及其生物学特性
为了直观地展现菌株在水稻中的定殖和分布情况,采用三亲本杂交法将绿色荧光蛋白基因(gfp) 导入内生菌得到标记菌株 ST6-gfp,菌株在激光共聚焦显微镜下呈现绿色荧光 (图3),说明gfp 成功标记菌株 ST6。

图3 菌株ST6-gfp 荧光可视化Fig.3 Visualization of ST6-gfp strain
菌株 ST6 在 LB 液体培养基中的生长曲线如图4A 所示。菌株在 LB 液体培养基中生长良好,前 4 h 为迟缓期,菌体浓度无明显的变化,4~8 h为细菌对数生长期,菌体数急速上升,8 h 后菌体生长稳定,保持匀速生长,20 h 达到最大值后生长稳定,菌体增值数与死亡数渐趋平衡。菌株ST6-gfp 和 ST6 表现出相似的生长动力学 (图4B),说明 gfp 标记对细菌生长的影响可以忽略不计。
菌株ST6 可以利用毒死蜱作为唯一的碳源生长,并降解无机盐液体培养基中的毒死蜱。图4显示了菌株 ST6 及其 gfp 标记菌 (ST6-gfp) 对毒死蜱的降解动力学及其在无机盐液体培养基中生长趋势。接菌后,无机盐液体培养基中毒死蜱的残留量随时间的延长而下降,在15 d 时,ST6(图5A) 和 ST6-gfp (图5B) 分别降解无机盐液体培养基中 38.6%和 37.9%的毒死蜱,这表明 gfp 标记对菌株的降解效率无显著影响。整个试验期间,菌株 ST6 和 ST6-gfp 表现出相似的生长趋势,在无机盐液体培养基中生长较为平缓,可能是由于无机盐液体培养基中不断积累的毒死蜱降解代谢物阻碍了菌株的生长[30-31]。朱云鹏[32]从受污染的土壤中筛选出一株Burkholderia contaminansA3,发现其在12 h 内可以降解 76.4%的毒死蜱(50 mg/L);杜晓敏[33]筛选出的Bacillus subtilisH27,在 24 h 可以稳定降解无机盐液体培养基中80%的毒死蜱 (25 mg/L);Aswathi 等[34]从农药厂被污染的土壤中筛选出一株Pseudomonas nitroreducensAR-3,其在8 h 内可降解 97%的毒死蜱 (40 mg/L);Li 等[35]从农药厂废水中分离出的Sphingomonassp.DSP-2,在 24 h 内可降解无机盐液体培养基中100%的毒死蜱 (100 mg/L);Feng 等[25]从水稻中分离得到的Bacillus megateriumRRB,在 12 d 内降解了无机盐液体培养基中50%的毒死蜱 (20 mg/L)。相对于从土壤、污泥或污水等特殊环境中分离筛选出的降解菌,植物内生菌对毒死蜱的降解活性偏低[25-27],这可能与内生菌分离自植物体内、通常不会遭受高水平的毒死蜱胁迫有关。植物内生菌更重要的优势在于其可定殖在植株体内,提高植物对环境污染的耐受性,促进宿主植物生长,增强植物对污染物的代谢降解等[36-37]。

图5 菌株ST6 (A) 及ST6-gfp (B) 在无机盐液体培养基中的生长曲线及毒死蜱降解曲线Fig.5 Growth curves of strain ST6 (A) and ST6-gfp (B) and degradation dynamic of chlorpyrifos (CPF) in MSM
2.3 ST6-gfp 在水稻中的定殖能力
菌株在水稻中的定殖情况如图6 所示:接种6 h 后,菌株成功定殖到水稻组织中,并转移到水稻植株的不同部位;接种 4 d 后,在水稻植株不同组织中仍可观察到细菌 ST6-gfp。
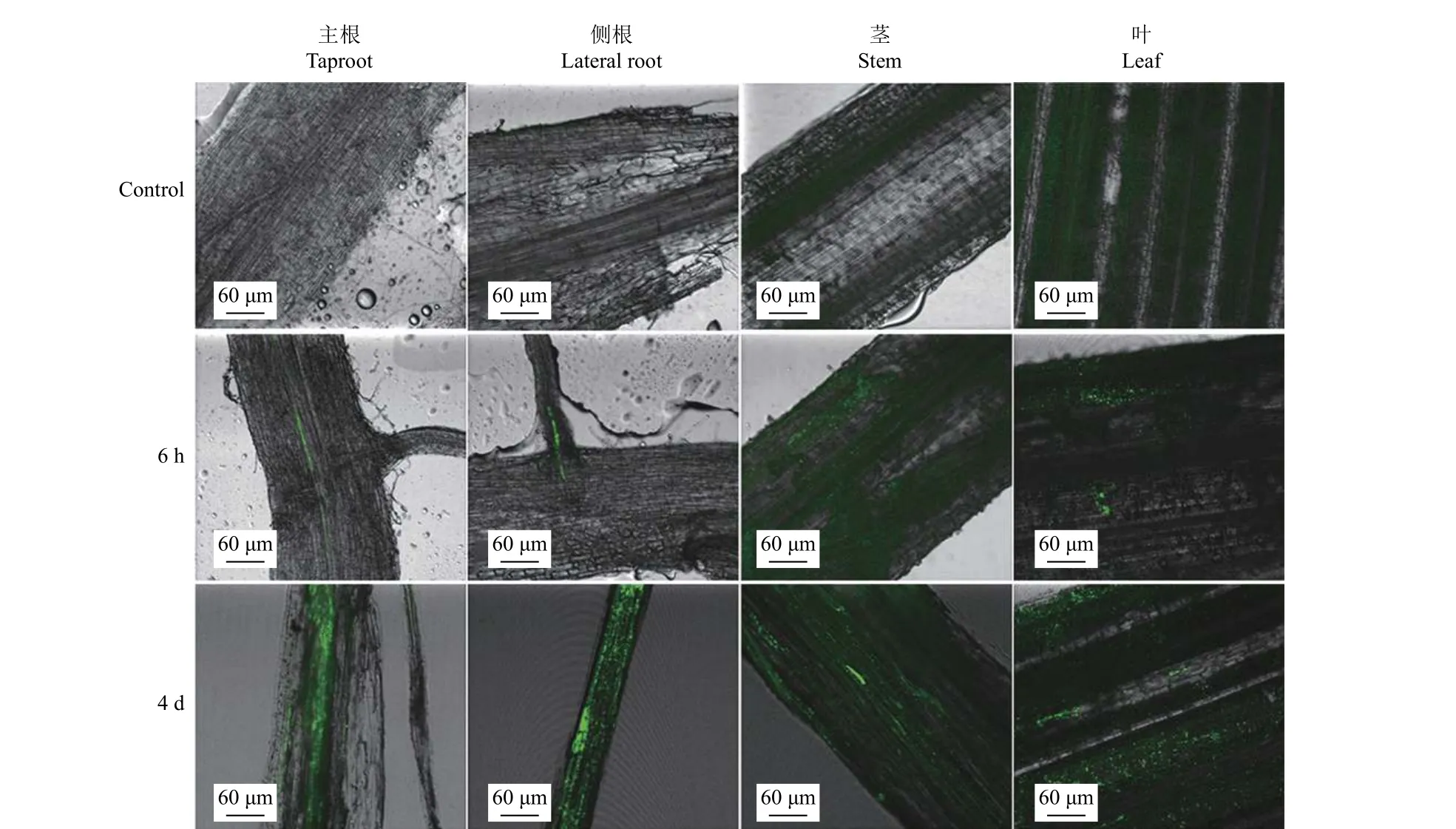
图6 植物组织内ST6-gfp 的可视化Fig.6 Visualization of ST6-gfp within plant tissues
为了验证菌株在水稻组织中的定殖,采用抗生素标记法[38-40],跟踪菌株在不同处理方式下水稻组织中的定殖数量及动态变化规律。图7 为不同处理方式下菌株 (ST6-gfp) 在水稻地上部 (图7A)和地下部 (图7B) 中的数量变化。可见在 21 d 的时间里,水稻植株地下部的菌株数量为 7.0~7.2 log CFU/g,地上部中为 4.9~5.1 log CFU/g;与空白处理组相比,毒死蜱处理组的水稻组织中的菌株数量相对更多,这与本课题组之前的研究结果类似[41-42]。本研究结果表明,菌株可以在水稻组织中成功定殖,并且在水稻中可长时间存活,菌株在水稻组织中的数量整体呈现出先升高后降低的趋势,且地下部的细菌数量显著高于地上部,这也与激光共聚焦显微镜的观察结果(图6) 一致。水稻植株的根系直接与菌液接触,菌株更容易在水稻根部定殖,而地上部中菌株的数量则反映了菌株在水稻组织中随水分运输等作用的转移能力。在毒死蜱处理下,菌株在水稻中定殖数量显著高于对照,说明毒死蜱胁迫促进了 ST6-gfp 在水稻中的定殖。我们推断,在受到胁迫情况下,水稻会牺牲部分既得利益允许更多有益菌定殖,帮助其对抗胁迫。
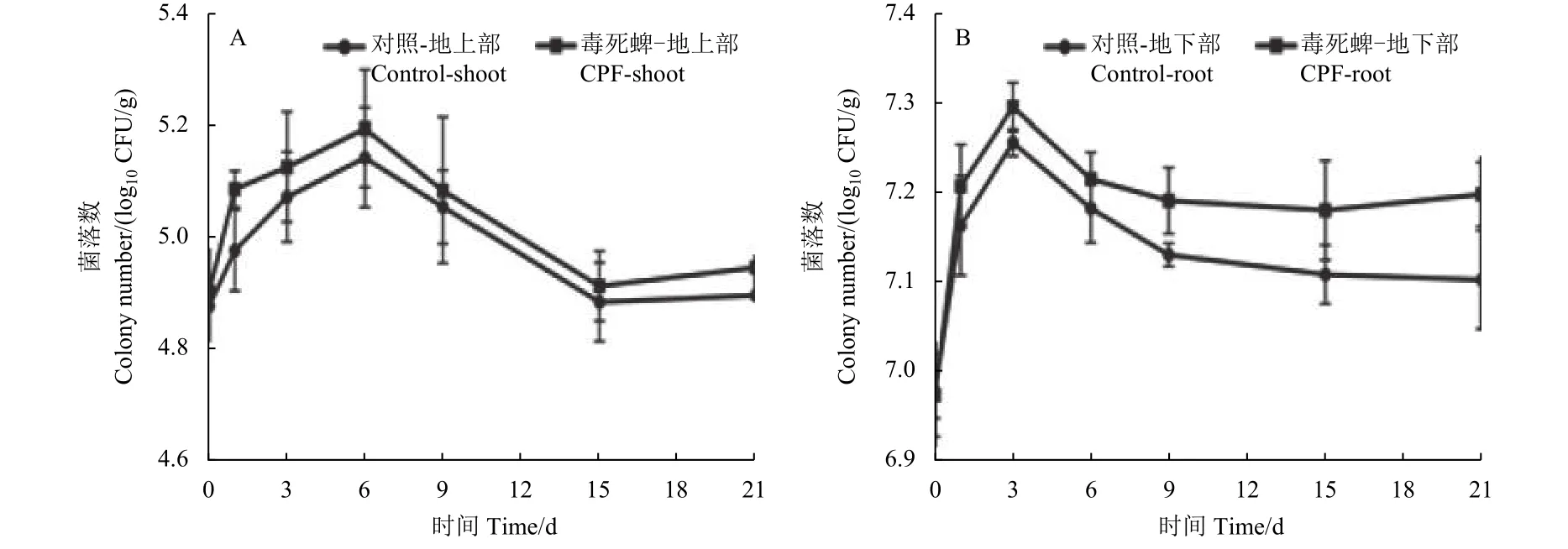
图7 毒死蜱处理或不处理的接种水稻中观察到的ST6-gfp 在地上部 (A) 和地下部 (B) 中的菌株数量Fig.7 Colony number of ST6-gfp strains in aboveground (A) and belowground (B) observed in inoculated rice with or without CPF treatments
2.4 内生细菌定殖对毒死蜱降解的影响
在21 d 试验期间,接种细菌和未接种细菌水稻植株中毒死蜱的含量见图8。接菌的水稻植株在试验初期表现出较高的毒死蜱积累能力 (图8A),培养3 d 后水稻植株中毒死蜱的含量达到了 86.8 mg/kg,为未接菌水稻的 1.1 倍,而在相对应的营养液中,接菌水稻的营养液中毒死蜱含量相对于未接菌的更低 (图8B)。在21 d 时,接菌水稻中毒死蜱的残留含量为 6.0 mg/kg,与未接菌水稻相比,接菌水稻保持较低的毒死蜱残留水平。研究结果表明,ST6-gfp 在前期促进了水稻对种植环境中毒死蜱的吸收,降低了种植环境中毒死蜱的含量,然后通过内生菌与水稻之间的相互作用,进一步加速了水稻植株中毒死蜱的降解[25-28,41]。先前的研究也表明,内生菌在辅助植物降解农药过程中起到了重要作用[41]。

图8 水稻植株 (A) 和水培培养液 (B) 中毒死蜱的残留量变化Fig.8 Residues of CPF in the rice plants(A) and hydroponic medium(B)
图8B 显示了毒死蜱在水稻营养液中的降解趋势,在 21 d 时,对照培养液中近 28.4% 的毒死蜱被降解,在添加有菌株 (ST6-gfp) 的培养液中大约53.2% 毒死蜱被降解。超过 90.3% 的毒死蜱在接菌水稻的营养液中降解,与未接菌水稻营养液相比,降解率增加了22.3%。各处理中毒死蜱的半衰期分别为 49.5、19.6、10.5、5.6 d (表1),说明菌株定殖水稻也可以显著提高种植环境中毒死蜱的降解。值得注意的是,尽管菌株在无机盐液体培养基中的降解能力不是很显著,但接种到水稻植株后却能促进水稻植株的生长 (表2),进而促进水稻植株及种植环境中毒死蜱的降解。近年来,利用植物内生菌进行污染物的降解已成为研究热点[43],Liu 等[22]从野生水稻中筛选的内生菌Bacillus amyloliquefaciensL381,能够去除水稻植株中93.4% 的邻苯二甲酸盐;Nasrollahl 等[44]从水稻中筛选出的内生菌B.altitudinisDB26-R 对水稻植株中二嗪磷的降解率高达 80%。由此可见,利用植物内生菌与植物之间相互作用,对环境中残留污染物进行降解,会成为农业安全生产及环境修复的新出路。

表1 各处理培养液中毒死蜱的生物降解动力学参数Table 1 CPF biodegradation kinetic parameters in each treatment
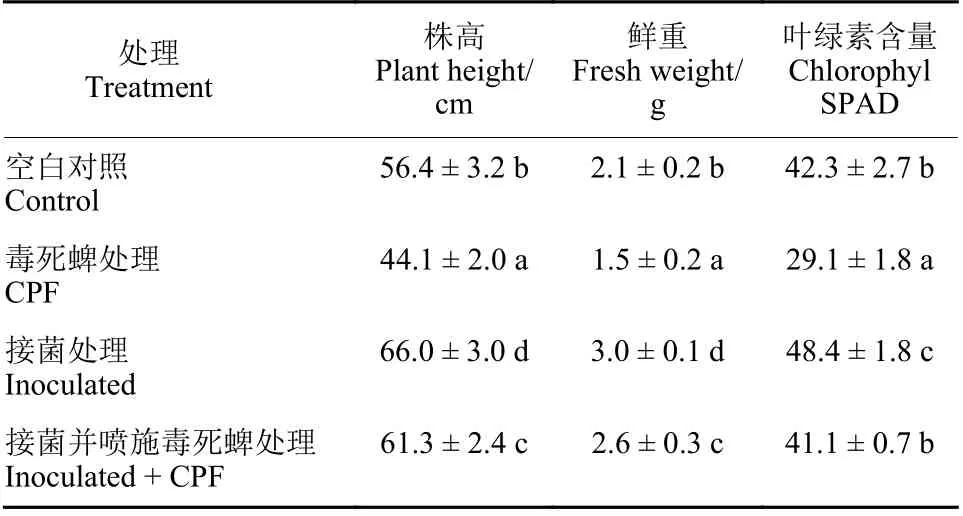
表2 毒死蜱胁迫下内生菌定殖水稻生物量的变化Table 2 Changes in the biomass of rice colonized by endophytic bacteria under CPF stress
2.5 内生菌产IAA 能力和促生长活性测定
盆栽试验结果 (表2) 表明,ST6-gfp 可显著促进水稻的生长,接菌水稻的株高、鲜重、叶绿素含量均高于对照组。毒死蜱处理组水稻的生物量显著低于空白对照组,说明喷施毒死蜱影响了水稻的生长,与毒死蜱处理组相比,接菌水稻生物量在毒死蜱处理下均有显著的提升。在毒死蜱处理下,接菌水稻的株高、鲜重和叶绿素含量30 d后几乎恢复到无毒死蜱胁迫水平,与未接菌毒死蜱处理组相比,除了鲜重增加 69.5% 外,株高和叶绿素含量分别增加了 38.9% 和 41.5%。试验结果表明,菌株定殖促进了水稻植株的生长,缓解了因毒死蜱胁迫而给水稻带来的损伤。Gorai 等[45]从鹰嘴豆分离得到Bacillus siamensisCNE6 可以改善鹰嘴豆植株整体生长;岳远浩[26]从水稻中筛选出的3 株内生菌 (DJ-1、2、3) 均对水稻的生长产生了促进作用,并能加速水稻植株中毒死蜱的降解。
IAA 作为重要的植物激素之一,在植物生长和发育中起着关键作用[46]。由表3 数据可知,菌株ST6-gfp 24 h 内产生 IAA 的量为 29.6 mg/L。Zhao 等[47]从土壤中筛选出的菌株BurkholderiaP5在 3 d 能够产生 18 mg/L 的IAA;Borah 等[48]从野生水稻中分离的菌株MicrococcusRS01-11 24 h 产生了28.4 mg/L 的IAA;Liu 等[22]从野生水稻中筛选得到的内生菌Azorhizobium caulinodansL131,24 h 产生了 22.3 mg/L 的 IAA,与文献中IAA 的产量相比,菌株 ST6-gfp 的 IAA 产量相对较高。Barbieri 等[49]通过在植物根部引入属于偶氮螺旋菌属的细菌,证明了生长素在促进生长中的作用。能产生 IAA 的菌株可增强植物的养分吸收,从而减轻胁迫反应并促进胁迫条件下的植物生长[50]。

表3 表3 菌株24 h 产生 IAA 的含量Table 3 The amount of IAA produced by the strains for 24 h
2.6 内生菌定殖对水稻酶活性及 MDA 含量的影响
农药对植物的胁迫可能影响植物的各种生理生化反应和产生氧化损伤,也能够诱导活性氧(reactive oxygen,ROS)在细胞内爆发,从而破坏植物细胞[51]。从图9 可知,毒死蜱含量为 0 mg/kg时,接菌水稻与未接菌水稻的抗氧化酶活性及 MDA含量无显著差异;毒死蜱含量为 10 mg/kg 时,未接菌水稻的抗氧化酶活性及 MDA 含量显著提升,而苯丙氨酸解氨酶(PAL)的活性下降,说明毒死蜱胁迫致水稻体内保护酶系统的活力和平衡受到破坏,使活性氧积累,启动并加剧膜脂过氧化而造成水稻植株的损伤。本试验结果还显示,在毒死蜱含量为 10 mg/kg 时,接菌水稻抗氧化酶活性和 PAL 活性进一步提升,与未接菌水稻相比,超氧化物歧化酶 (SOD)、POD、抗坏血酸过氧化物酶 (APX)、谷胱甘肽还酶 (GR)、过氧化氢酶 (CAT) 和PAL 酶活性分别提升了 1.1、1.3、1.2、1.8、1.2 和 1.7 倍,而 MDA 含量却恰好相反,接菌水稻中 MDA 含量相比于未接菌水稻降低了46.9%,说明接菌诱导水稻植株体内抗氧化酶系酶活性提高,可以有效清除一部分活性氧,减轻了毒死蜱胁迫给水稻造成的过氧化损伤。钱永强等[52]研究结果表明,POD 和 CAT 是植物抗氧化酶系统的重要成员,它们分别分解活性氧和自由基氧化产生的过氧化物和过氧化氢,消除其对细胞的伤害,减少 MDA 的产生。
内生菌定殖水稻对CYP450 和GST 的影响如图9 所示,毒死蜱处理后的未接菌水稻组织中CYP450 和GST 的含量显著上升,分别是未经毒死蜱处理水稻组的1.7 和1.5 倍,表明毒死蜱可以诱导水稻植株中 CYP450 以及 GST 的活性上升,推测解毒酶系在植物对毒死蜱的代谢中发挥了一定的作用。谭丽蓉的研究结果表明,水稻在除草剂莠去津(阿特拉津)胁迫下,叶片中 CYP450 的含量显著增加[53]。在毒死蜱胁迫下,接菌水稻中CYP450 和 GST 的含量进一步升高,接菌水稻的叶片中 CYP450 酶活力达到了 17.5 U/g,GST 活力达到 38.5 U/mg prot,相比于没有毒死蜱胁迫的处理组,GST 活力提高了 2.4 倍,CYP450 提高了4.0 倍。结果表明,ST6-gfp 定殖提高了解毒酶的活力,缓解了植物的氧化胁迫损伤,提高植物对毒死蜱的耐受能力。

图9 毒死蜱胁迫和无毒死蜱胁迫情况下,接菌水稻和未接菌水稻酶活性和MDA 含量Fig.9 Enzyme activities and MDA content of inoculated and non-inoculated rice with or without CPF stress
在研究中,接菌处理的水稻植株抗氧化酶 (如SOD、POD 和 CAT) 的活性得到改善,并显著降低了 MDA 含量。这些结果表明,ST6-gfp 增强了水稻的抗氧化能力和解毒能力[54]。
3 结论
本研究从毒死蜱污染水稻中筛选得到一株内生嗜水气单胞菌 ST6,该菌具有毒死蜱降解功能和促生功能。gfp 基因标记技术追踪结果显示该菌株可良好地定殖于水稻中。ST6-gfp 定殖后能显著提高水稻抗氧化酶系和解毒酶系的活力,促进水稻及种植环境中毒死蜱的降解,缓解毒死蜱对水稻造成的胁迫损伤。
这些结果为利用内生菌清除植物或种植系统内的农药残留提供了新的启示,它可以在不影响农业生产的情况下对农业系统中的农药残留进行修复。为了更好的在农业生产中应用内生菌削减农药等有机污染物,还需要对内生菌与植物互作的分子机制进一步研究。