基于证据推理的反应物浓度变化问题探讨
2023-04-17左传鹏周万明
左传鹏 周万明
(湖南省长沙市长郡中学)
一、发现问题
【例1】(2019年江苏卷,15题节选)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
( )
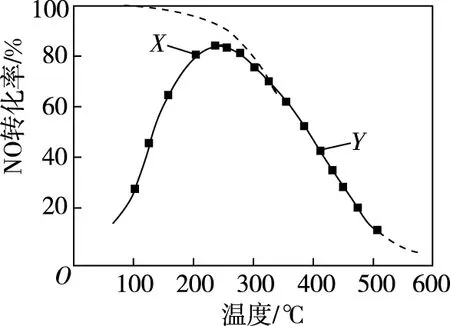
D.380℃下,c起始(O2)=5.0×10-4mol·L-1,NO平衡转化率为50%,则平衡常数K>2 000
在高三复习备考过程中,笔者发现不少学生在做2019年江苏卷第15题的D选项时是这样分析的:
设起始时c(NO)=amol·L-1,则:

起始(mol·L-1)a5.0×10-40
转化(mol·L-1) 0.5a0.25a0.5a
平衡(mol·L-1) 0.5a5.0×10-4-0.25a0.5a
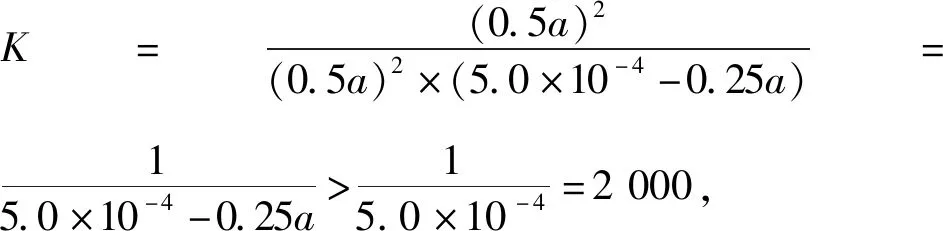
上述解答过程是按恒容情况得出的,可本题在信息中给出的条件是“恒压”,在恒压情况下,体积发生了改变,不能采用浓度三段式列法,笔者认为上述分析方法值得商榷。设起始投入bmol NO和5.0×10-4mol O2,体积为1 L,平衡时体积为VL,列物质的量三段式如下:

起始(mol)b5.0×10-40
转化(mol) 0.5b0.25b0.5b
平衡(mol) 0.5b5.0×10-4-0.25b0.5b
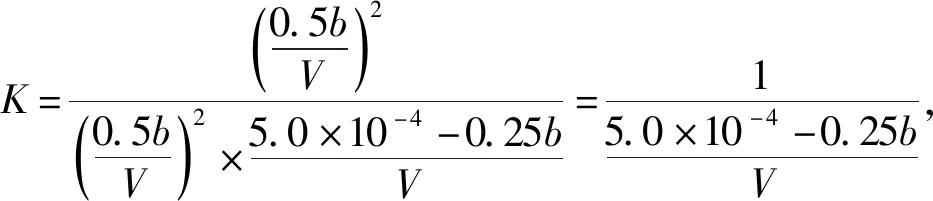
二、问题探讨

不妨设往恒温恒压密闭容器中投入amol N2和bmol H2,N2转化xmol,初始体积为V1L,反应至平衡时体积为V2L,列物质的量三段式如下:

起始(mol)ab0
转化(mol)x3x2x
剩余(mol)a-xb-3x2x
那么,N2浓度是不是也减小呢?
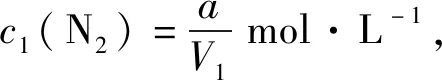
讨论:①当a


(1)如果m+n=p,容器体积不变,A的物质的量减少,A的浓度减小;
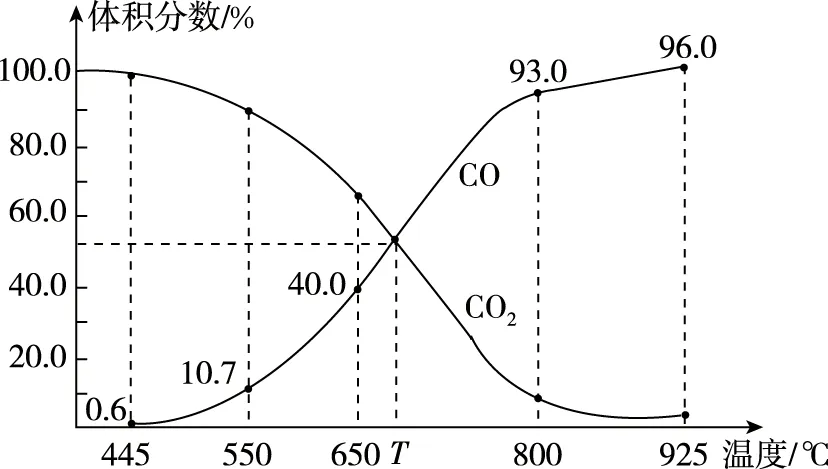
(2)如果m+n (3)如果m+n>p,容器体积减小,难以由定义判断A的浓度的变化情况。 下面针对情况(3),即恒压容器中气体化学计量数减小的可逆反应,笔者建立反应物A的浓度[c(A)]或反应物A的体积分数[φ(A)]与A消耗的物质的量(x)的函数关系式,采用高中学生熟悉的数学求导方法来探讨。 导数法的一个重要应用是确定函数的单调性。在某区间内,①如果f′(x)>0,那么函数y=f(x)在这个区间单调递增;②如果f′(x)<0,那么函数y=f(x)在这个区间单调递减;③如果恒有f′(x)=0,则y=f(x)为常数函数。 方法一:对浓度函数求导 设起始A、B的物质的量分别为amol、bmol,容器体积为1 L。反应一段时间后,A减少了mxmol。列三段式 起始/molab0 转化/molmxnxpx 剩余/mola-mxb-nxpx 讨论:a+b>a,①当m≥m+n-p,c′(A)<0,说明c(A)为单调递减函数,随着反应正向进行c(A)逐渐减小; ②当m 方法二:对体积分数函数求导 讨论:a+b>a,①当m≥m+n-p,φ′(A)<0,说明φ(A)为单调递减函数,故随着反应正向进行c(A)逐渐减小; ②当m 综上,方法1和方法2得出相同结论:当反应物A的化学计量数大于或等于反应的气体化学计量数之差时,说明反应物A的浓度减小;当反应物A的化学计量数小于反应的气体化学计量数之差时,需知晓该反应的化学计量数及投料量,才能确定反应物浓度的变化情况。 ( ) C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 对C项解析:观察图像知,在T℃反应达平衡时,CO和CO2的体积分数均为50%,当充入等体积的CO2和CO,二者的体积分数不变,恒压时体积分数与浓度成正比,故二者的浓度也保持不变且仍然相等。因此,Qc=K,平衡不移动,故C项错误。 物质的量浓度的定义是一个比值定义,它与物质的量及体积两个物理量有关。气体分子数减小的可逆反应在恒压密闭容器中进行时,由于反应物的物质的量与容器体积均减小,反应物的浓度的变化有多种可能性。通过函数求导法探讨得到反应物浓度的变化规律和判断方法:当反应物的化学计量数大于或等于反应的气体化学计量数之差时,反应物的浓度会减小;当反应物的化学计量数小于反应的气体化学计量数之差时,只有知晓该反应的化学计量数及投料量,才能确定反应物的浓度变化情况。
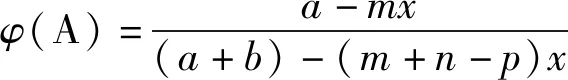


三、结语

