循“依标教学” 重“实践应用”
——梳理三年高考表格实验题看2023高考实验复习备考
2023-04-17吕艳
吕 艳
(新疆乌苏市第一中学)
化学实验是培养学生化学学科素养的重要路径,承载动手、观察、表述、分析、探究等多重能力培养的功能,其考查方式一般为方案设计类和结果分析类,同时派生出多个触角,围绕元素的性质和制备、元素周期律、化学反应原理等知识,在实验安全、实验操作、实验现象的观察和表述、实验原理的探究和验证、实验结论的论证等细节处进行考查。教育部教育考试院在“2022全国高考命题总体思路”一文中明确:高考试题严格依据高中课程标准,确保内容不超范围、深度不超要求。遵循教育规律,加强教考衔接,注重通用方法,强调在深刻理解的基础上融会贯通、灵活应用,让学生掌握原理、内化方法、举一反三,主动进行探究和深层次学习。
化学实验,包罗万象,不拘一格。可以聚焦在安全标识的细微处,也可以囊括元素化合物、化学反应原理的知识。落点多、触角多,如何在高考复习备考中持续、有效地开展化学实验复习?本文从表格实验题入手,多角度分析近三年高考客观试题的考查内容、考查形式和考查角度,聚焦课程标准的学业质量要求,以此反观2023高考复习备考,希望形成考教融合的实验复习备考策略。
一、多维度看表格实验题的考查方式
本文统计了2020~2022年的17套试题中的22道表格实验题(包含全国高考试题6套,各地高考、选考科目考试及学业水平选择性考试试题11套),从考查形式、考查内容、知识的载体等多角度剖析表格实验题。
说明:本文后续的统计均以笔者选定的22道题作为参照。
(一)从考查形式和考查频次看表格实验题
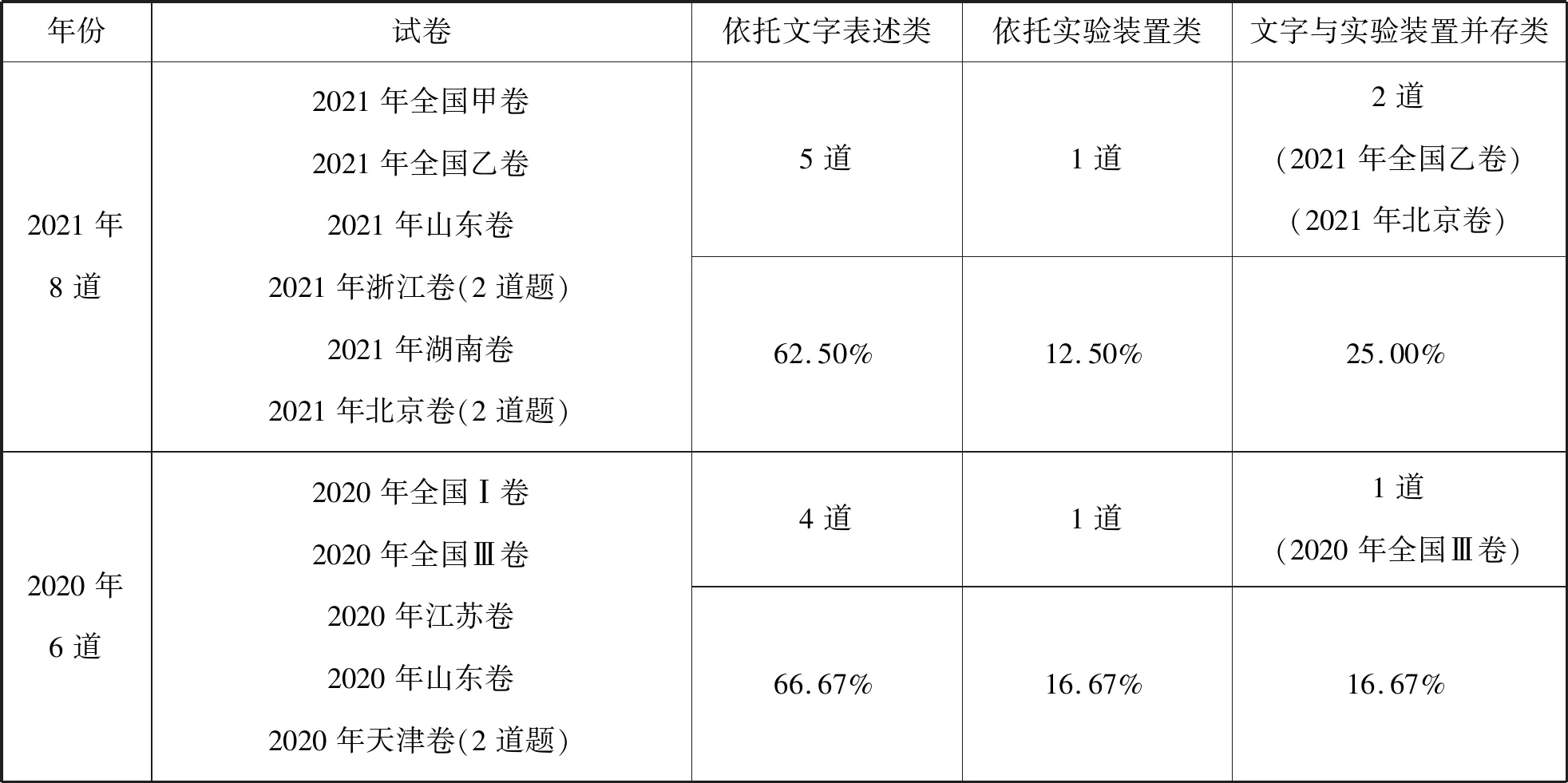
17套试卷22道表格实验题目,题干的考查形式主要呈现三种方式:依托文字表述,考查四个选项与题干要求的吻合度,有13道,占比59.10%;依托实验装置,考查实验目的与实验仪器选择、操作规范、药品存放等,有4道,占比18.18%;题干同时依托实验装置和文字描述的共计5道,出现在2022年北京卷、2021年全国乙卷、2021年北京卷、2020年全国Ⅲ卷,占比22.73%。具体为:
续表
从统计数据可以看出近三年表格实验题考查方式的微小变化,其中:
以文字表述为载体的表格实验题占比近三年从66.67%下降至50.00%,以实验装置为载体的表格实验题占比从16.67%增加至25.00%,以文字和实验装置双重表述为载体的表格实验题占比从16.67%增加至25.00%。
同时,对比22道试题中四个选项关系,14道试题为平行的并列关系,即四个选项为四个单独的考查点;6个试题呈现总分关系,即四个选项围绕一个任务进行分项讨论、探究、辨析或验证;1道试题结构和选项之间呈现对比,是2022年北京卷“铁上电镀铜的实验探究”,硫酸铜溶液中滴加少许硫酸和过量氨水形成电镀液环境对比,讨论不同现象出现的原因;1道试题题干与选项呈现维恩关系(部分交叠),是2021年北京卷“实验室制备下列气体所选试剂、制备装置及收集方法”,考查气体与试剂、装置、收集方法的匹配。具体为:
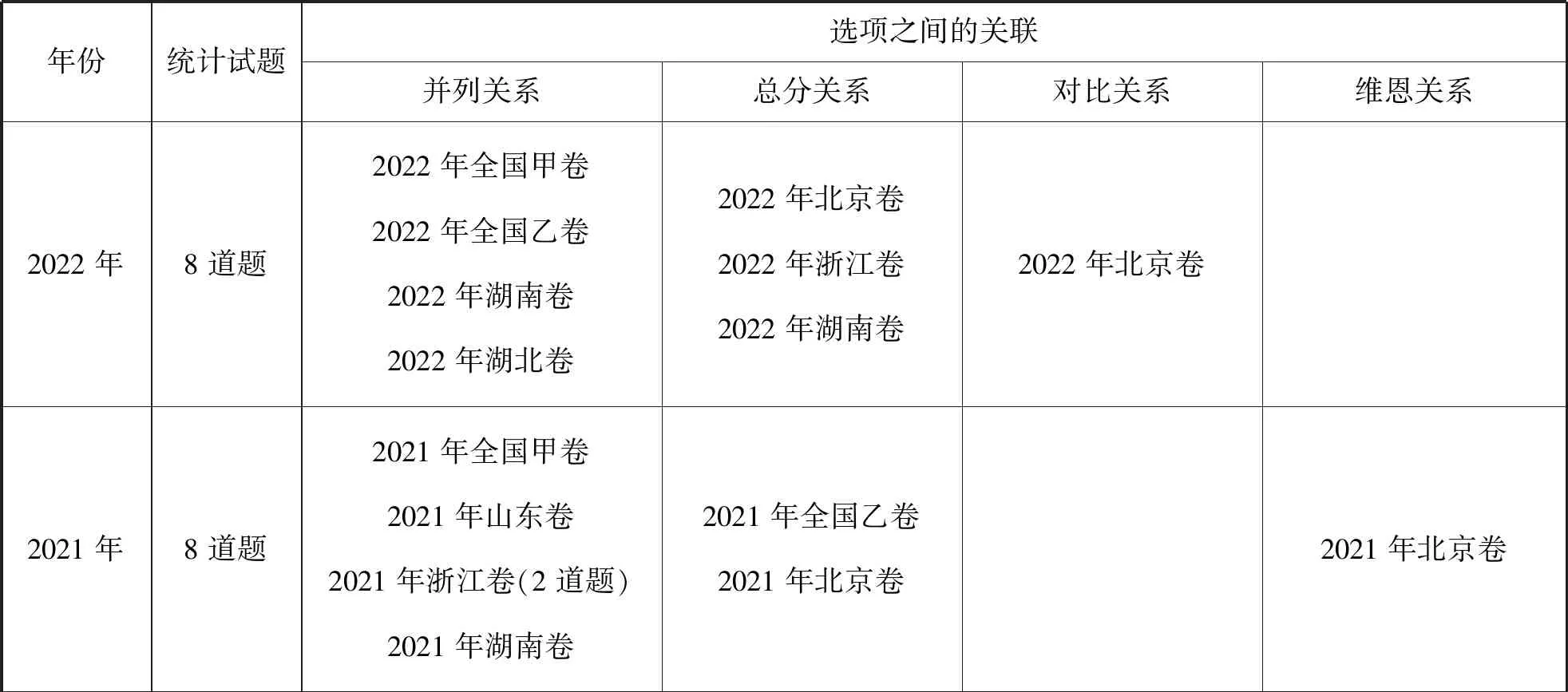
表2 表格实验题的题干与选项的关系
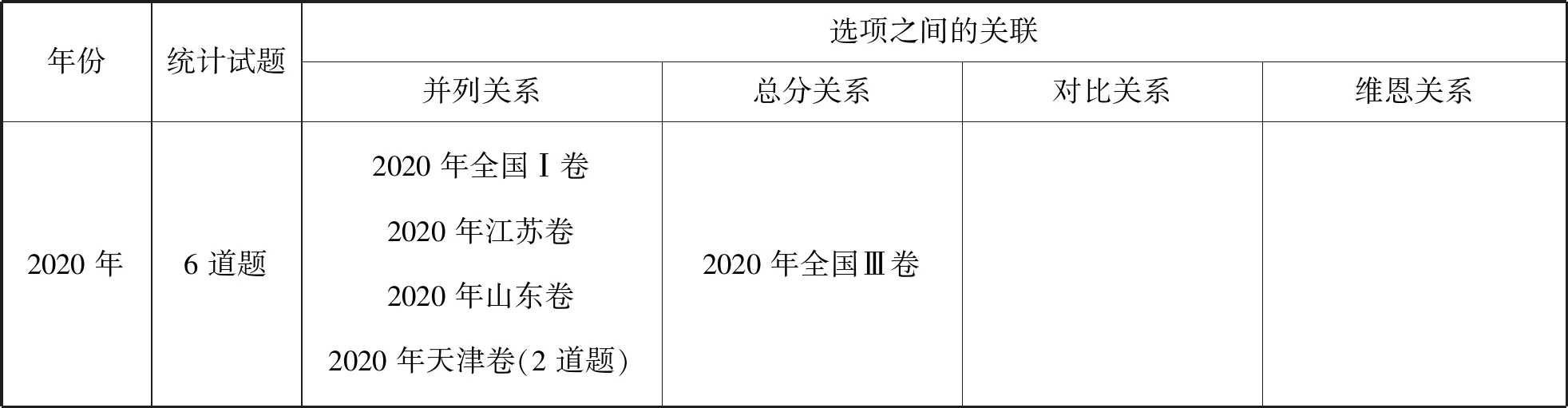
续表
由以上分析总结:2023复习备考,依照复习进度和复习内容,需要关注课本实验、从实验的操作、实验细节点的复盘入手,对实验设计、对应的现象和与之匹配的实验结论需要严谨表述;同时,涉及物质性质的验证、性质的预测、原理的验证,仅靠“看图说话”是不可取的,必须与元素化合物、元素周期律、化学反应原理的复习有机融合。
(二)从学业水平质量要求看表格实验题
学业质量是学生在完成学科课程学习后的学业成就表现,是化学学科核心素养及其表现水平的主要维度,也是“依标教学”的本源所在。普通高中化学课程标准将化学学业质量水平划分为4级,结合学业质量描述,笔者将其与对应高考试题进行分类分析。
1.学业水平第一层级,对实验提出的要求是:能依据化学问题解决的需要,选择常见的实验仪器、装置和试剂,完成简单的物质性质、物质制备、物质检验等实验;能与同伴合作进行实验探究,观察、记录实验现象,能通过实验现象形成初步的结论,侧重素养3证据推理与模型认知。
【例1】(2021年北京卷,5题)实验室制备下列气体所选试剂、制备装置及收集方法均正确的是
( )

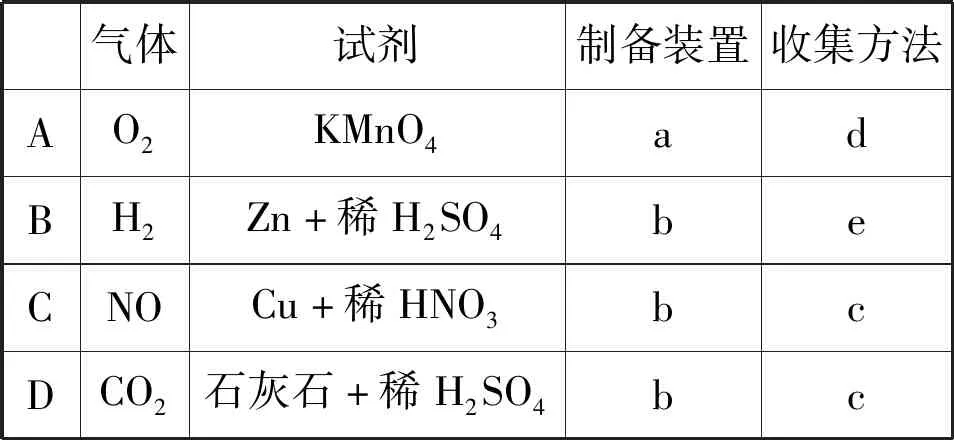
气体试剂制备装置收集方法AO2KMnO4adBH2Zn+稀H2SO4beCNOCu+稀HNO3bcDCO2石灰石+稀H2SO4bc
【答案】B
2021年北京卷这道表格实验题,题干与四个选项呈现维恩关系,即交叉关系。以最为熟悉的两个气体发生装置和三个气体收集装置为题干,考查氧气、氢气、一氧化氮、二氧化碳四种气体的药品选择、对应发生装置的选择、气体收集方式的选择。这道试题考点不新但是考法很新,透过试题,我们可以预见命题者期望通过这样一道试题,来判断学生是否具备简单气体制备的思维模型、是否具备依据要求解决实际问题的能力。
在《普通高中化学课程标准(2017年版2020年修订)》中,对“化学科学与实验探究”主题的学业要求:能根据不同类型实验的特点,设计并实施实验。
那么在复习中,教师也应该与学生一起,从不同维度来看气体的制备。一轮复习可以对每一种气体的发生装置、净化装置、收集装置、尾气处理装置进行线性梳理;二轮复习就需要围绕一个核心点,网状拓宽、构建与之关联的因素,形成灵活可用的气体制备的思维模型。这样,学生依据思维模型,就可以进行组合、拼接、重组,完成多种药品条件限定、多种仪器组合的制备装置选择。比如,以气体发生装置为中心点的拓展思维模型构建。如图1:
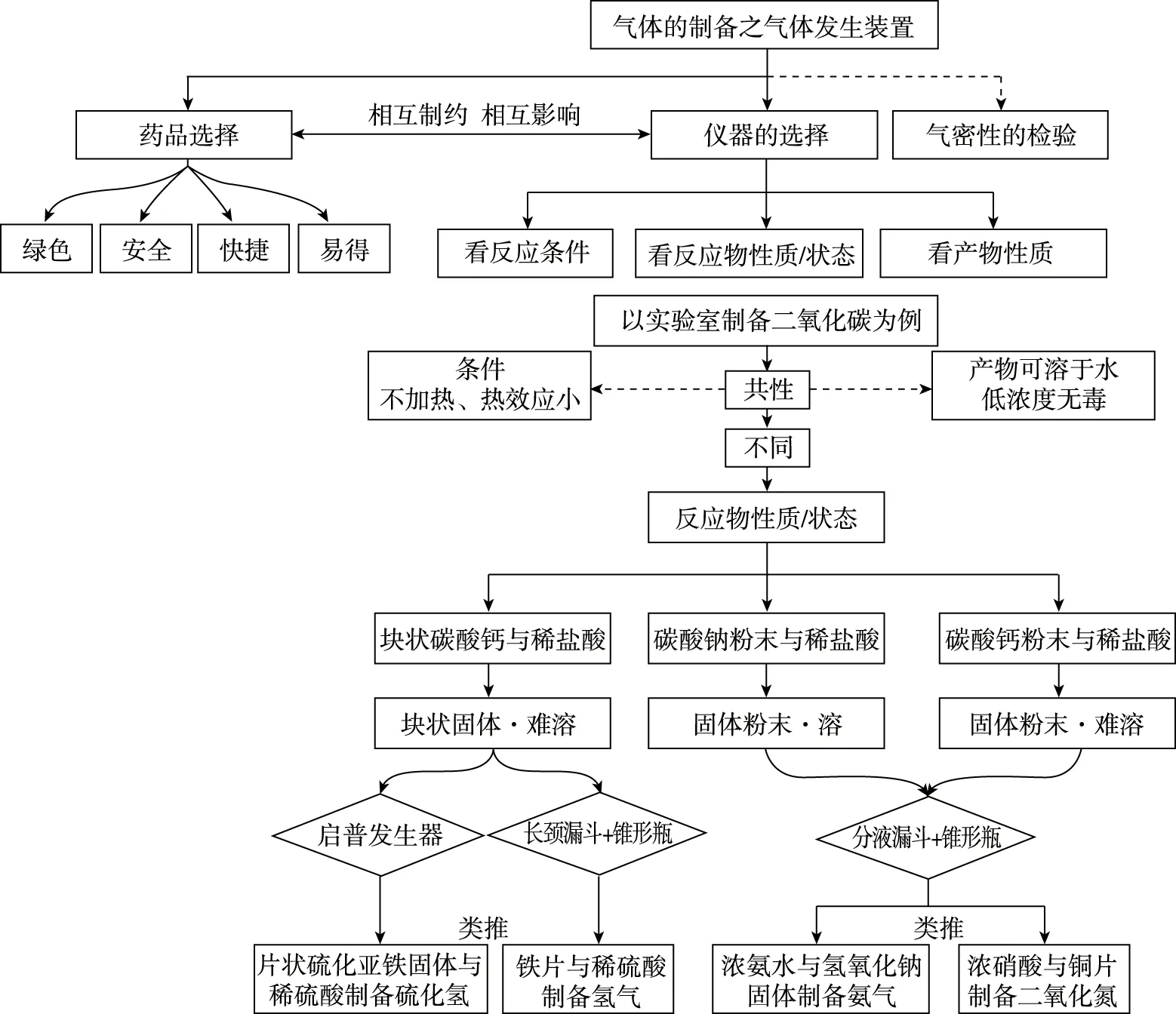
图1 气体发生装置
2.学业水平第二层级中对实验部分提出的要求是:能通过实验探究物质的性质和变化规律,提出有意义的实验探究问题,能根据已有经验和资料作出预设和假设,能设计简单实验方案,能运用适当的方法控制反应条件并顺利完成实验,能收集和表述实验证据,基于实验实施得出结论。侧重素养3证据推理与模型认知。
【例2】(2022年6月浙江卷,25题)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是
( )
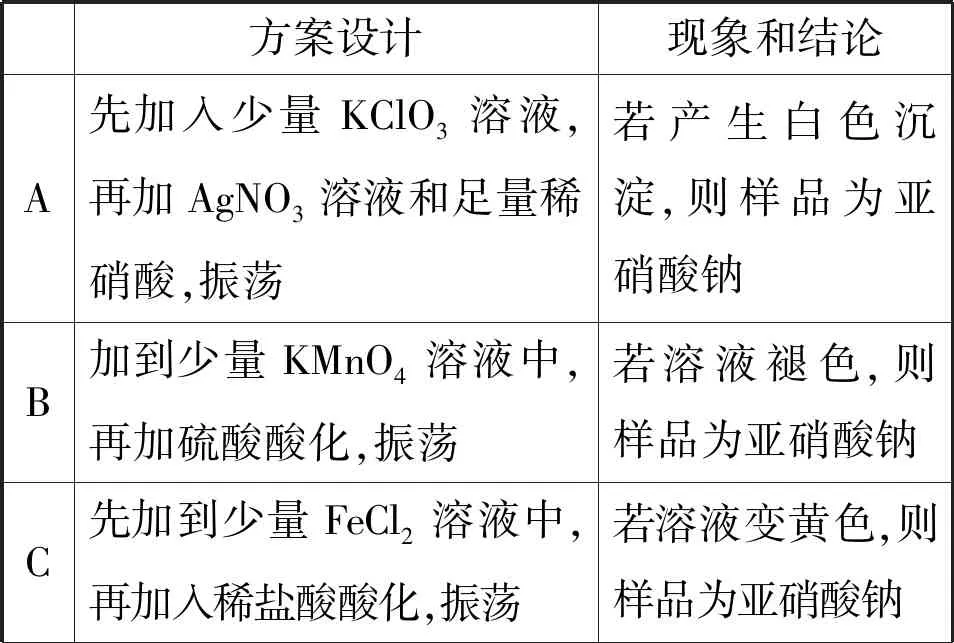
方案设计现象和结论A先加入少量KClO3溶液,再加AgNO3溶液和足量稀硝酸,振荡若产生白色沉淀,则样品为亚硝酸钠B加到少量KMnO4溶液中,再加硫酸酸化,振荡若溶液褪色,则样品为亚硝酸钠C先加到少量FeCl2溶液中,再加入稀盐酸酸化,振荡若溶液变黄色,则样品为亚硝酸钠
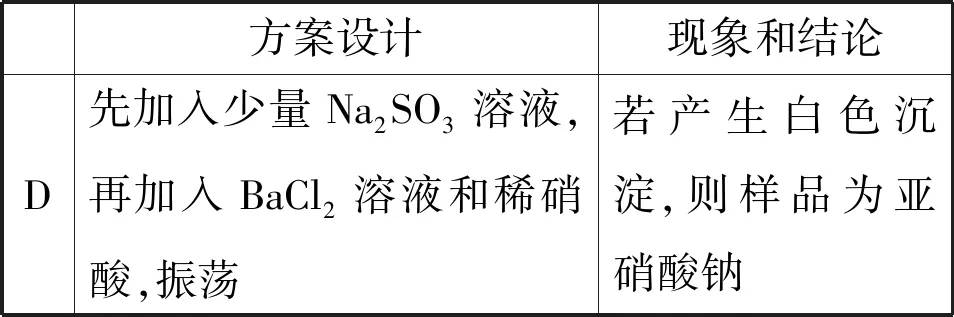
续表
【答案】C
在《普通高中化学课程标准(2017年版2020年修订)》中,对“常见无机物及应用”主题的学业要求:能从物质的类别、元素的化合价的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。
依托本题的考查形式,复习中,教师可以与学生一起,一轮复习构建起研究物质性质的基础认知模型,二轮复习在此基础上进行完善和拓展。

图2 研究物质的性质一般流程
一般而言,研究物质的性质,分为4个基本步骤:通过物质组成判断所属类别、依据所属类别物质的共性和典型代表物的性质来预测陌生物质性质、实验设计和验证、确认物质的性质。化学实验是物质认知模型的关键环节,承上启下:承上,能结合物质归属预测物质的性质,并完成实验设计;启下,能通过实验的宏观现象得出相应的结论。比如,该试题中,从+3价氮的氧化性和还原性两个角度进行实验的设计,选取氯酸钾、高锰酸钾、氯化亚铁、亚硫酸钠进行实验验证,结合实验现象和结论,一明一暗两条线完成四个选项的设置。
同时,教师可以与学生一起,以亚硝酸钠为探究点,进行陌生物质性质的探究。
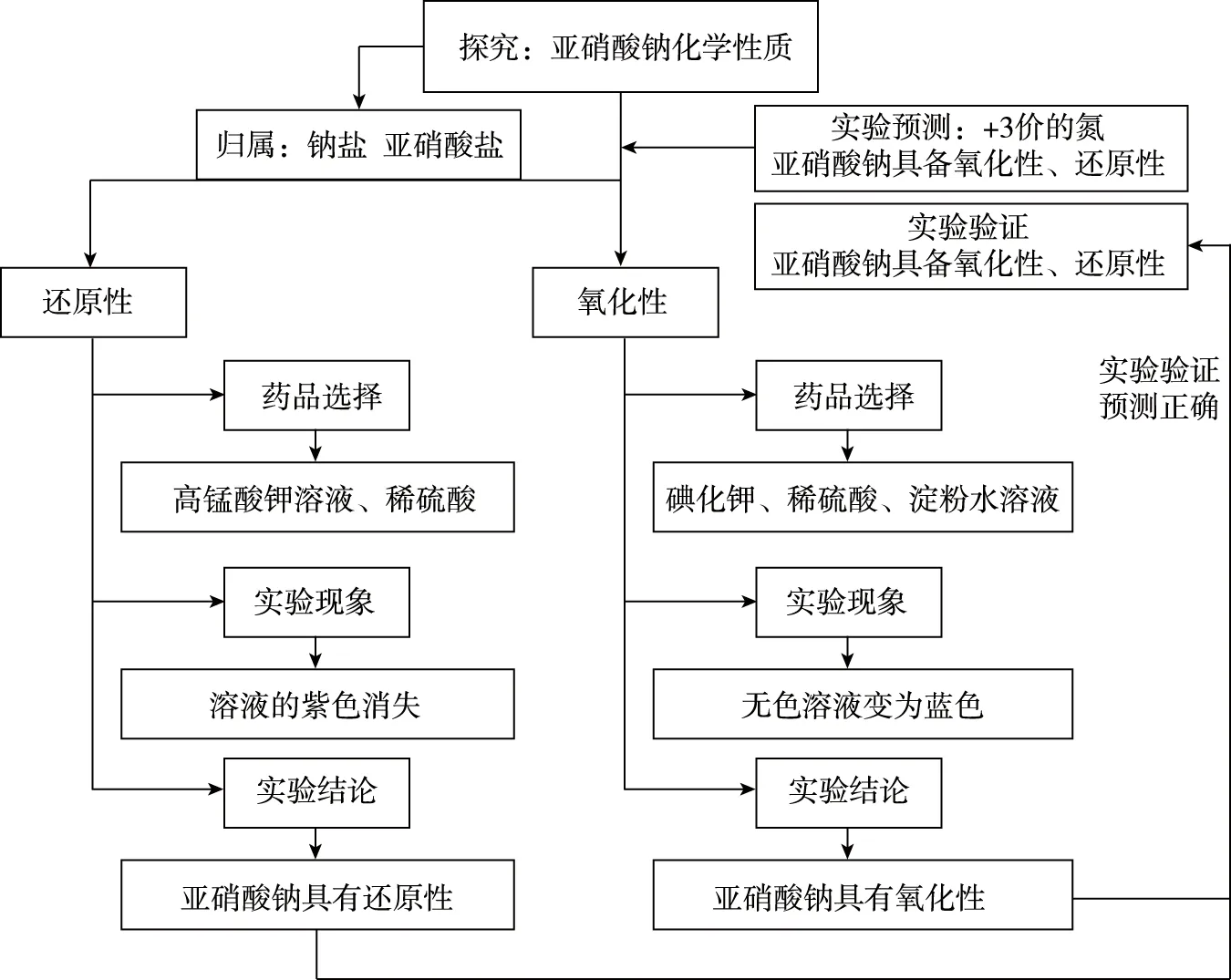
图4 探究亚硝酸钠的性质
通过实验探究物质的性质和变化,并在此基础上构建解决问题的模型,能给学生搭建一架无形的台阶,帮助学生在已有知识的平台上,具备自主探究物质性质的能力,能提升解决实际问题的能力并向未知物质展开学习,将素养3证据推理与模型认知、素养4科学探究与创新意识结合,实现学科核心素养的渐次提升。
3.学业水平第三层级,对实验提出的要求是:能依据解决问题的需要提出实验探究课题;能设计实验方案探究物质和能量的转化、影响反应速率和化学平衡的因素、有机化合物的主要性质等;能选择常见的实验试剂和仪器装置,控制实验条件,安全、顺利地完成实验;能收集并用数据、图表等多种方式描述实验证据,能基于现象和数据进行分析推理得出合理结论。侧重素养3证据推理与模型认知。
长久以来,由于GB、GJB和HB编制规划渠道的差异,导致一些标准被复制,甚至互不兼容。一些HB晋升为GJB后(HB和GJB之间没有完全替换的关系),显露出标准重叠、交叉、复杂混乱的问题。以铝合金为例,其锻件既有HB又有GJB,而铝合金薄板标准转换为GJB之后,材料尺寸规定的范围太窄,航空材料的截面尺寸规定不完整,导致该标准不能被航空厂采用。
【例3】(2022年全国甲卷,13题)根据实验目的,下列实验及现象、结论都正确的是
( )
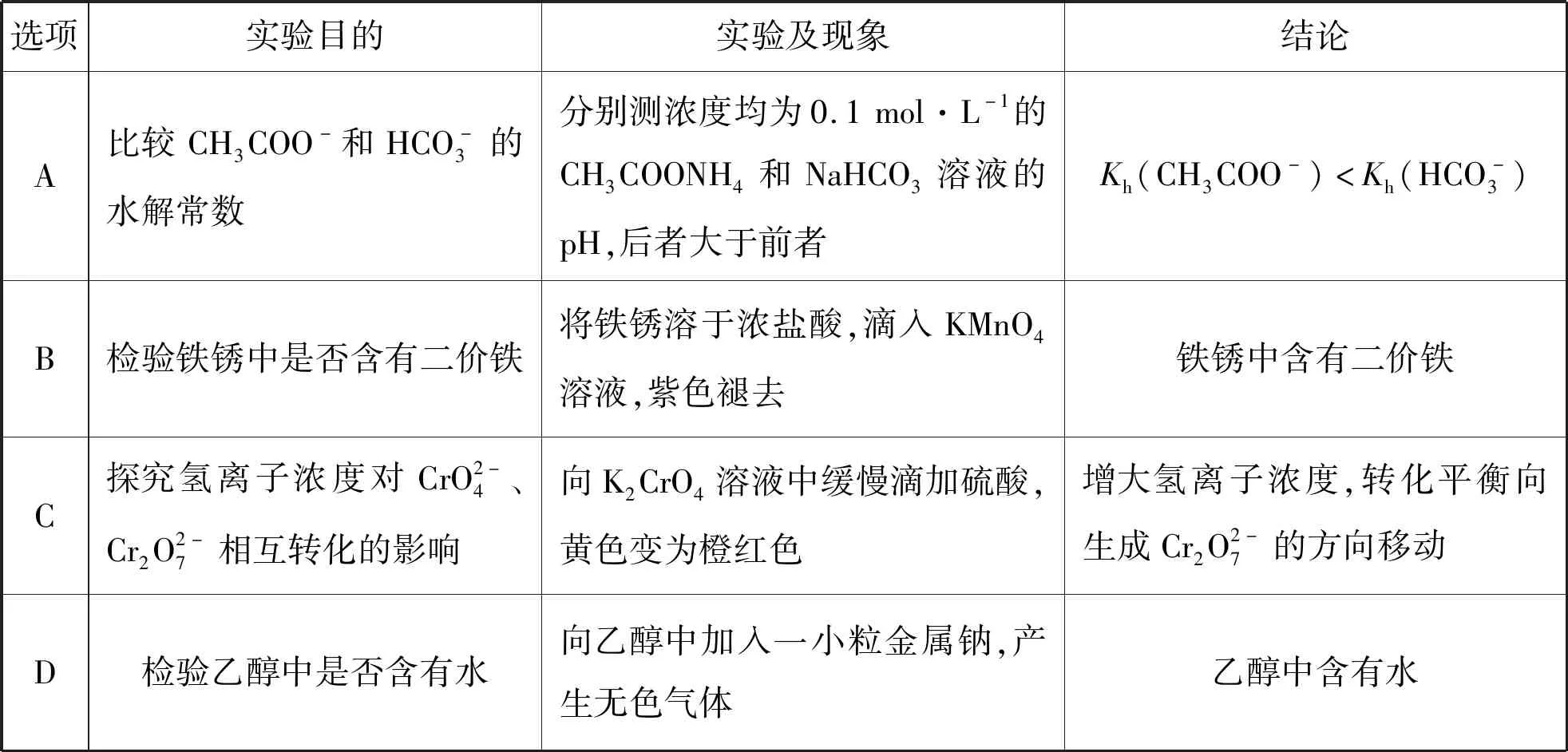
选项实验目的实验及现象结论A比较CH3COO-和HCO-3的水解常数分别测浓度均为0.1mol·L-1的CH3COONH4和NaHCO3溶液的pH,后者大于前者Kh(CH3COO-) 【答案】C 2022年全国甲卷13题将化学反应原理融入表格实验题,其中A项考查水解平衡常数、C项考查溶液中的平衡移动。在《普通高中化学课程标准(2017年版2020年修订)》中,对“水溶液中的离子反应与平衡”主题中,对水解平衡的教学要求是“认识盐类水解的原理和影响盐类水解的主要因素”;对溶液中的平衡教学要求是“了解水溶液中的离子反应与平衡”;并且在学业要求中提出,能正确测定溶液的pH,能选择实例说明溶液pH的调控在工农业生产和学科研究中的重要作用。 溶液中的平衡,最难的是将溶液中微观粒子的行为与宏观现象进行关联,用宏观现象解释溶液中微观粒子的反应和变化。依托本题的考查形式,复习中,教师可以与学生一起,采用定性+定量结合的方式,进行实验的复习。定性实验,可采用明确目标的情境创设实验,也可采用试题情境转化的演示实验,在实际操作中观察现象。定量实验,借鉴人教版(2019)选择性必修一70页图3-13“不同盐溶液的pH”,可以在定性实验中加入定量的数据测定,同时进行原理的分析,二者结合的复习效果应优于重复性的纯理论知识复习。 图3 一明一暗分析物质的组成及性质 比如:浓度对反应速率的影响。可由浅入深。 第一:控制变量法,设计3个对比实验,观察宏观现象,同时测定反应前溶液pH,实现宏观现象与微观粒子浓度的关联。 选择0.1 mol/L和0.01 mol/L的两种浓度的盐酸与铁钉反应,比较气泡产生的速率;选择0.1mol/L的盐酸、0.1 mol/L的醋酸与铁钉反应,比较气泡产生的速率;选择0.1 mol/L的醋酸、0.1 mol/L的氯化铵溶液与铁钉反应,比较气泡产生的速率; 第二,定性计算和思考:0.1 mol/L的醋酸溶液c(H+)、电离度α与Ka关联的计算 Ka(CH3COOH)=1.75×10-5 =1.32×10-3mol/L 第三,定性计算和深入思考:0.1 mol/L的氯化铵溶液水解出的c(H+)是多少;若需要提供与0.1 mol/L的醋酸一样浓度的H+,理论上需要氯化铵溶液的浓度;盐类水解中离子浓度与Kh、Ka、Kb的关联计算。 Kb(NH3·H2O)=1.8×10-5 =7.46×10-6mol/L 若需提供与0.1 mol/LCH3COOH溶液中一样浓度的H+ 需要氯化铵溶液的浓度即 比如:沉淀的生成和转化,依照人教版(2019)选择性必修一80页实验3-4进行演示实验,同时设计情境完成宏观现象与定量计算的结合,实现化学反应原理在解释实验现象中的具体应用。 第一:依照选择性必修一80页实验3-4进行演示实验。 向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液,可以看到有白色沉淀生成。振荡试管,向其中滴加4滴0.1 mol/L的 KI溶液,可以看到出现黄色沉淀;振荡试管,再向其中滴加8滴0.1 mol/LNa2S溶液,可以看到出现颜色更深的黑色沉淀。 可以得出结论:溶解度大的沉淀转化为溶解度更小的沉淀容易实现。 第二:定性计算和深入思考,同一类型的难溶电解质要实现沉淀的完全转化,二者的溶度积Ksp需要满足如何的关系? AgX+Y-⟺AgY+X- 参照人教版(2019)选择性必修一122页溶度积常数表格可以计算出 对比两个转化的平衡常数,可以判断氯化银转化为碘化银的反应很彻底。由此可知人教版(2019)课本中选用该实验是较为严谨的。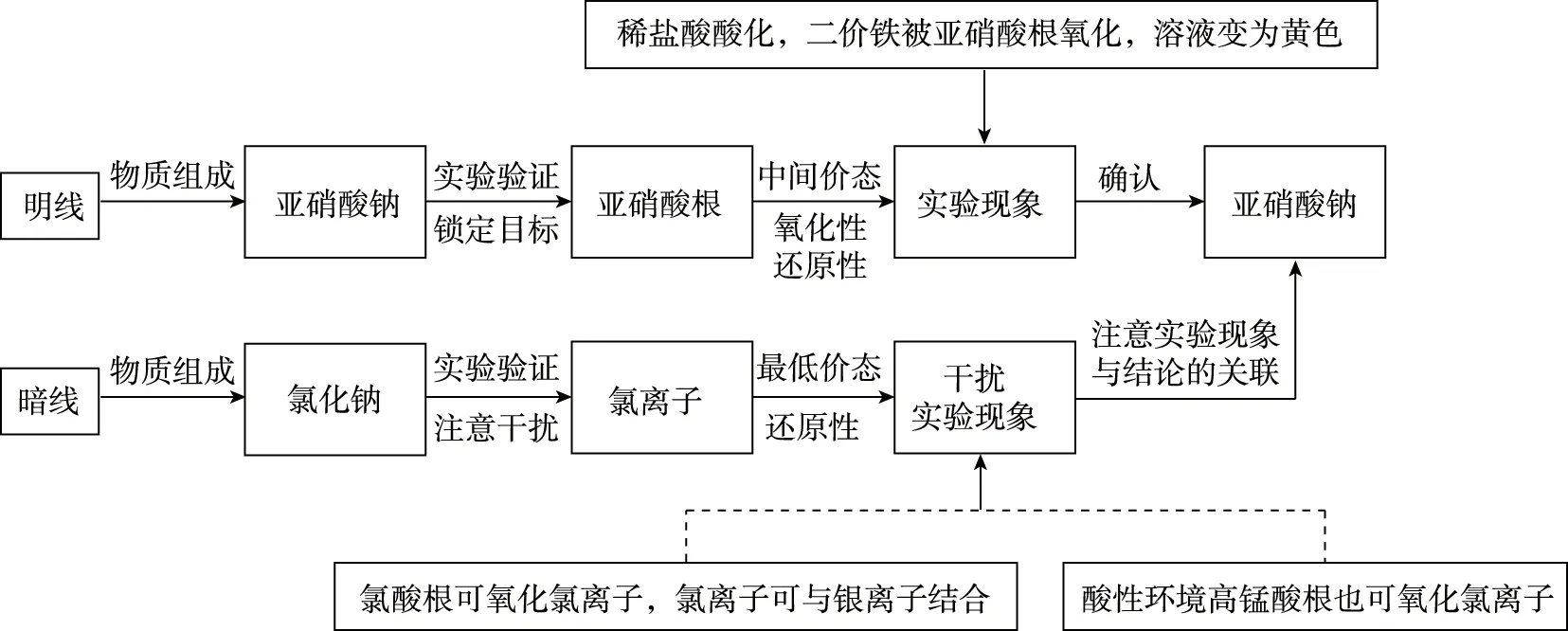


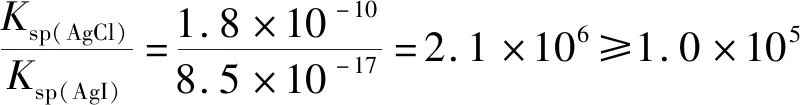
二、结语

