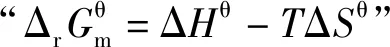基于学科本原,探究“化学反应的方向”的两种不同解读
2023-04-17董拥军
董拥军
(南京师范大学附属扬子中学)

《普通高中化学课程标准》(2017年版2020年修订)要求:知道化学反应是有方向的,知道化学反应的方向与反应焓变和熵变有关;了解浓度商和化学平衡常数的相对大小与反应方向间的联系。教师应该引导学生经历化学平衡常数模型建构的过程,结合具体实例,促使学生体会化学平衡常数在判断反应状态、反应方向与分析预测平衡移动方向等方面的功能价值。
1.基于“化学反应范特霍夫等温方程式的解读
根据化学反应范特霍夫等温方程式
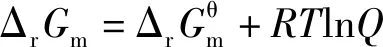
反应商Q为各物质的浓度商或气体的分压商
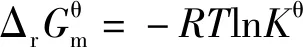
Kθ是标准平衡常数。
将②代入①式得
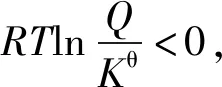
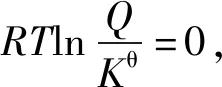
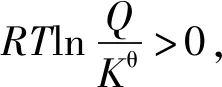
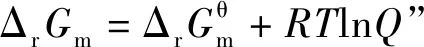
2.基于“标准Gibbs自由能变的解读
2.1 基于“标准Gibbs自由能变等温方程的解读
由于焓变(ΔHθ)和熵变(ΔSθ)受温度影响很小,在温度相差不是特别大时,均采用标准态298.15 K的数据。
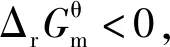
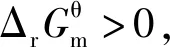
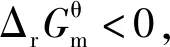
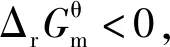
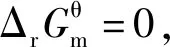

2.2 基于“标准Gibbs自由能变的解读
根据化学反应范特霍夫等温方程式
当体系处于平衡状态时ΔrGm=0,因此
当体系处于平衡状态时,反应商Q为各物质的浓度商或气体的分压商,均为平衡浓度商或平衡分压商,即Q=Kθ,因此推理得出:
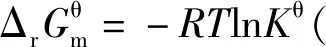
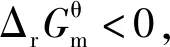
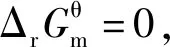
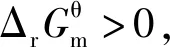
2.3 基于“标准Gibbs自由能变等温方程和“标准Gibbs自由能变-RTlnKθ”的整合
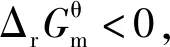
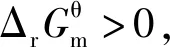
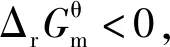
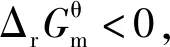
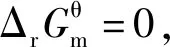
3.基于“标准Gibbs自由能变解读的几个说明
3.1 热力学理论所预言的自发方向仅代表化学反应的一种可能性
我们使用的焓判据和熵判据,实际上经常依据的是反应的标准焓变(ΔHθ)和标准熵变(ΔSθ)(不同于焓变ΔH和熵变ΔS)。这时我们所讨论的“化学反应的方向”,应该是指各种物质均处于标准态时化学反应的方向。
钛被誉为“21世纪金属”,第1次制得纯净的金属钛是在1910年。其实人们早在1791年就已经在金红石(TiO2)中发现了钛元素。科学家和工程师们最初设计以下方案来制备金属钛:

③

④
然而,科学家们发现TiO2(s)和Cl2(g)难以直接反应,逆向反应在一定温度下却很容易进行。于是,科学家们意识到化学反应的发生是具有方向性的。
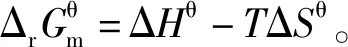
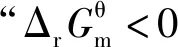
在元素化合物知识的学习过程中,经常会有学生对某些反应产生疑惑,如:C与SiO2反应为什么生成的是Si和CO而不是CO2?基于热力学的分析就可以很好地说明这个问题。

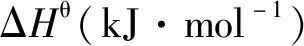
687.27 359.04 687.27-0.359 04T1 914.2

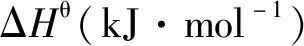
514.85 183.35 514.85-0.183 35T2 808.0
工业制硅的实际温度在1 800~2 000℃,超过了反应⑤最低转化温度,未达反应⑥最低转化温度,所以反应生成的是Si和CO。
当然还可以从反应⑦进行热力学分析,由方程式2×⑥-⑤得:

研究“化学反应的方向”的意义在于,先对某个化学反应的方向和限度做个预判,即在指定的条件下某个反应能否发生、限度是多少,这样我们在设计化学反应的路线时,能够事先在理论上做出判断,指明研究方向,从而避免不必要的浪费。





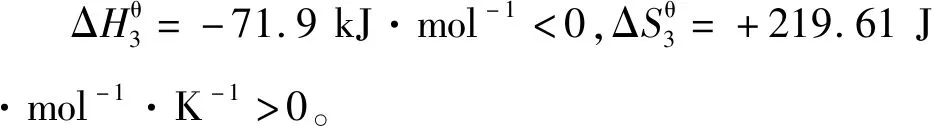
说明本反应在任何条件下都可以自发进行,焓减和熵增成了本反应发生的双重动力。实际工业生产中通常将温度控制在800~900℃,让TiO2与碳和氯气反应即可制得四氯化钛。
3.2 基于“标准Gibbs自由能变解读“化学反应的方向”研究的对象是化学反应的热力学倾向性,而不是“平衡移动的方向”
一切自发变化都是单向的,单向性即不可逆性。而多数化学反应都是可逆的,同时存在着正反应方向和逆反应方向,但这与“化学反应的方向”并不矛盾。“化学反应的方向”指的是“Gibbs自由能减小的方向”,即使是可逆反应,化学反应向着Gibbs自由能减小的方向进行是不可逆的。从微观的某一瞬间来考查一个可逆反应,确实同时存在着正反应速率和逆反应速率,但正反应的趋势与逆反应的趋势哪个更强,宏观上“化学反应的方向”就是向着那个强的方向。对于一个可逆反应而言,若正反应Kθ>1,则逆反应的Kθ<1,而“化学反应的方向”就是向着Kθ>1的方向进行,即这个“化学反应的方向”为正反应方向。同理,若正反应Kθ<1,则逆反应的Kθ>1,这个“化学反应的方向”为逆反应方向。

有文献认为:由于Qp 有文献认为:再充入PCl5(g),c(PCl5)增大,此时v正>v逆,反应向正反应方向进行,平衡向正反应方向移动。 有文献认为:化学平衡移动中化学反应进行方向的说法不科学。 有文献认为:用反应商判断,平衡向正反应方向移动。 问题主要集中在两方面:①再充入PCl5(g),c(PCl5)增大,此时v正>v逆,反应向正反应方向进行,平衡向正反应方向移动;②再充入PCl5(g),同时容器的压强增大,使得PCl5(g)的转化率降低,平衡向逆反应方向移动。 ΔHθ 由化学反应范特霍夫等温方程式 当ΔrGm=0时,化学反应处于平衡状态,Q=Kθ -RTlnKθ+RTlnQ=0 Kθ=1,表明的是正反应的趋势与逆反应的趋势相当。1864~1879年,挪威数学家古德贝格和化学家瓦格细致分析了前人的工作,又做了大约300个实验,经过深入的分析推理,两位科学家合作确立了“质量作用定律”。他们提出:对于一个化学过程,总有2个方向相反的力同时起作用,一个推动新物质的生成,另一个帮助新物质再生成原物质。在标准状态下,这2个方向相反的力分别为正反应方向的热力学倾向性和逆反应方向的热力学倾向性。

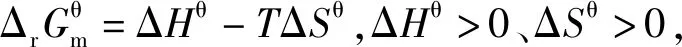
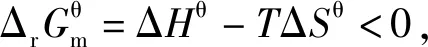

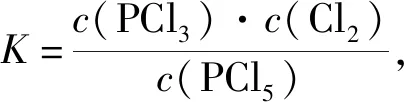
3.3 基于“标准Gibbs自由能变解读“化学反应的方向”的前提条件是“ΔrGm=0”
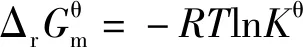
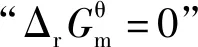
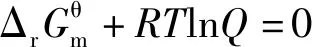
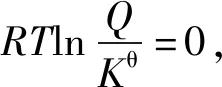
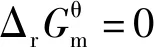
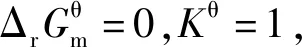
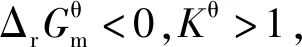
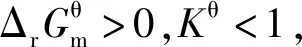
3.4 基于“标准Gibbs自由能变解读“化学反应的方向”使用的条件是“标准状态”