肉桂醛对PC-3细胞增殖、EMT及干细胞特性的影响
2023-04-13吴俊檄唐欲博令狐熙涛包广龙施浩然文振宇黄帅瓦庆德
吴俊檄 唐欲博 令狐熙涛 包广龙 施浩然 文振宇 黄帅 瓦庆德
1遵义医科大学第二附属医院骨外科(贵州遵义563000);2中山大学附属第一医院药学部(广州510260);3广州医科大学附属第二医院骨外科(广州510260)
前列腺癌(prostate cancer,PCa)骨转移发生率高,且呈逐年上升趋势,对于PCa 骨转移患者,其生存质量差且总体生存率欠佳[1-2]。随着PCa 骨转移机制探索的不断深入,许多骨靶向药物及新型治疗药物被陆续应用于临床,尽管其治疗取得了部分进展,但其效果仍有待进一步提高[3-4]。因此,探索抑制PCa 骨转移的新型治疗药物具有重要的意义。目前研究发现肉桂醛(CA)是一种存在于肉桂和月桂叶中的天然化合物,具有较好的抗瘤活性,其可通过调控微小RNAs(microRNAs,miRNAs)及相关信号通路影响肿瘤的发生发展[5-9]。近来研究发现,CA 对PCa 细胞具有明显的细胞毒性,其可通过自噬依赖性细胞凋亡的方式诱导PCa 细胞死亡[6]。然而,CA 能否通过调控miRNA 的表达影响PCa 骨转移目前尚未明确。既往研究发现,miR-143 是PCa 骨转移的重要调控因子,在PCa 骨转移性肿瘤中的miR-143 表达水平明显低于原发性肿瘤,miR-143 可通过调控PCa 骨转移瘤细胞(PC-3细胞)的EMT及干细胞特性抑制PCa 骨转移[10-11]。因此本研究以PC-3细胞为研究对象,拟进一步探索CA 能否通过调控miR-143 表达影响PC-3细胞的增殖、EMT及干细胞特性,为CA 作为潜在的抗PCa 骨转移药物提供前期实验参考。
1 材料与方法
1.1 材料PC-3细胞(人前列腺癌骨转移瘤来源细胞株)(ATCC 公司),纯度≥95%的肉桂醛溶液(美国Sigma 公司),AGO2、ZEB1、N-cadherin、fibronectin、vimentin、CD44、Oct-4、c-Myc 及α-tubuin 抗体(美国Cell Signaling Technology 公司),CCK-8试剂盒(北京全式金生物技术有限公司),逆转录试剂盒、RNA 抽提试剂盒以及荧光定量PCR 试剂盒(日本Takara 公司),超敏ECL 化学发光试剂盒及BCA 蛋白浓度测定试剂盒(碧云天生物科技公司)。
1.2 方法
1.2.1 细胞形态观察调整PC-3细胞悬液的密度为1 × 104个/孔,接种至24 孔板中,然后分别加0、5、10、20 μmol/L 的CA 溶液共培养24 h,镜下观察PC-3细胞的形态变化。
1.2.2 CCK-8 试验调整PC-3细胞悬液浓度后接种至96 孔培养板中(密度为4 × 103个/孔),细胞贴壁后加入0、5、10、15、30、60 μmol/L 的CA 溶液,每组设5 个复孔,培养24 h 后在每个孔中加入CCK-8试剂液10 μL,孵育2 h 后检测各孔的吸光度值。
1.2.3 Transwell 试验将密度为1 × 106个/mL 的PC-3细胞悬液100 μL 接种于Transwell 上室,0、5、10、20 μmol/L 的CA 溶液加入下室然后继续培养24 h。取出Transwell 小室,固定、洗涤,小心去除上室面的PC-3细胞,然后染色,晾干,倒置显微镜下观察细胞特点,拍照并计算数量,算出平均值。在检测细胞的迁移能力时,不需要在上室中添加Matrigel 基质胶,而在检测细胞侵袭能力时,需要将Matrigel 基质胶稀释液(1∶5)包被在Transwell上室中,其余条件同迁移试验。
1.2.4 黏附试验取部分PC-3细胞悬液(1×106个/孔)接种到6孔板中,然后加入0、5、10、20 μmol/L 的CA 溶液处理24 h,重悬每组细胞至1 × 104个/孔后接种在FN 包被的96 孔板中,培养2 h 后,封闭,洗涤,固定,染色,然后在显微镜下观察,拍照计数。
1.2.5 成球试验0、5、10、20 μmol/L 的CA 与PC-3细胞共同孵育24 h。0.25%胰酶消化PC-3细胞后用无血清RPMI1640 培养基制作细胞悬液至1 ×106个/mL,接种于24 孔培养板中继续培养14 d,计数球体数量,观察拍照。
1.2.6 qRT-PCR 分析0、5、10、20 μmol/L 的CA溶液分别与PC-3细胞共同培养24 h,低温环境下抽提总RNA,然后将总RNA 样本立即逆转录成cDNA。使用实时PCR 试剂盒进行PCR 扩增共40个循环。采用2-ΔΔCT法计算miR-143、AGO2 mRNA的相对表达水平。相关引物序列详见表1。
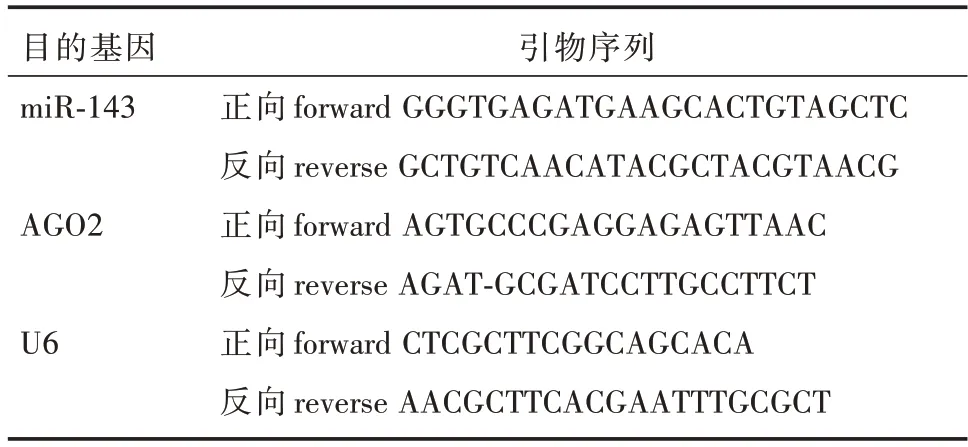
表1 qRT-PCR 引物序列Tab.1 Sequence of primers used for qRT-PCR
1.2.7 细胞转染0.25%胰酶消化PC-3细胞后制成细胞悬液,接种至6 孔平板中(1 × 106个/孔),在37 ℃、5% CO2培养箱中培养细胞密度至40%,使用Lipofectamine 3000 转染试剂将miR-143mimic、AGO2-siRNA 或AGO2 mRNA 转染入PC-3细胞。
1.2.8 Western blot 分析分别用10 μmol/L 的CA溶液、miR-143mimic、Vetor 转染PC-3细胞,接种四组PC-3细胞24 h 后,混合裂解液提取总蛋白并进行BCA 标准法定量。在10%~12%的SDS-PAGE凝胶中进行电泳,电转,2 h 后封闭,1 h 后加入一抗稀释液AGO2、ZEB1、N-cadherin、fibronectin、vimentin、CD44、Oct-4、c-Myc 和α-tubuin,避光低温孵育。然后加入二抗低速震荡1 h,洗涤3 次,选用ECL 发光检测,曝光成像。
1.3 统计学方法用SPSS 18.0 及GraphPad Prism进行统计分析和作图,用均数±标准差表示资料的数据。通过t检验、单因素方差分析方法对数据进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 CA 对PC-3细胞增殖、迁移、侵袭、黏附及成球的影响CCK-8 实验结果显示,CA 呈浓度依赖性抑制PC-3细胞的增殖(P<0.01,图1B),其IC50值约为19 μmol/L,选用0、5、10、20 μmol/L 浓度梯度的CA 溶液用于后续实验。镜下观察发现随着CA 浓度不断增加PC-3细胞的形态从规则梭形逐渐变成圆形并出现细胞碎片(图1C)。Transwell 实验结果显示CA 可抑制PC-3细胞的体外迁移及侵袭能力,与对照组相比差异有统计学意义(P<0.01,图1D-E)。黏附实验结果显示CA 可降低PC-3细胞的黏附能力(P<0.01,图1F)。成球实验发现,加入CA 后PC-3细胞的成球能力显著低于对照组(P<0.01,图1G)。
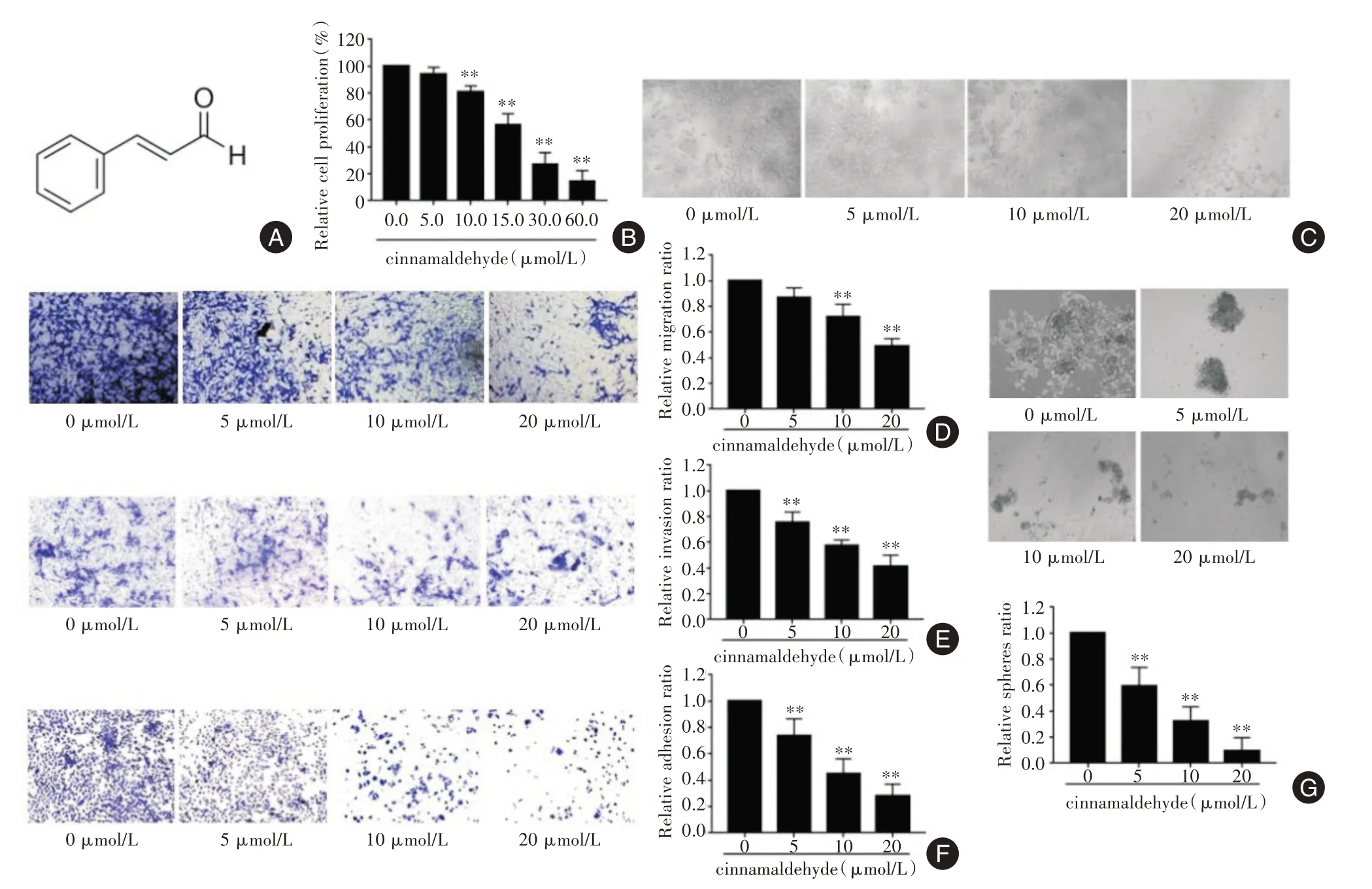
图1 CA 抑制PC-3细胞的增殖、迁移、侵袭、黏附及成球能力(× 100)Fig.1 CA inhibited proliferation,migration,invasion,adhesion and spheres formation of PC-3 cell in vitro(× 100)
2.2 过表达AGO2 可逆转CA 及miR-143 对PC-3细胞侵袭、迁移和黏附的影响
2.2.1 CA对PC-3细胞中miR-143及AGO2 mRNA表达的影响qRT-PCR 实验结果显示,与对照组相比,CA可显著上调miR-143的表达(P<0.01,图2A);同时,CA 可呈浓度依赖性下调PC-3细胞中AGO2 mRNA 的表达,与对照组相比差异有统计学意义(P<0.01,图2B)。
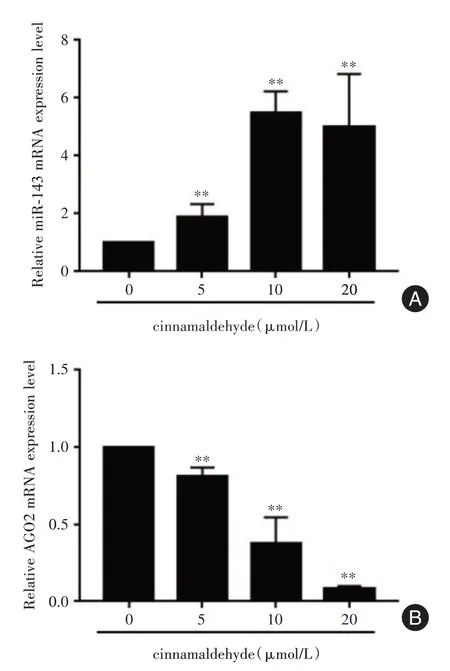
图2 CA 上调PC-3细胞中miR-143 表达,抑制AGO2 mRNA 的表达Fig.2 CA upregulate the expression of miR-143 and downregulate the expression of AGO2 mRNA in PC-3 cells
2.2.2 CA、AGO2 及miR-143 对PC-3细胞迁移、侵袭和黏附的影响Transwell 及基质黏附实验结果提示,与对照组比,CA、过表达miR-143 及沉默AGO2 均能抑制PC-3细胞的迁移、侵袭及黏附(P<0.01),而同时加入CA 及上调AGO2、同时上调miR-143 及AGO2 后PC-3细胞迁移、侵袭及黏附的抑制作用较对照组差异无统计学意义(P>0.05),见图3。
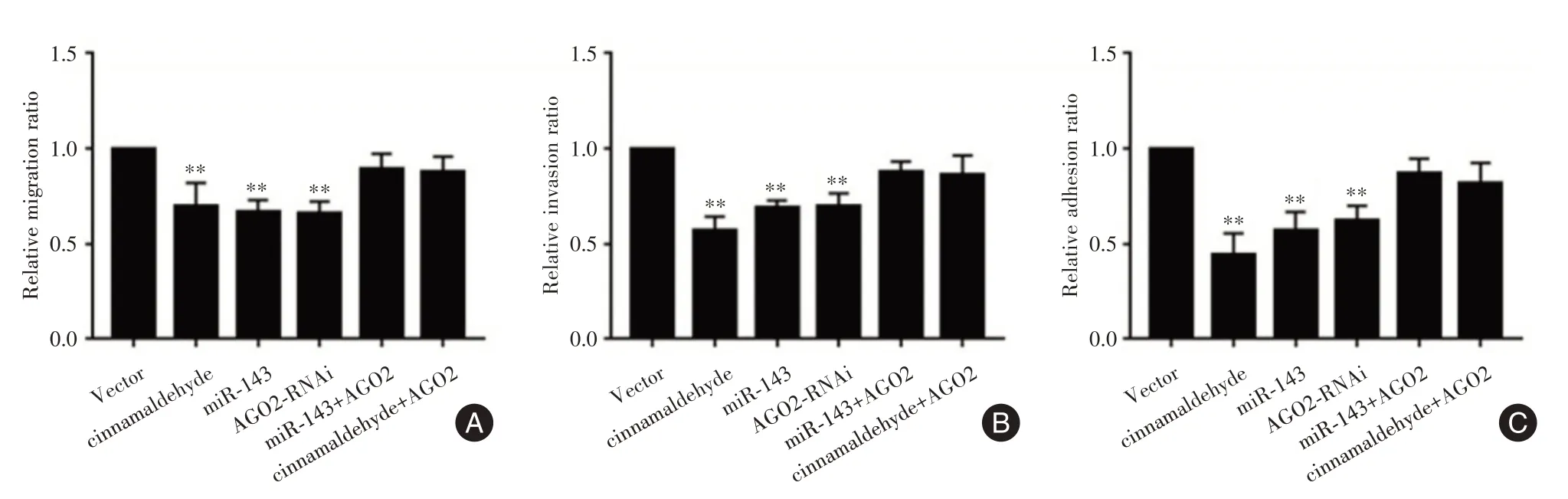
图3 AGO2 可逆转CA 或过表达miR-143 对PC-3细胞侵袭、迁移和黏附的抑制作用Fig.3 AGO2 rescued the effects of overexpressed miR-143 or CA on migration,invasion and adhesion of PC-3 cells in vitro
2.3 CA 及miR-143 对PC-3细胞EMT及干细胞特性的影响Western blot 实验发现加入CA 或上调miR-143 后PC-3细胞中AGO2 及EMT 相关蛋白波形蛋白、N-钙黏蛋白、纤连蛋白及ZEB1 的表达明显下降(P<0.05,图4A);此外,CA 或上调miR-143后PC-3细胞的干细胞特性相关蛋白CD44、Oct-4及c-Myc 蛋白的表达均明显下降,与对照组比差异均有统计学意义(P<0.05,图4B)。
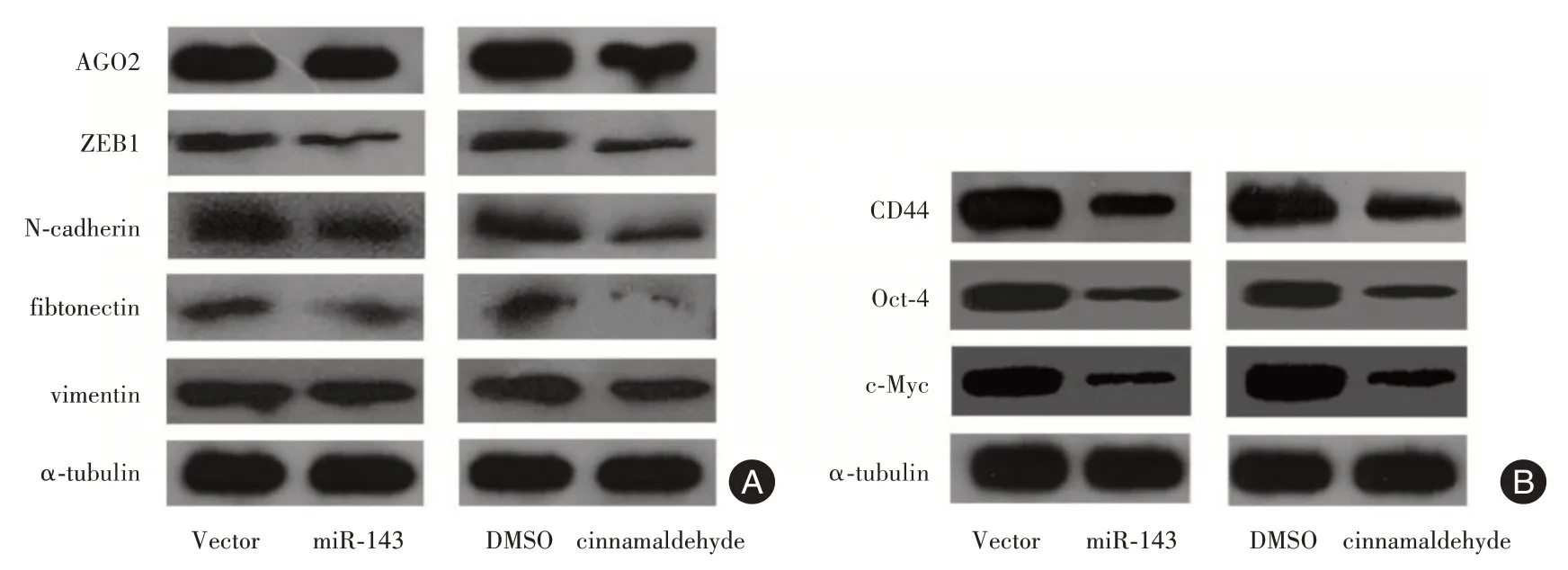
图4 CA 或过表达miR-143 抑制PC-3细胞中AGO2、EMT及干细胞特性相关蛋白表达Fig.4 CA or overexpression of miR-143 inhibits the expression of AGO2,EMT and stem cell property related proteins of PC-3 cells in vitro
3 讨论
PCa 骨转移的治疗方式包括非骨特异性抗癌药物治疗、分子靶向药物治疗及放射性药物治疗等,虽提高了部分患者总体生存率,但总体疗效仍欠佳[12-13]。随着CA 抗肿瘤作用的不断深入研究,MEI 等[14]提出CA 可通过调控TLR4 依赖的信号通路影响PCa 相关成纤维细胞的功能,进而抑制PCa的进展。此外,CA 还可通过抑制肿瘤相关成纤维细胞的线粒体功能或作为天然蛋白酶体抑制剂诱导PCa 细胞凋亡[7,15]。本研究发现,CA 可呈浓度依赖性抑制PC-3细胞的增殖,其24 h 的IC50值约为19 μmol/L。此外,Transwell、基质黏附及成球实验结果提示CA 可在体外抑制PC-3细胞的迁移、侵袭、黏附及成球能力。
PCa 的转移和进展是受多种机制调节的复杂过程。miRNAs 可通过转录后抑制的方式发挥抗肿瘤作用,Argonaute2(AGO2)蛋白作为RNA 诱导沉默复合体的核心成分,可与miRNAs 之间相互调控进而影响肿瘤的发生发展[16]。研究报道,CA 抑制肿瘤的恶性生物学行为与其可调控miRNA 的表达有关[8,17]。既往研究发现,miR-143 是PC-3细胞迁移侵袭的负向调控因子,且AGO2 可与miR-143结合[10,11,18]。本研究通过qRT-PCR 发现CA 可上调PC-3细胞中miR-143 的表达,并抑制AGO2 mRNA的表达;此外,过表达miR-143 后PC-3细胞中AGO2表达明显下调,提示miR-143 可调控AGO2 的表达。本研究进一步探讨CA 抗PC-3细胞活性的作用机制,结果发现CA、过表达miR-143 及沉默AGO2 均能抑制PC-3细胞的迁移、侵袭及黏附能力;功能回复实验提示,过表达AGO2 可逆转CA 及miR-143 对PC-3细胞迁移、侵袭及黏附的抑制作用。上述结果说明,CA可能通过上调miR-143/Ago2轴抑制PC-3细胞的迁移、侵袭及黏附。
肿瘤干细胞具有很强的迁移及侵袭能力,此外,当PCa 细胞由上皮表型向间质表型转化时,肿瘤的侵袭及转移能力也会明显增强[19]。因此,抑制干细胞特性及EMT 可成为抑制PCa 骨转移潜在治疗方式[20-21]。研究发现CA 可以通过逆转非小细胞肺癌的EMT 过程来抑制肿瘤细胞黏附及生长[22]。本研究发现,CA 可浓度依赖性抑制PC-3细胞的成球能力,并抑制PC-3细胞中EMT及干细胞特性相关蛋白的表达,说明CA 对PC-3细胞的EMT及干细胞特性具有抑制作用。此外,上调miR-143 后PC-3细胞中N-钙黏蛋白、波形蛋白、纤连蛋白、ZEB1 及CD44+、Oct-4、c-Myc 表达水平均明显降低。综合上述研究结果,本研究推测CA 可抑制PC-3细胞的EMT及干细胞特性,其机制可能与其能上调miR-143/AGO2 轴有关。
综上所述,本研究表明CA 可在体外抑制PC-3细胞的增殖、迁移、侵袭及黏附能力;CA 还可抑制PC-3细胞的EMT及干细胞特性,其机制可能与其能上调miR-143/AGO2 轴有关。本研究主要探索了CA 在体外对PC-3细胞恶性生物学行为的抑制作用,尚未探讨miR-143/AGO2 轴在CA 抑制PCa 骨转移生长与转移中的详细作用机制和体内抑瘤效果,因此在下一步研究中将会重点对其展开研究,以期为CA 作为抗PCa 骨转移的潜在治疗药物提供前期实验参考。
【Author contributions】Wu Junxi wrote the article.TANG Yubo,LINGHU Xitao and BAO Guanglong performed the experiments.SHI Haoran and WEN Zhenyu collected data.HUANG Shuai and WA Qingde designed the study.All authors read and aplproved the final manuscript as sub-mitted.
