人参皂苷Rg1联合阿霉素对K562/ADR细胞增殖及耐药的影响
2023-04-11唐紫云李敏瑞张成桂刘衡周玥
唐紫云,李敏瑞,张成桂,刘衡,周玥
(1.大理大学组织学与胚胎学教研室,云南 大理 671000;2.云南省昆虫生物医药研发重点实验室,云南 大理 671000;3.药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000)
慢性髓细胞白血病(chronic myeloid leukemia,CML)是起源于造血干细胞的恶性克隆性增殖的血液系统肿瘤,以骨髓和外周血中髓系细胞增殖、费城染色体(Ph)和BCR-ABL融合基因阳性为主要特征[1]。目前针对CML的治疗主要以化疗和骨髓移植为主,但是随着CML病程的进展其化疗耐药性也随之增加,化疗失败成为 CML 高病死率的关键因素[2]。研究显示,中药及其衍生物联合化疗药物可有效提高白血病耐药细胞对化疗药物的敏感性[3]。因此,寻找有效的耐药逆转剂,增强耐药细胞对化疗药物的敏感性具有重要的研究意义。人参是中国的传统名药材之一,早在几千年前就可以医治多种疾病,有“百草之王”之称。人参具有广泛的临床药用价值,其抗肿瘤的主要活性成分是人参皂苷。目前,人参皂苷Rg1的研究多集中于敏感细胞系,已有研究表明,人参皂苷Rg1可以抑制鼻咽癌细胞CNE-2增殖、侵袭和迁移能力,并诱导其凋亡[4]。人参皂苷Rg1可抑制K562细胞增殖并诱导其凋亡[5]。人参皂苷Rg1还具有抗感染、抗肿瘤和延缓脑衰老等作用[6-8]。本课题组前期实验发现,人参皂苷Rg1可以抑制K562细胞增殖,阻滞细胞周期于G0/G1期,并基于PI3K/AKT/mTOR信号通路诱导其衰老[9-10],但人参皂苷Rg1对耐阿霉素(adriamycin,ADR)细胞K562/ADR的影响尚未见报道。本实验选择人CML耐ADR细胞K562/ADR为实验对象,探究人参皂苷Rg1对K562/ADR细胞的增殖抑制及逆转作用,为白血病的临床治疗提供实验依据。
1 材料和仪器
1.1 实验材料与试剂
人慢性髓系白血病细胞株K562细胞购于齐氏生物科技有限公司;人慢性髓系白血病耐ADR细胞株K562/ADR细胞购于上海瑾原生物科技有限公司;人参皂苷Rg1(普瑞法科技开发有限公司,商品号10607,批号22427-39-0);阿霉素(瑾原生物科技有限公司,商品号6585,批号23214-92-8);RPMI1640培养基(美仑生物科技有限公司,商品号MA0215,批号MA0215-Oct-14G);胎牛血清(FBS,普诺赛生物,商品号164210-50,批号SA220126 );CCK-8试剂盒(碧云天生物科技公司,商品号 C0042,批号031521211214);PBS磷酸盐缓冲液(索莱宝,商品号P1010,批号20210201)。
1.2 实验仪器
低速台式离心机(安徽中科中佳科学仪器有限公司,型号SC-3610);立式压力蒸汽灭菌器(上海博迅医疗生物仪器公司,型号YXQ-50S1);生物安全柜(苏州安泰空气技术有限公司,型号BSC-1301ⅡA2);二氧化碳培养箱(赛默飞,型号371);倒置显微镜(Motic公司,型号AE31);多功能酶标仪(Bio-Rad公司,型号iMARK);电热恒温水浴箱(上海恒科生物有限公司,型号HWS24);流式细胞仪(Beckman公司,型号CytoFLEX)。
2 实验方法
2.1 K562和K562/ADR 细胞培养
K562及K562/ADR细胞均用配制好的含10% FBS和1%青链霉素的RPMI1640完全培养基常规培养,培养条件为37 ℃、5% CO2、湿度饱和的环境,1~2 d换液传代。K562/ADR细胞在培养过程中需加入ADR以维持其耐药性,ADR终浓度为1 μg/mL,实验开始前1周更换为不含药培养基培养。
2.2 CCK-8法检测人参皂苷Rg1对K562/ADR细胞增殖的影响
选取对数生长期的K562/ADR细胞,1 000 r/min 离心 5 min,台盼蓝染色,计数板计数。按细胞量1×104/孔接种于96孔板,每孔100 μL。实验分为实验组、细胞对照组和试剂对照组,实验组人参皂苷Rg1浓度梯度为80、100、120、140、160 、180 μg/mL;细胞对照组不加任何药物培养,仅含K562/ADR细胞;试剂对照组仅含培养基和药物,不含细胞。每组设3个复孔。于培养箱分别培养24 h和48 h后,每孔加入10 μL CCK-8液,继续于培养箱培养4 h。酶标仪检测 450 nm处各孔的吸光度值,计算细胞增殖抑制率。细胞增殖抑制率=1-[(As-Ab)/(Ac-Ab)]×100%。其中,As为实验孔吸光度 (含细胞、培养基、CCK-8溶液和药物溶液);Ac为细胞对照孔吸光度 (含细胞、培养基、CCK-8溶液,不含药物);Ab为试剂对照孔吸光度 (含培养基、CCK-8溶液、药物,不含细胞)。
2.3 CCK-8法检测人参皂苷Rg1对K562/ADR细胞的逆转作用
选取对数生长期的K562/ADR细胞,1 000 r/min 离心 5 min,台盼蓝染色,计数板计数。按细胞量1×104/孔接种于96孔板,每孔100 μL。实验分组:K562/ADR细胞对照组、ADR实验组和ADR+Rg1实验组,另设试剂对照组。K562/ADR细胞对照组为不加任何药物培养,仅有K562/ADR细胞;ADR实验组加入ADR终浓度梯度为2、4、8、16、32 μmol/L;ADR+Rg1实验组在ADR实验组基础上每孔加120 μg/mL的人参皂苷Rg1。每组设3个复孔,放于培养箱培养48 h。每孔加入10 μL CCK-8液,继续放于培养箱培养4 h。酶标仪检测 450 nm 处各孔的吸光度值,利用GraphPad Prism 8.0软件求出IC50值,计算逆转倍数。逆转倍数 =ADR实验组IC50值/ADR+Rg1实验组IC50值。
2.4 细胞集落形成实验
分别收集K562细胞、K562/ADR细胞、1 μmol/L ADR作用48 h的K562/ADR细胞、120 μg/mL人参皂苷Rg1作用48 h的K562/ADR细胞、1 μmol/L ADR联合120 μg/mL人参皂苷Rg1作用48 h的K562/ADR细胞,1 000 r/min 离心5 min,台盼蓝染色,计数板计数。按细胞量500个/孔接种于12孔板,每孔500 μL,放于37 ℃、5% CO2、湿度饱和的培养箱中培养7 d后计算集落形成率。细胞集落形成率(%)=平均细胞集落数/每孔中加入的细胞数×100%,以大于50个细胞的聚合为1个细胞集落。实验重复3次。
2.5 流式细胞术检测细胞周期
分别收集K562细胞、K562/ADR细胞、1 μmol/L ADR作用48 h的K562/ADR细胞、120 μg/mL人参皂苷Rg1作用48 h的K562/ADR细胞、1 μmol/L ADR联合120 μg/mL人参皂苷Rg1作用48 h的K562/ADR细胞,1 000 r/min 离心5 min,沉淀70%乙醇固定后的细胞,预冷的PBS洗涤,碘化丙啶染色,重悬细胞沉淀,37 ℃避光温浴30 min,用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。
2.6 统计学分析
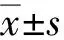
3 实验结果
3.1 K562和K562/ADR细胞形态比较
K562和K562/ADR细胞于37 ℃、5% CO2、湿度饱和的培养箱中培养48 h,倒置显微镜下观察细胞形态,K562和K562/ADR细胞均为淋巴母细胞样,圆形,聚团悬浮生长,形态相似,无明显差异(图1)。

A K562;B K562/ADR图1 K562细胞和K562/ADR细胞形态比较(100×)
3.2 人参皂苷Rg1对K562/ADR细胞增殖的影响
不同浓度的人参皂苷Rg1分别作用于K562/ADR细胞24 h和48 h后,与对照组相比,细胞增殖抑制率明显升高(P<0.001);人参皂苷Rg1浓度为120 μg/mL,作用时间为48 h时,细胞抑制率最高,为(20.04 ± 0.01)%(P<0.05),后续实验人参皂苷Rg1采用该浓度和作用时间,见表1。

表1 人参皂苷Rg1对K562/ADR细胞增殖的影响
3.3 人参皂苷Rg1对K562/ADR细胞的逆转作用
ADR对K562/ADR细胞的IC50为1.38 μmol/L,与120 μg/mL的人参皂苷Rg1联合作用后IC50为0.59 μmol/L,逆转倍数为2.34(P<0.05),表明人参皂苷Rg1能部分逆转K562/ADR细胞对ADR的耐药性(图2)。
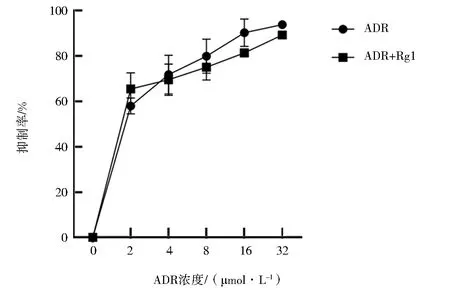
图2 人参皂苷Rg1联合不同浓度ADR对K562/ADR细胞增殖的影响
3.4 人参皂苷Rg1联合ADR对K562/ADR细胞集落形成能力的影响
与K562细胞相比,K562/ADR细胞集落形成率差异无统计学意义;与K562/ADR组和人参皂苷Rg1或ADR单药处理组相比,人参皂苷Rg1与ADR联合作用时,细胞集落形成率最低(P<0.05),见表2、图3。

表2 人参皂苷Rg1联合ADR对K562/ADR细胞集落形成能力的影响

A K562组;B K562/ADR组;C ADR组;D 人参皂苷Rg1组;E ADR+Rg1组图3 集落图像(100×)
3.5 人参皂苷Rg1联合ADR对K562/ADR细胞周期的影响
与K562组相比,K562/ADR组各细胞周期差异无统计学意义;与K562/ADR组相比,ADR和人参皂苷Rg1单用或联用时,阻滞在G0/G1期的细胞比例均升高(P<0.05),G2/M期的细胞比例均降低(P<0.05),ADR组S期细胞比例升高(P<0.05),其余组S期细胞比例无明显变化;与单用ADR或单用人参皂苷Rg1组相比,ADR联合人参皂苷Rg1作用后阻滞在G0/G1期的细胞比例明显升高(P<0.05),S期细胞比例降低(P<0.05),见表3、图4。

表3 人参皂苷Rg1联合ADR对K562/ADR细胞周期的影响
4 讨论
白血病是血液系统恶性肿瘤之一,骨髓中以异形的幼稚白血病细胞大量增殖为主,该细胞可浸润多器官和多组织,抑制正常造血功能,出现贫血、出血、感染、脾大等症状[11]。目前治疗白血病的方法有联合化学治疗、诱导分化治疗、造血干细胞移植治疗、免疫治疗等,而主要方法是化学治疗[12]。随着化疗方案的不断改进,白血病患者的生存率已明显提高,但仍有一部分患者因病情复发而死亡,而造成化疗失败的主要原因是肿瘤细胞对化疗药物产生了耐药性[13]。随着中药得到广泛认可,低毒高效的中药单体和提取物作为肿瘤多药耐药的逆转剂逐渐引起研究者的关注。

A K562组;B K562/ADR组;C ADR组;D 人参皂苷Rg1组;E ADR+Rg1组;第一个高峰为G0/G1期;第二个高峰为G2/M期;平台期为S期图4 人参皂苷Rg1联合ADR对K562/ADR细胞周期的影响
本研究选择耐ADR的人慢性髓细胞白血病细胞K562/ADR为实验对象,通过CCK-8法检测人参皂苷Rg1对其增殖抑制作用。结果表明,当人参皂苷Rg1浓度为120 μg/mL,作用时间为48 h时,人参皂苷Rg1对K562/ADR细胞的抑制率最高,为(20.04 ± 0.01)%。将此浓度的人参皂苷Rg1与不同浓度的ADR联合作用于K562/ADR细胞48 h后,K562/ADR细胞的IC50值明显降低,并可得出人参皂苷Rg1对K562/ADR细胞的逆转倍数为2.34,说明与ADR单独作用相比,人参皂苷Rg1联合ADR能明显抑制K562/ADR细胞增殖,并提高K562/ADR细胞对ADR的敏感性。
细胞集落形成实验是检测细胞增殖能力的方法之一,可以通过计算细胞集落形成率来判断细胞的增殖能力。细胞集落形成实验显示,人参皂苷Rg1联合ADR作用K562/ADR细胞48 h后,细胞集落形成率明显降低。细胞周期是一个高度有组织和有条理的过程,以确保遗传物质在细胞分裂过程中的完整性,诱导细胞周期阻滞可有效抑制多种肿瘤的发生发展[14-15]。大量研究表明,细胞周期异常与肿瘤发生和肿瘤患者的不良预后有关,通过阻滞细胞周期从而抑制癌细胞增殖逐渐成为抗肿瘤药物开发的新方向[16]。本研究中流式细胞术检测结果提示,人参皂苷Rg1联合ADR作用K562/ADR 48 h后,细胞周期明显阻滞于G0/G1期,进一步说明人参皂苷Rg1联合ADR能明显抑制K562/ADR细胞增殖。
本研究结果表明,人参皂苷Rg1能够抑制人CML耐ADR细胞K562/ADR增殖并逆转其耐药性,提高K562/ADR细胞对ADR的敏感性,其可能与阻滞细胞周期于 G0/G1期有关。但肿瘤耐药是一个多机制、多基因的复杂过程,目前尚不能明确人参皂苷Rg1联合ADR逆转K562/ADR耐药与细胞周期的关系,其具体机制还有待深入研究。在后续研究中,将通过检测K562/ADR细胞胞内ADR累积情况和耐药蛋白P-gp的表达水平来进一步分析人参皂苷Rg1对K562/ADR的耐药逆转作用,同时检测细胞周期相关蛋白Cyclin 和CDK的表达水平来进一步分析人参皂苷Rg1联合ADR逆转K562/ADR耐药与细胞周期阻滞的关系,为白血病的耐药治疗提供实验依据。
