miR-24通过PI3K/AKT抑制脑梗死大鼠脑损伤的机制研究
2023-04-10张科儒杨春梅
张科儒, 李 花, 陶 黎, 杨春梅
脑梗死又称缺血性脑卒中(cerebral ischemic stroke),是因脑部血液供应障碍导致的局限性脑组织的缺血性坏死或软化,发病的患者有可能会存在肢体活动障碍、言语功能障碍或者是意识昏迷的现象[1,2]。microRNAs(miRNAs)在缺血性疾病中发挥重要作用,研究表明miR-24可以降低脑梗死大鼠的血脂[3],通过CDX1/PI3K/Akt通路促进人脑胶质瘤细胞生长[4],也可以参与糖尿病大鼠血管重构[5],同时本研究前期通过基因芯片筛选脑梗死患者外周血差异基因发现miR-24是显著异常表达的miRNAs之一,因此本研究将进一步探究其作用机制,在大鼠中探究miR-24是否通过调控PI3K/AKT通路发挥脑梗死的脑保护作用,报道如下。
1 材料与方法
1.1 实验动物
1.1.1 SD大鼠 SPF级SD大鼠,8~10周龄,雄性,体重200~250 g,由北京维通利华实验动物中心提供。
1.1.2 药品与试剂 水合氯醛购自天津市申泰化学试剂有限公司,miR-24 agomiR上海吉玛制药技术有限公司合成,苏木精(H9627),伊红(861006)购于美国sigma公司,Anti-Bcl-2 antibody (ab194583),Anti-Bax antibody (ab32503),Anti-caspase-3 antibody (ab184787),Anti-PI 3 Kinase catalytic subunit gamma/PI3K-gamma antibody (ab154598),Anti-pan-AKT antibody (ab8805),Anti-AKT (phospho T308) antibody (ab38449),Anti-GAPDH antibody (ab8245)及二抗抗体购于美国Abcam公司。
1.1.3 仪器设备 Leica RM2015切片机,德国Leica公司,-80 ℃超低温保存箱,美国Thermo公司,4 ℃冰箱,购自合肥美菱股份有限公司,SC-3610低速离心机,购自安徽中科中佳科学仪器有限公司,ABI 7500 qPCR仪,美国Thermo Fisher公司,Western blot电泳仪,BIO-RAD公司,美国。
1.2 实验方法
1.2.1 大鼠分组及饲养条件 50只8~10周龄雄SD大鼠于SPF级鼠房饲养,室温调节在(25±2)℃,相对湿度40%~65%,12 h/12 h昼夜交替照明,自由摄取食物和饮用水,适应性饲养1周后造模,本实验通过医院伦理委员会审核,伦理审查号:20211383。
1.2.2 大鼠脑梗死动物模型的建立 大鼠随机分为4组,对照组随机选取10只,假手术组随机选取10只,其他30只建立大鼠脑梗死模型将大鼠消毒后固定,在大鼠颈部前正中线处切开皮肤,采用钝性分别分离左侧颈总动脉(CCA)、颈内动脉(ICA)以及颈外动脉(ECA);进一步结扎大鼠ECA,找到远心端,使用动脉夹夹闭ICA、ECA;在 ECA距CCA 1 cm的分叉处用剪刀剪开,用 MCAO线栓沿ECA缓慢插入ICA,进线的深度控制在大约18~22 mm之间,缝合大鼠颈部伤口并消毒;2 h后将露出体外的线栓用剪刀减去,造成再灌注损伤。大鼠完全苏醒以后,对所有的大鼠进行提尾实验观察,造模成功标准为右前肢呈现屈曲的状态,最终成模率80%,随机选取20只用于实验。假手术组大鼠操作与模型组一致,仅不予结扎和插线。模型组大鼠在完成MCAO模型建立2 h后,对其进行脑室内立体定向注射miR-24 agomir,以调控脑部组织内miR-24的表达[6]。
1.2.3 大鼠脑组织HE染色 脊椎脱臼法处死大鼠后,分离各组大鼠脑组织,对各组大鼠脑组织进行固定包埋后切片,脱蜡覆水,苏木精染色5 min,5%乙酸1 min,伊红染色1 min,脱水:70%、80%、90%、100%酒精各10 s,二甲苯1 min,通风橱自然晾干再封片,于显微镜下进行检查,神经元正常且没有皮质水肿记录为“-”;少数神经元坏死带有少量皮质水肿,梗死面积小于皮质总面积的1/3记录为“+”;少量神经元坏死并伴有皮质水肿,梗死面积占皮质总面积的1/3至2/3记录为“”;大量神经元坏死及皮质水肿,梗死面积大于皮质总面积的2/3记录为“”[7]。
1.2.4 大鼠脑组织TTC染色 将各组大鼠脑组织进行冠状切片,然后将各组大鼠脑部切片置于浓度为2%的2,3,5-三苯基氯化四氮唑(TTC)溶液中,染色20 min,染色后用4%多聚甲醛固定,拍照,分析脑梗死面积[8]。
1.2.5 大鼠脑组织miR-24表达水平分析 用TRizol提取各组大鼠脑组织mRNA后,立刻按照试剂盒进行cDNA反转录,反转录进行qPCR,引物序列为:miR-24 F-CAGAGATCTAAGTCGTGTGAAATCATGTG,miR-24 R-TAAGTCGACAACAGGGTTTTCCAAGTCTA,U6 F-GTGCAGGGTCCGAGGT,U6 R-CTCGCTTCGGCAGCACA,扩增条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸20 s,共40个循环。以2-△△Ct计算miR-24相对表达量[9]。
1.2.6 Western blot检测大鼠脑组织蛋白的表达 对各组大鼠脑组织分离后进行液氮研磨,采用RIPA蛋白裂解液细胞收取总蛋白,进行SDS-PAGE电泳80 vs 15 min,120 vs 2 h, PVDF膜转模120 vs 2.5 h,TBST 漂洗3次每次10 min,使用5%脱脂奶粉封闭,TBST漂洗3次,每次10 min,加入一抗,二抗温孵育后,TBST漂洗3次,每次10 min,ECL 显色,发光仪曝光、拍照[10,11]。
1.3 统计学分析 应用SPSS 22.0统计软件分析数据。计量资料比较采用独立样本t检验、F检验和SNK-q检验,计数资料采用χ2检验或KW秩和检验。P<0.05为具有统计学意义。
2 结 果
2.1 miR-24对大鼠脑组织皮质病理学的影响 对照组和假手术组大鼠脑组织的皮质区形态规则,极少数出现已凋亡的神经细胞。模型对照组大鼠的脑组织皮质区形态不规则,凋亡细胞数增加,试验组大鼠的脑组织皮质区神经细胞形态学好于模型组,凋亡数明显减少(见表1、图1)。

图1 各组大鼠脑组织皮质HE染色分析(×200)

表1 各组大鼠脑组织皮质病理学分析(只)
2.2 各组大鼠脑梗死面积的比较 对照组和假手术组大鼠脑组织红色均匀,无脑梗死发生,模型组出现大面积白色脑梗死区域;而试验组大鼠相对于模型组大鼠脑组织脑梗死区域范围明显减少,脑梗死状况出现明显改善(见图2)。

图2 各组大鼠脑梗死面积的比较
2.3 miR-24在各组大鼠脑组织中的表达水平 与对照组和假手术组大鼠相比,模型组大鼠脑组织miR-24表达显著降低(P<0.05);而试验组大鼠相对于模型组大鼠miR-24表达显著上升(P<0.05),但仍显著低于对照组和模型组(P<0.05)(见图3)。

图3 miR-24在各组大鼠脑组织中的表达水平
2.4 各组大鼠脑组织凋亡蛋白caspase-3、Bcl-2、Bax相对表达量的比较 与对照组和假手术组大鼠相比,模型组大鼠脑组织caspase-3、Bax蛋白表达有上升趋势,Bcl-2蛋白表达有降低趋势(P<0.01);而试验组大鼠相对于模型组大鼠caspase-3、Bax有降低趋势,但仍显著高于对照组和模型组(P<0.05),Bcl-2蛋白表达有升高趋势,但仍显著低于对照组和假手术组(P<0.05)(见表3)。
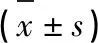
表2 miR-24在各组大鼠脑组织中的表达水平
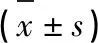
表3 各组大鼠脑组织凋亡蛋白caspase-3、Bcl-2、Bax相对表达量比较
2.5 各组大鼠脑组织中PI3K/AKT信号通路的变化 与对照组和假手术组大鼠相比,模型组大鼠脑组织PI3K、AKT蛋白表达有降低趋势,p-AKT蛋白表达有降低趋势(P<0.01);而试验组组大鼠相对于模型组大鼠PI3K、AKT有上升趋势,p-AKT也有上升的趋势,相对定量进一步验证了这种趋势(P<0.01)(见表4、图4)。
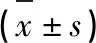
表4 各组大鼠脑组织中PI3K/AKT信号通路的变化

图4 大鼠心脏组织Dvl3、GSKβ及β-catenin的蛋白表达水平
3 讨 论
脑梗死多发于50~60岁以上的中、老年人,男性发病率高于女性,患者临床常合并有动脉硬化、高血压、高脂血症或糖尿病等危险因素或对应的全身性非特异性症状。脑梗死的前驱症状无特殊性,部分患者可能有一时性肢体麻木、头晕、肌肉及四肢无力等短暂性脑缺血发作的表现。脑梗死发病通常属于急症,具有高致残率及高致死率的特征,临床治疗原则多为超早期治疗,在发病4.5 h内尽可能静脉溶栓治疗,在发病6~8 h内进行适当的急性期血管内干预,并依据患者自身的危险因素、病情程度等采用对应针对性治疗,结合神经外科、康复科及护理部分等多个科室的努力实现一体化治疗,以最大程度提高治疗效果和改善预后[11,12]。MicroRNA是长度约为20~24个核苷酸的一类内生的小RNA,在细胞内具有多种重要的调节作用。研究表明,多种microRNA对神经系统细胞有调控作用,如miR-124-3p可以通过靶向RhoG抑制多形性胶质母细胞瘤的生存能力和运动能力,抑制GBM细胞中的miR-124-3p可上调RhoG水平并促进GBM细胞的增殖。特异性小干扰RNA序列敲低RhoG表达部分中和了miR-124-3p抑制剂诱导的效应[13,14],但miR-24在神经系统疾病尤其是脑梗死中得作用尚不清晰,本研究表明,在大鼠脑梗死中,miR-24出现了显著的下调,过表达miR-24后,可以显著抑制大鼠神经细胞凋亡,缩小大鼠脑梗死面积,发挥脑保护的作用。
PI3K/AKT信号通路可以调控多种不同细胞功能,在包括代谢、生长、增殖、存活、转录以及蛋白质合成等方面发挥重要作用[15]。研究表明,PI3K/AKT在脑损伤保护中发挥重要作用,PI3K/AKT和Nrf2/ARE通路可在缺血性脑组织神经保护和抗氧化作用。本研究表明通过大鼠脑梗死模型证实,脑组织内PI3K、AKT及p-AKT均有下降的趋势;而过表达miR-24后,大鼠脑组织PI3K、AKT及p-AKT均有上升趋势,提示出miR-24的调控与PI3K/AKT信号通路关键分子PI3K和AKT紧密相关,同时AKT蛋白的磷酸化修饰在此过程中发挥重要作用。
综上所述,miR-24可以抑制脑梗死大鼠脑损伤,其机制于PI3K/AKT信号通路的调控及其磷酸化修饰密切相关。
