侯氏制碱法产物碳酸钠中氯化钠的有效去除*
2023-04-03王文卓郭子琰王锐泽陈咏梅徐庆红
李 洋 王文卓 郭子琰 王锐泽 陈咏梅 徐庆红
(北京化工大学化学学院 北京 102299)
自1943年侯德榜先生发明侯氏制碱法以来,我国纯碱工业生产能力高速发展。纯碱作为基本化工原料,被广泛应用于造纸、冶金、纺织、石油、国防、医药等领域,纯碱同时也是制造其他化学品的原料、清洗剂和洗涤剂。[1,2]在纯碱的生产过程中,Na+和Cl-极容易被中间产物NaHCO3吸附和包夹,因此,在NaHCO3经过焙烧之后,产物Na2CO3中含有一定量的杂质NaCl。NaCl 在Na2CO3中含量的高低是成品纯碱被关注的主要指标之一,是判定纯碱产品品级的一项重要指标。Na2CO3中NaCl 的含量越低,纯碱产品品级越高,质量越高。纯碱制备过程中的纯化同样关系到外销产品的经济效益和国家的国际名誉。化工产品国家标准规定,成品纯碱中NaCl 的含量小于0.0050 %为优级品,含量为0.0050 %~0.0080 %为一级品,含量为0.0080%~0.010%为合格品,含量大于0.010%为等外品。[3,4]因此,降低联合制碱法产物纯碱中NaCl 的含量,具有重要意义。
对于纯碱制备过程中的纯化问题,研究者们多年来进行了很多尝试,也发展了很多纯化方法,诸如化学沉淀-结晶法[5]、微孔膜过滤法[6]、蒸发-结晶法[7]和碳化-络合法[8]等等。例如:杨等[9]采用重结晶法提纯纯碱产品,去除效率最高只能达到52.97%;叶等[7]虽然使用蒸发-结晶法实现了94.4%的纯碱回收率,但该方法成本高昂、操作复杂,并不适合实验教学大规模使用。长期的实践证明,很多已知方法有除杂效果低、成本高、操作繁杂、其他杂质的引入、造成二次环境污染等弊端。[10]
通过探索,课题组实现了便捷高效、绿色环保的实验室规模纯碱纯化新方法。该方法不仅对中学和大学化学实验教学项目“碳酸钠的制备”产物纯化切实可行,优化了无机化学实验课程内容;同时也给工业纯碱生产提供了一个产物纯化新思路。
一、实验部分及样品测试方法
1.仪器与试剂
仪器:循环水式多用真空泵(河南豫华仪器科技有限公司SHZ-DIII);恒温水浴锅(江苏新春兰科学仪器有限公司HH-M6);万分之一电子天平(上海舜宇恒平科学仪器有限公司FA2004);旋转蒸发仪(上海远怀实业有限公司RE501)。
试剂与材料:氯化钠(AR,≥99.5 %),碳酸氢铵(AR,NH3含量21.0~22.0 %),一水合硝酸汞(AR,≥98.0%),硝酸(AR,≥68.0%),溴酚蓝(生物技术级),二苯偶氮碳酰肼指示剂(AR,≥40.0 %),NaOH 溶液(AR,≥68.0 %),无水乙醇(AR,≥99.7 %),甲醇(AR,≥99.7%),正丁醇(AR,≥99.7%)。上述试剂均购自北京化学试剂厂。实验用水均为去离子水。
2.实验内容
按照《新编大学化学实验》教材中“碳酸钠的制备”相关内容进行纯碱的制备。[11]量取NaCl 溶液(270.0 g/L)50 mL 放入100 mL 烧杯中,然后水浴加热,温度控制在30~35 ℃范围内。称取NH4HCO3固体20 g,在不断搅拌下分批次加入到上述溶液中。加料完毕后继续充分搅拌20 min左右,并保持反应要求温度。静置几分钟后减压过滤,得到NaHCO3晶体(尽量抽干母液)。抽干后用所选定的试剂对样品进行洗涤。在此步骤开展一系列单变量实验,探究最佳样品洗涤条件对NaCl 去除率的影响。对洗涤后的样品进行高温焙烧,制备得到Na2CO3试样。利用标准汞量法测定Na2CO3样品中Cl-的含量。另外,考察洗涤液4次重复使用后的回收率。
(1)乙醇用量对洗涤效果的影响
按照提供的制备方法,相同条件下制备11 组NaHCO3。20 ℃下使用无水乙醇作为洗液对NaHCO3进行洗涤,润洗次数1次,润洗时间1 min,收集洗涤后的NaHCO3待用。反应物和乙醇的质量比(m乙醇/m反应物)分别为6∶1、4∶1、3∶1、2∶1、1.5∶1、1∶1、1∶1.5、1∶2、1∶3、1∶4、1∶6。
将洗涤后的产品置于蒸发皿中,并水浴加热将乙醇挥发殆尽;然后样品置于石棉网上高温焙烧0.5 h左右,得到白色粉末状Na2CO3。冷却到室温后,称量。准确称取2.0000 g 制备的Na2CO3样品溶于去离子水中,并定容于50.00 mL 容量瓶中。用移液管移取25.00 mL Na2CO3溶液,用0.0500 mol/L 硝酸汞标准溶液进行滴定,测定样品中Cl-含量,得到最佳m乙醇/m反应物比率。
(2)润洗次数对洗涤效果的影响
按照提供的制备方法,在相同条件下制备6组NaHCO3试样。20 ℃下用上述步骤中得到的最佳m乙醇/m反应物比值对NaHCO3进行洗涤,分别润洗0、1、2、3、4、5次,每次润洗时间为1 min。采用上述相同的方法制备Na2CO3试样并测定其中的Cl-含量,得到最佳润洗次数。
(3)润洗时间对洗涤效果的影响
按照提供的制备方法,在相同条件下制备7 组NaHCO3试样。使用无水乙醇作为洗液,选择最佳反应物和乙醇质量比例及润洗次数,20 ℃下润洗NaHCO3试样。七组试样的浸泡时间分别为0、1、2、3、4、5、6 min。采用前述相同的方法制备Na2CO3试样并测定其中的Cl-含量,得到最佳润洗时间。
(4)洗液浓度对洗涤效果的影响
按照提供的制备方法,在相同的条件下制备6 组NaHCO3。分别使用0%、20%、50%、80%、85%、90%、95%、96%、97%、98%、99%、100%乙醇水溶液为洗液,在最佳反应物和乙醇质量比例、润洗次数、润洗时间条件下,于20 ℃用乙醇水溶液洗涤NaHCO3试样。采用前述相同的方法制备Na2CO3试样并测定其中的Cl-含量,得到最佳洗液浓度。
(5)洗液温度对洗涤效果的影响
按照提供的制备方法,在相同的条件下制备6 组NaHCO3。在最佳反应物和乙醇质量比例、润洗次数、润洗时间、洗液浓度条件下,分别用温度为0 ℃、10 ℃、20 ℃、30 ℃、40 ℃及50 ℃的乙醇水溶液对产物进行洗涤。采用前述相同的方法制备Na2CO3试样并测定其中的Cl-含量,得到最佳洗液温度。
(6)探究洗涤液种类对洗涤效果的影响及机理分析
按照提供的制备方法,在相同的条件下制备4 组NaHCO3。在上述得到的最佳洗涤条件下,分别用甲醇(极性6.6)、正丁醇(极性3.7)、异丁醇(极性3.0)作为洗液对产品进行洗涤。采用前述相同的方法制备Na2CO3试样并测定其中的Cl-含量。比较上述洗液和乙醇(极性4.3)溶液对NaCl 洗除的效果,并分析洗液极性与NaCl脱除率及产物产率之间的关系。
(7)探究洗涤步骤对洗涤效果的影响及机理分析
按照提供的制备方法,在相同的条件下制备3 组NaHCO3。在上述得到的最佳洗涤条件下,对比洗涤潮湿态NaHCO3、干燥态NaHCO3及干燥态终产物Na2CO3三种情况下的NaCl去除率。
(8)乙醇洗液回收率的考察
按照实验步骤中的制备方法,在相同操作条件下制备5组NaHCO3。在最佳洗涤条件下,使用同一批乙醇溶液对该5份样品连续进行洗涤,旋蒸回收每次洗涤后的乙醇再利用,考察乙醇的回收率。
(9)Na2CO3试样中Cl-含量的测定
本实验使用汞量法测定样品中NaCl的含量。
0.05 mol∙L-1硝酸汞溶液的标定 用移液管移取25.00 mL NaCl 标准溶液(0.0500 mol∙L-1)于250 mL锥形瓶中,加100 mL 去离子水和2~3 滴溴酚蓝指示剂,滴加1.0 mol∙L-1硝酸溶液至溶液由蓝变黄,再过量2~6滴;加入4~5滴二苯偶氮碳酰肼指示剂,用硝酸汞标准溶液滴定至溶液由黄色变为紫红色,记录所用硝酸汞标准溶液的体积。同时做空白实验(25.00 mL去离子水)。
硝酸汞标准滴定溶液浓度c(mol∙L-1)以式1进行计算:
其中:c1为氯化钠标准溶液浓度(mol∙L-1);V1为移取的氯化钠标准溶液体积(mL);V为滴定所消耗的硝酸汞标准溶液体积(mL);V0为滴定空白试验溶液所消耗的硝酸汞标准溶液体积(mL)。
参比溶液的测定在250 mL锥形瓶中加入40 mL去离子水和2滴溴酚蓝指示剂,滴加硝酸溶液(1.8 mol∙L-1)至溶液由蓝色恰变为黄色,再过量2~3 滴。加入4~5 滴二苯偶氮碳酰肼指示剂,用已知准确浓度的硝酸汞溶液滴定至溶液由黄色变为紫红色,记录所消耗的硝酸汞标准溶液体积。
Na2CO3试样中NaCl 含量的测定称量2.0000 gNa2CO3试样,用少量去离子水溶解后转移至50.00 mL容量瓶中。然后用移液管准确移取25.00 mL 配制好的Na2CO3溶液于250 mL锥形瓶中,加入2滴溴酚蓝指示液,滴加7.4 mol∙L-1硝酸溶液中和至溶液变黄后,滴加1 mol∙L-1氢氧化钠溶液至溶液变蓝,用1.8 mol∙L-1硝酸溶液调至溶液恰好呈黄色后再过量2~3 滴。向上述溶液中滴加4~5滴二苯偶氮碳酰胼指示液,用已知准确浓度的硝酸汞溶液滴定至溶液由黄色变为紫红色即为终点,记录所消耗的硝酸汞标准溶液体积。试样中氯化钠质量分数wNaCl由式2计算得到。
其中:c为硝酸汞标准溶液浓度的准确值(mol∙L-1);V为滴定消耗的硝酸汞标准溶液体积(mL);V0为参比溶液所消耗的硝酸汞标准溶液体积(mL);m为Na2CO3试样的质量(g);M为氯化钠的摩尔质量(58.44)(g∙mol-1)。
二、实验结果及讨论
1. 乙醇溶液作为洗液洗脱NaHCO3中NaCl 杂质的可行性分析
NaCl、NaHCO3和Na2CO3在20 ℃水和无水乙醇中的溶解度如表1所示。研究发现,在去离子水和无水乙醇中,NaCl、NaCO3和NaHCO3的溶解度均依次降低,但三种物质在无水乙醇中的溶解度均很小,且呈快速递减趋势,NaHCO3在其中几乎不溶解。[12]如果用乙醇湿润洗涤制备过程中间产物NaHCO3,则有可能最大程度地将NaCl 从产品制备系统中去除同时保证产品损失率最小,从而提高纯碱的制备品质。另外,洗涤后的乙醇能够很容易地被蒸馏回收并循环使用,达到绿色环保、增加经济效益之目的。

表1 常温下NaCl、NaHCO3和Na2CO3在去离子水和无水乙醇中的溶解度
由于在室温下NaCl 在无水乙醇中的溶解度为0.065 g∙(100 g)-1,NaHCO3在无水乙醇中的溶解度约等于0.000 g∙(100 g)-1,在提纯过程中,用高浓度的乙醇水溶液为洗液,能够最大程度地提高NaCl在洗液中的溶解度并降低产品的损耗。另外,根据NaCl 和NaHCO3的二元体系相图可知,NaCl 在乙醇中的溶解度随温度变化很明显,而NaHCO3在乙醇中的溶解度基本不随温度变化,故理论上提高洗液乙醇温度能够提升NaHCO3中的NaCl脱出效率。[13]
本实验用高浓度乙醇溶液洗涤制备过程中的中间产物NaHCO3。通过开展单变量实验,探究洗液与反应物质量比、洗涤时间、洗涤次数、洗液浓度、环境温度对氯化钠去除率以及碳酸钠产率的影响,以期望得到最佳洗涤条件。溶解过程是溶质与溶剂分子间相互作用的结果,溶解度主要取决于同种分子和异种分子之间的作用力,而分子间引力的大小与分子的极性、极化度、分子间形成的氢键以及络合物的形成等有关。[14]因此,课题组在探究用高浓度乙醇作为洗液的同时,还对分子极性不同的甲醇、正丁醇、异丁醇作为洗液从NaHCO3中洗脱NaCl 进行了研究,并将结果与高浓度乙醇溶液的洗涤效果进行了比较。与此同时,课题组还对回收乙醇的重复利用性能进行了研究。对于Na2CO3中的NaCl 含量,本实验采用汞量法进行滴定测定(以二苯偶氮碳酰肼为指示剂),其中所涉及的滴定原理[15,16]如式3、4所示。滴定过程中,Hg2+与洗涤液中的Cl-络合,当Cl-几乎全部反应后,稍过量的Hg2+与指示剂二苯偶氮碳酰肼络合,溶液变为紫红色。通过消耗的Hg2+物质的量计算所配制纯碱溶液中Cl-的物质的量,进而得到纯碱中所含NaCl 的百分含量。
2.以乙醇为洗涤液的单变量实验对NaCl 脱除率的影响
乙醇用量对NaCl 脱除率及Na2CO3产率的影响如图1所示。在m乙醇/m反应物由0提升到1∶3的过程中,杂质NaCl的脱除率由0.00 wt%快速提升到87.00 wt%;继续提高乙醇用量,NaCl 的脱除率虽然略有升高,但非常缓慢;当m乙醇/m反应物为3∶1时,产品中NaCl的脱除率达到94.33 wt.%,继续增加乙醇用量,NaCl的脱除率基本不再发生变化。由图1B 中可知,随着乙醇洗液用量的增加,Na2CO3的产率略有降低(67.91~64.63%),此降低主要是NaCl的脱除造成的。通过对比实验结果,秉承节省原料的绿色化学思想,选取m乙醇/m反应物=3∶1为最佳比例开展后续实验。

图1 乙醇用量对NaCl的去除率(A)及Na2CO3产率(B)的影响
浸润洗涤次数对NaCl 脱除率及Na2CO3产率的影响如图2所示。由实验结果可知,当用无水乙醇浸润洗涤NaHCO31 次时,终产物Na2CO3中NaCl 杂质的含量由于乙醇洗涤有显著降低,其脱除率高达94.33 wt.%,而后随着洗涤次数的增加,NaCl 的脱除率变化很小。因此,1 次洗涤就能够达到良好的杂质脱除效果。另外,多次洗涤对Na2CO3的产率影响不大。

图2 洗涤次数对NaCl的去除率(A)及对Na2CO3产率(B)的影响
无水乙醇对NaHCO3浸润时间的长短对NaCl脱除率及终产物Na2CO3产率的影响如图3所示。实验结果表明,当洗涤时间由2 min 提升到3 min 时,NaCl 的脱除率有较大提升;但随着浸润时间的延长,终产物中NaCl 含量略微降低,Na2CO3产率略有下降(见图3B)。因此,选取3 min为最佳洗涤时间开展后续实验。

图3 洗涤时间对NaCl的去除率(A)及Na2CO3产率(B)的影响
洗液温度对NaCl 从NaHCO3中的脱除率及Na2CO3产率有很大的影响。随着洗液温度的升高,NaCl 的脱除率开始不断增高,但最后逐渐趋于平缓(如图4A所示)。当洗液温度由0 ℃提升到50 ℃,NaCl的脱除率由96.92 wt.%提升到99.43 wt.%。但同时也发现,随着洗液温度的升高,NaHCO3在乙醇中的溶解度也大幅度增加,导致Na2CO3的产率大幅度降低(由64.65%降到51.77%,如图4B 所示)。由于20 ℃时,乙醇洗涤使得NaCl 脱除率已经能够达到98.96 wt.%,同时Na2CO3的产率降低不大,因此,从节能及安全等综合因素考虑,20 ℃完全可以作为最佳温度条件开展后续实验。
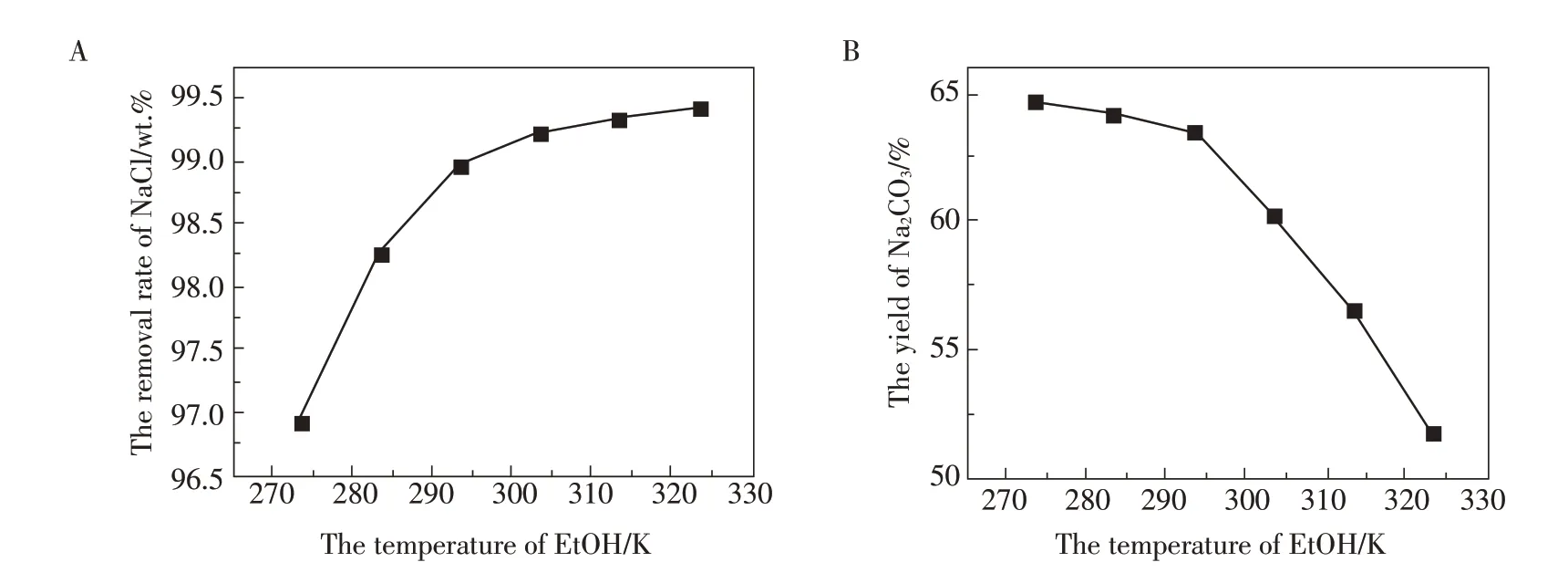
图4 洗液温度对NaCl的去除率(A)及Na2CO3产率(B)的影响
乙醇溶液的浓度对NaCl 脱除率及Na2CO3产率的影响很大,这主要是由于NaCl 和NaHCO3在水中都有着较高的溶解性。研究发现,当乙醇浓度由100 wt.%降低到98 wt.%时,NaCl 脱除率反而略有下降(从96.65 wt.%降到95.06 wt.%,如图5A所示)。其中的原因可能是随着浓度的降低,乙醇溶液的密度在逐渐增大,乙醇浸润NaHCO3的程度在逐渐减弱,导致NaCl的脱除率略有下降。但随着乙醇浓度继续降低(由98 wt.%降低到90 wt.%),NaCl 的脱除率又大幅度上升,由95.06 wt.%提升到98.96 wt.%。由于被90 wt.%乙醇洗涤后,产物中NaCl 的含量已经很低,如果继续降低乙醇溶液的浓度实际上意义已经不大。事实证明,当乙醇浓度降到80 wt.%以下时,终产物Na2CO3的产率将会受到很大影响(如图5B 所示)。因此,90 wt.%可以被视为最佳洗液浓度。

图5 洗液浓度对NaCl的去除率(A)及Na2CO3产率(B)的影响
3.对不同阶段合成产物洗涤效果的实验
课题组对潮湿中间产物NaHCO3(A)、干燥的中间产物NaHCO3(B)及干燥的终产物Na2CO3(C)进行了乙醇溶液单变量最佳组合实验条件下的洗涤,结果如表2所示。在潮湿NaHCO3试样中,绝大部分Cl-和Na+能够以游离的离子形式被乙醇溶液快速洗涤掉,此时NaCl 的最高脱除率达到98.96 wt.%。而在干燥的NaHCO3和Na2CO3试样中,部分Cl-和Na+将以NaCl 分子形式紧密结合在一起,很难被洗除。因此,NaCl 脱除最佳洗涤对象是经过减压抽滤后潮湿的NaHCO3试样。

表2 洗涤步骤对NaCl脱除率及Na2CO3产率的影响
通过上述系列单变量实验探究,我们得到了以乙醇为洗涤液的实验室规模联合制碱法纯碱中NaCl 最佳洗涤脱除条件:对潮湿的中间产物NaHCO3进行洗涤,m乙醇/m反应物=3/1、洗涤次数1 次、洗涤浸润时间3 min、洗液温度20 ℃,洗涤液浓度90 wt.%。在该洗涤条件下,杂质NaCl 的最大脱除率可以达到98.96 wt.%,Na2CO3产率为63.55%。
4.洗涤剂种类对洗涤效果的影响
在最佳洗涤条件下,我们比较了甲醇、乙醇、正丁醇、异丁醇四种极性不同的有机溶剂(100 wt.%)对实验室规模联合制碱法中间产物NaHCO3中NaCl 的洗脱效果及洗涤过程对终产物Na2CO3产率的影响。实验结果如表3所示。通过对比实验结果可知,洗涤剂极性与NaCl 脱除率之间有着规律性的变化关系。在相同洗涤条件下,洗涤剂极性越高,NaCl 的脱除率越高,呈现出同向变化关系。

表3 洗涤剂极性对NaCl脱除率及Na2CO3产率的影响
5.乙醇洗液的回收
我们对洗涤后的乙醇溶液进行了回收(采用旋蒸法),以利于乙醇的重新使用。结果表明,4 次重复使用后,乙醇的回收率能够达到89.70 wt.%(见表4),大大节约了实验成本。

表4 4次重复使用后乙醇洗液的回收率
三、本教改实验的创新点及教学实施运行思路
1.本教改实验的创新点
(1)对中学和大学化学实验“碳酸钠的制备”方案进行改进,提出了一种切实可行的纯碱制备过程中脱除NaCl 新方法。旨在建立和培养学生合成过程中化合物的纯化思想和能力。
(2)与前人提出的纯碱制备过程中NaCl脱除方法相比,本纯化方法具有操作简单、绿色环保、成本低廉且效果显著的特点。本实验方案不但能够作为化学实验教学项目“碳酸钠的合成”中的一个NaCl 脱除步骤进行,而且还能够开发成“化合物制备—产物纯化及碳酸钠中杂质NaCl含量的测定—总碱度的测定”一个全新的综合化学实验教学项目。
(3)本论文实验结果同时也为工业纯碱生产过程中NaCl脱除提供了一种新的思路和方法。
2.教学实施运行思路
本实验属于对已有无机化学教学实验“碳酸钠的制备”的改进,涉及到无机及分析化学实验中的化合物制备、减压抽滤、样品洗涤纯化、滴定等操作和知识点。本文中所得到的实验结果不仅可以实现对“碳酸钠的制备”方案的改良,同时也适合单独开展产物纯化实验,在现有的“碳酸钠的制备”“双指示剂法测定碳酸钠的总碱度”两个现有教学实验基础上形成“化合物制备—产物纯化及碳酸钠中杂质NaCl 含量的测定—总碱度的测定”的完整联合制碱法综合实验教学项目。
如果作为完整的综合实验教学项目,建议整个教学过程分5个环节完成:
(1)NaHCO3样品的制备。该实验步骤需要1.0学时;
(2)NaHCO3样品的洗涤。利用本论文得到的最佳组合条件对NaHCO3样品进行洗涤。该实验步骤需要0.5学时;
(3)灼烧制备Na2CO3样品。该实验步骤需要1.0学时;
(4)汞量法测定样品中氯化物含量。该实验步骤需要2.0学时;
(5)Na2CO3中总碱度的测定。该实验步骤需要2.0学时。
四、结论
本论文对中学和大学化学教学实验项目“碳酸钠的合成”实验方案进行了改进,探索了Na2CO3制备过程中NaCl 杂质的去除新方案。研究发现,利用90%乙醇作为洗液,在常温条件下对Na2CO3中杂质的最大去除率达到98.96 wt.%,Na2CO3产率达到63.55%,乙醇回收率高达89.70 wt.%。利用乙醇作为洗液去除NaCl,具有高效、无毒特点,是一种可持续、绿色环保的纯碱纯化方法。
本实验不仅为化学教学实验项目“碳酸钠的制备”提供了切实可行的产物纯化方法,同时也给工业纯碱生产提供了一个产物纯化新思路。
