亚洲百合及东方百合 AGPase 酶活性及表达量与淀粉含量的相关性
2023-03-31李莲莲莫江玲张超超吴学尉王丽花
张 达,李莲莲,莫江玲,李 缘,张超超,吴学尉,王丽花
(1.云南大学农学院, 昆明 650504; 2.云南省农业科学院花卉研究所, 昆明 650205)
【研究意义】百合是百合科百合属(Lilium)球根花卉植物,是重要的鲜切花[1],中国切花生产用百合种球主要依赖进口,每年需向荷兰进口约3亿粒百合种球[2]。中国从20世纪90年代开始研究百合种球国产化,目前已取得一定成果[3],但在百合种球繁育周期长及采后处理技术等方面还有进一步研究和进步的空间[4]。通常百合鳞茎需要培育到一定围径规格才能开花,不同类型百合鳞茎培育膨大速率不同[5-8]。鳞茎的膨大及植株发育受淀粉合成代谢的影响[9-12],离不开相关酶的调控,相关酶的活性及表达会影响淀粉的合成与累积[12]。在淀粉生物合成的相关酶中,腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)作为淀粉合成限速酶调控淀粉生物合成的第一步,其活性及表达量对淀粉的生物合成至关重要[13-16]。因此,对AGPase酶活性及其基因的表达量与淀粉含量的相关性进行研究,探索出的其相关性可作为前期优良品种的鉴定及为后续分子实验提供理论基础,有利于促进百合种球国产化。【前人研究进展】在东方百合种球鳞茎中,AGPase酶活性与淀粉积累量表现为正相关[17]。百合AGPase基因RNAi载体构建也已有报道[18]。已有使用转录组测序的方法对兰州百合籽鳞茎形成发育过程中不同时期淀粉合成相关酶的基因的研究,结果表明,与淀粉合成方向相关的酶,如ADPG焦磷酸化酶(AGPase)、可溶性淀粉合成酶(SSS)、淀粉分支酶(SBE)和颗粒结合型淀粉合成酶(GBSS)在鳞茎形成和膨大期表现为母鳞片中活性减少,小鳞茎中基因表达量增加,而裂解方向的淀粉去分支酶(SDBE)在母鳞片中的基因表达量高于小鳞茎,这说明淀粉合成相关酶与鳞茎的膨大密切相关,并在分子水平上证明了碳水化合物代谢在小鳞茎发生和发育中的重要性[19]。针对食用百合兰州百合的3个淀粉合成相关酶(AGPase、SSS、GBSS)的基因克隆,表达量分析也已见报道,研究结果表明淀粉合成酶对于百合淀粉积累以及种球膨大发育具有重要作用[20]。【本研究切入点】不同种类百合的AGPase表达量与淀粉含量的相关性、不同种类百合的AGPase酶活性与淀粉含量的相关性以及直接针对切花种球的相关研究尚未见报道。【拟解决的关键问题】本研究从AGPase的大小亚基基因AGPS及AGPL作为出发点,克隆并预测其结构与功能,并通过研究其基因表达的模式,测定淀粉酶活性,使用皮尔逊相关性分析最终得出淀粉含量,AGPase酶活性,AGPase亚基基因表达量之间的相关性,从而更好的了解百合中淀粉合成的影响因素,若AGPase基因与淀粉合成及淀粉含量正相关,则可作为筛选高淀粉含量百合种质的标记,为早期快速鉴定百合新种质提供新途径,也可为后续基因编辑等分子实验提供理论基础。
1 材料与方法
1.1 样品采集
本实验所采取的研究对象为亚洲百合川百合及东方百合‘白佩琪’。本实验所采取的百合鳞片均采集自云南大学农学院温室。鳞片分为3个发育阶段取样:花期即第1朵花开后的2 d进行采集;倒苗期即地上茎完全枯萎后的第5天进行采集;出苗期即第2年鳞茎出芽后的第5天进行采集,所有鳞片均采集鳞茎内部鳞片。本实验所采取的叶片为花期的叶片,采集时间为花开后的2 d进行采集。采样时每个样品采集3份百合组织作为生物学重复材料。
1.2 样品的总RNA提取及cDNA合成
使用北京擎科生物科技有限公司的多糖多酚植物总RNA提取试剂盒在液氮冷冻的研钵中进行RNA的提取,提取鳞片时使用100 mg材料;提取叶片时,使用200 mg材料。使用1.2%的琼脂糖凝胶电泳检测核酸纯度,使用微量紫外分光光度计测量浓度,提取后的RNA置于-80 ℃冰箱保存。取1000 ng RNA,使用北京擎科生物科技有限公司的反转录试剂盒进行基因组DNA的去除以及反转录。
1.3 基因克隆
以各个组织的混合样品提取cDNA作为模板,根据云南大学农学院花卉产业研究中心所测的转录组Unigene序列,通过Blast的方法在nr/nt数据库比对得到两类百合的AGPase基因序列信息,设计特异性引物(表1)进行扩增。使用KOD FX酶进行克隆,PCR扩增体系为20 μL。PCR产物使用1.2%琼脂糖凝胶电泳,将目的片段胶回收后连接于T载体上,再转化于DH5α大肠杆菌感受态细胞中,涂布于含卡那霉素抗性的LB平板上。培养24 h后进行阳性克隆筛选,将阳性菌液送到北京擎科生物昆明分公司进行测序。将测序所得结果在NCBI上进行CD-search保守结构域分析,在其保守结构域内设计qPCR引物。
1.4 qPCR及分析
使用Primer6软件(http://www.premierbiosoft.com)进行引物设计。设计的引物由北京擎科生物科技有限公司进行合成(表1)。对克隆得到的AGPase1 个小亚基、2 个大亚基序列进行引物设计,使用设计的引物,使用 Takara TB Green®Premix ExTaqTMII 试剂盒(RR820A),以EIF为内参基因,对所有样品进行 qPCR。得到的结果使用2-ΔΔCT的方法计算结果,数值使用 GraphPad Prism 8.0.1 进行分析及作图。

表1 引物序列
1.5 淀粉含量及酶活性的测定
使用索莱宝的淀粉含量检测试剂盒(BC0700),对所有材料进行淀粉含量的测定;使用索莱宝的AGP活性检测试剂盒(BC0430),对所有材料进行AGPase酶活性的测定,U为酶活单位,定义为每克组织在反应体系中每分钟催化产生1 nmol 还原型辅酶Ⅱ(NADPH)定义为一个酶活单位(U)。
1.6 相关性分析
借助R语言,使用R包Hmisc下的rcorr命令进行皮尔逊相关性分析(Pearson correlation analysis),再使用R包corrplot进行可视化展示。对所有时期鳞片的AGPase基因相对表达量,酶活性及淀粉含量进行相关性分析;叶片由于不是淀粉的贮藏器官,故采用AGPase基因相对表达量,酶活性与同时期的鳞片淀粉含量进行相关性分析。
2 结果与分析
2.1 AGPase基因克隆
AGPase是由2个小亚基基因和2个大亚基基因组成的异源四聚体,由不同的基因编码。本次实验克隆测序后得到AGPase小亚基基因序列1个,命名为AGPS;大亚基基因2个,分别命名为AGPL1及AGPL2,所得保守结构域见图1。本次克隆到的2类百合各3个基因都具有PLN02241超级家族中的PLN02241家族蛋白结构特征。

A:亚洲百合川百合小亚基基因AGPS;B:亚洲百合川百合大亚基基因AGPL1;C:亚洲百合川百合大亚基基因AGPL2;D:东方百合‘白佩琪’小亚基基因AGPS;E:东方百合‘白佩琪’大亚基基因AGPL1;F:东方百合‘白佩琪’大亚基基因AGPL2。
2.2 AGPase相对表达量
通过对AGPase的3个基因序列在两类百合不同时期的内层鳞片中的表达量分析表明,大亚基基因在不同百合中表达趋势总体是相似的,但相同的发育阶段,两类百合的表达量也呈现出一定差异。小亚基基因在东方百合‘白佩琪’中倒苗期表达量最高,另外两个时期表达量较低,但亚洲百合川百合倒苗期表达量最低,另外两个时期都高于倒苗期且另外两个时期表达量差异不大。总体上来看,大亚基基因的表达量要高于小亚基基因(图2~3)。

bc:出苗期;bh:花期;bd:倒苗期,图中同一基因不同小写字母表示有显著性差异(P<0.05),下同。
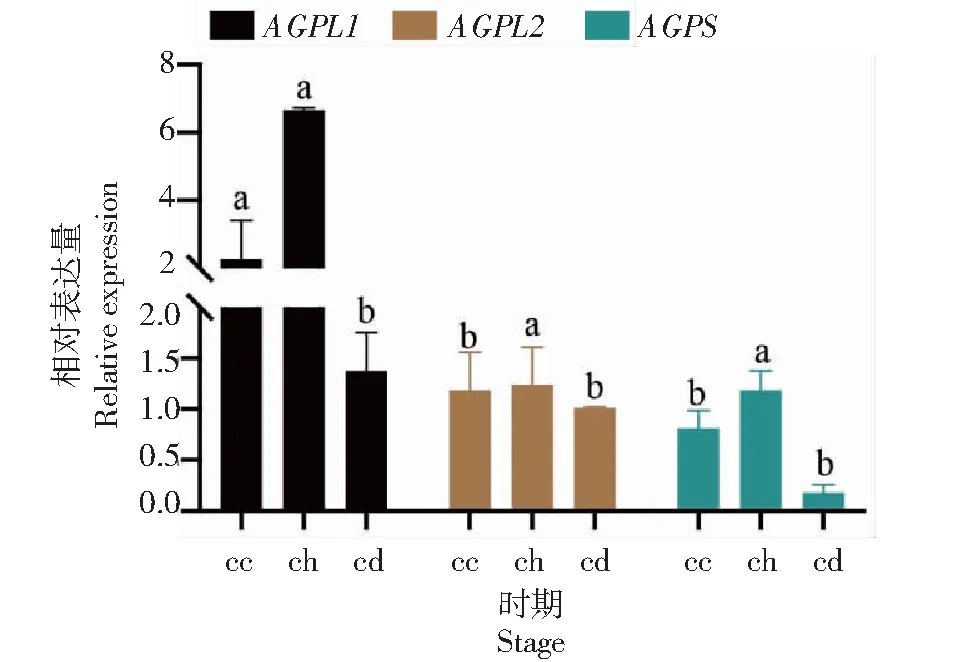
cc:出苗期;ch:花期;cd:倒苗期。
此外,本研究还测定了花期时叶片的3个AGPase亚基基因相对表达量,发现叶片中的大亚基基因表达量远低于内层鳞片,亚洲百合川百合及东方百合‘白佩琪’的AGPL1在内层鳞片中的表达量都约为叶片中的3倍;AGPL2在亚洲百合川百合鳞片中约为叶片的40倍,东方百合‘白佩琪’则约为36倍。但小亚基基因的表达量两类百合呈现不同的趋势,亚洲百合川百合小亚基基因的表达量鳞片中约为叶片的一半,而东方百合‘白佩琪’鳞片则是叶片的2倍左右。
2.3 两类百合的淀粉含量
由图4可知,不同种类的百合鳞片在发育过程中的变化趋势一致,但是东方百合‘白佩琪’仅花期含量比亚洲百合川百合高,其余时期都是亚洲百合川百合淀粉含量更高。同一时期(花期)不同组织的淀粉含量(图5)表明,叶片的淀粉含量相对鳞片低很多,且在该时期,东方百合‘白佩琪’的叶片及鳞片淀粉含量都高于亚洲百合川百合。

图5 两种百合叶片和鳞片在同一时期(花期)的淀粉含量
2.4 两类百合AGPase酶活性
由图6可知,不同种类的百合鳞片在发育过程中的酶活性变化趋势一致,但是东方百合‘白佩琪’仅倒苗期活性比亚洲百合川百合高,其余时期均是亚洲百合川百合酶活性更高。

图6 两类百合不同时期内层鳞片中的AGPase酶活性
由图7可知,叶片的酶活性相对鳞片都很高,且在该时期,东方百合‘白佩琪’的叶片及鳞片的酶活性都高于亚洲百合川百合。

图7 两种百合叶片和鳞片在同一时期(花期)的AGPase酶活性
2.5 百合淀粉含量与AGPase酶活性、AGPase基因表达间的相关性分析
2.5.1 百合鳞茎的AGPase基因、酶活性、淀粉含量的相关性 相关性分析(图8)表明,百合鳞茎的淀粉含量与AGPase酶活性及AGPS基因表达量高度线性正相关,相关系数分别为0.90及0.71。由此可以得出,酶活性及AGPS表达量都与淀粉含量正相关。

图中*表示有显著性差异(P<0.05),下同。
2.5.2 百合叶片的AGPase基因、酶活性、同时期鳞片淀粉含量的相关性 叶片相关性分析(图9)表明,叶片中3个AGPase基因之间都高度线性正相关,相关系数分别为0.96,0.89,0.92,这与鳞片中的3个基因的相关性模式不同,说明这3个基因在叶片中与在鳞片中可能存在不同的协同表达模式。此外,叶片中AGPase基因表达量与鳞片淀粉含量相关性不显著。

图9 叶片3个AGPase基因表达量及酶活性与同时期鳞片淀粉含量间的相关性分析
3 讨 论
本次克隆得到的亚洲百合川百合和东方百合‘白佩琪’的3个AGPase基因序列相似度都在95%以上。此外,本次克隆得到的AGPase基因序列均用Blast进行了验证,结果表明,所克隆到的基因与前人在兰州百合中所克隆基因序列相似度在90%以上[19]。由此可见,不同百合中AGPase相同亚基基因相对比较稳定保守。
本次所测淀粉含量及酶活性表明,不同类型百合的淀粉含量虽然有差异,但总体差别不大,与兰州百合及亚洲百合各发育时期总碳水化合物变化的趋势大体上也是一致的[21]。新铁炮百合的研究结果表示,在开花前植株鳞茎的淀粉积累达到最大值,而后淀粉含量开始下降[13],然而本实验均在倒苗期淀粉含量最高,这一点契合孙红梅等[21]在之前研究中提出的不同种类百合鳞茎发育过程中淀粉积累及转化的趋势不完全相同这一结论。
本次表达量分析中发现两类百合小亚基基因AGPS的表达量相较于大亚基基因AGPL1和AGPL2更低,这与兰州百合的小鳞茎发过程中这3个基因的表达量结果相一致[19]。水稻在不同温度处理下的相对表达量结果也表明,大部分时期小亚基基因的表达量都要低于大亚基基因[23]。根据本次相关性分析,小亚基基因AGPS表达量与淀粉累积正相关,故猜测这种现象或许是因为小亚基基因直接行使代谢功能而大亚基基因承担小亚基基因代谢活性的调控[24],所以在淀粉合成旺盛的时期小亚基基因才高度表达,而大亚基基因每个时期都在表达。造成表达量差异的具体原因是否与猜测想符合,还需要进一步研究证实。
相关性分析结果表明,AGPase小亚基基因的表达量与百合淀粉含量及酶活性都表现出正相关,说明小亚基基因是影响AGPase活性及淀粉合成的关键因子。此外,叶片的酶活性也可以直接影响鳞片淀粉含量,这说明鳞茎作为库器官,其贮藏的淀粉除了自身合成外,还有很重要的一部分来自其他源器官。鳞片和叶片中AGPase基因之间的相关性呈现较大差异,这与玉米中同一AGPase基因不同部位,不同时间的表达差异性很大这一结果一致[25];与小麦中不同亚基基因存在组织特异性表达这一结果也一致[26],故可以推测百合AGPase不同亚基基因可能也存在组织特异性表达。
综上所述,本研究说明亚洲百合川百合和东方百合‘白佩琪’的AGPase基因序列,表达模式、AGPase酶活性、鳞片淀粉含量等除了小亚基基因表达模式存在差异外都很相似,故不同类型的百合在对AGPase进行研究时应可参考或直接使用一些其他百合中的相关结论。此外,AGPase大小亚基基因表达量差异及二者的相互作用等在百合中研究较少,值得进行深入研究以探明AGPase调控淀粉合成从而影响种球膨大的基因机理。另外,相关性分析的结果为鳞茎的繁育提供了可通过调节淀粉合成限速酶小亚基基因表达及调节其酶活性以促进百合鳞茎膨大的实践思路。
4 结 论
本研究通过对东方百合‘白佩琪’及亚洲百合川百合的AGPase基因的克隆及qPCR、淀粉含量及酶活性的测定得到这两类百合AGPase基因序列,表达量,不同时期淀粉含量及AGPase酶活性以及在两类百合中的异同。两类百合不同时期的淀粉含量及酶活性变化趋势相同,但同一发育时期不同类型百合的淀粉含量及酶活性存在差异。两类百合大小亚基基因的表达量在鳞茎不同时期的表达模式是相似的,但同一发育时期不同类型百合的表达量存在差异。AGPase小亚基基因的表达量与淀粉含量正相关。
