番茄环纹斑点病毒N和NSm基因的VIGS载体构建
2023-03-31赵立华文俊元邱润霜张仲凯赵明富
崔 玥, 赵立华, 陈 思, 文俊元, 邱润霜, 张仲凯, 赵明富
(1.云南农业大学植物保护学院,昆明 650201;2.云南省农业科学院生物技术与种质资源研究所,昆明 650205)
【研究意义】番茄环纹斑点病毒(Tomato zonate spot tospovirus,TZSV)属于布尼亚病毒目(Bunyaviridae)、番茄斑萎病毒科(Tospovirus)、正番茄斑萎病毒属(Orthotospovirus),是正番茄斑萎病毒属在云南省的优势种,主要通过蓟马传播[1]。近年来,TZSV在云南、贵州、广西及东南亚国家普遍流行发生,导致大量观赏植物和重要蔬菜品质下降、产量损失,对当地的农业生产造成严重威胁[2]。TZSV病毒为球形病毒粒子,主要在叶肉细胞的细胞质和内质网中分布[3]。与Orthotospovirus属的其他成员相似,TZSV基因组具有3条负单链RNA,分别命名为大(L)、中(M)和小(S)RNA。L RNA是负义链,编码RNA依赖的RNA聚合酶(RdRp),用于复制和转录。M RNA编码非结构蛋白NSm和病毒糖蛋白前体(Gn/Gc)。S RNA编码非结构蛋白NSs和核衣壳蛋白N。其中NSs蛋白具有RNA沉默抑制活性,N蛋白负责包裹病毒基因组RNA[4-5]。本研究通过构建N和NSm基因沉默载体为基因功能的研究提供材料,为田间病毒病的防控提供一定的理论基础。【前人研究进展】病毒诱导的基因沉默技术(Virus induced gene silencing,VIGS)是一种通过基因瞬时表达研究基因功能的方法。目前,烟草脆裂病毒(Tobacco rattle virus,TRV)诱导的基因沉默系统是从不同的RNA和DNA病毒中发现的几十个VIGS载体中具有宿主范围广、能够对整株植物进行沉默的优点而得到广泛应用[6]。TRV VIGS技术目前已应用于本氏烟(Nicotianabenthamiana)、大麻(CannabissativaL.)、落叶松[Larixgmelinii(Rupr.)Kuzen.]、小麦(TriticumaestivumL.)、大豆(Glycinemax)、辣椒(CapsicumannuumL.)等植物[7-11]。病毒诱导的基因沉默技术广泛应用于非生物胁迫、细胞信号传导和次生代谢产物的生物合成以及抗病毒等方面的研究。TRV诱导番茄LeCTR1基因沉默后,活性氧(ROS)含量显著下降,而AOS2、PR1、NPR1、和PR5等抗性相关基因表达量上升,进而提高了番茄对番茄卷叶病毒(Tomato leaf curl virus,ToLCV)的抗性[12]。沉默H2B和CoI1基因后,本氏烟中水杨酸(SA)和茉莉酸(JA)含量增加,导致马铃薯X病毒(Potato virus X,PVX)和番茄斑萎病毒(Tomato spotted wilt orthotospovirus,TSWV)的侵染受到抑制[13-14]。Macharia等[15]通过VIGS体系研究发现植物体的自噬作用与NbHYPK和ATG8基因有关,有助于防御TMV侵染。邱润霜等[16]将TSWVN基因插入TRV载体以进一步研究基因功能,但尚未有将TZSV基因插入VIGS载体的报道。【本研究切入点】VIGS是目前报道鉴定植物基因功能的重要技术手段,已有多种RNA病毒被成功开发成VIGS载体,但在TZSV上尚未见报道,通过构建的TZSV重组载体结构或许可用于研究TZSV基因的功能,在防治TZSV方面具有潜在的应用价值。【拟解决的关键问题】目前田间采用传统的化学药剂,物理和生物防治等方法控制和预防TZSV侵染,由于各种措施的弊端使TZSV的侵染仍严重威胁经济作物和观赏植物产量和质量。本研究将TZSVN和NSm基因构建到pTRV-pTV00的VIGS载体上,抑制基因和蛋白的表达,为田间防控TZSV提供了技术手段和试验材料。
1 材料与方法
1.1 试验材料
pTV00、pBINTRA和pTV00-PDS载体均由昆明植物研究所吴建强教授提供。TZSV YN-Chili分离株从中国云南省元谋县受感染的番茄植株中获取,并在本氏烟中繁毒[12]。K326和本氏烟在云南省农业科学院生物技术与种质资源研究所温室中栽培。根据NCBI数据库中发布的TZSVN和NSm基因序列(注册号: MG656995.1,NC_010490.1)设计引物(表1)。

表1 VIGS 和RT-qPCR扩增引物
1.2 试验方法
1.2.1 TZSV接种 采用摩擦接种法将TZSV接种到K326和本氏烟植株上。将新鲜毒源加入PBS缓冲液(100 mg/mL)进行研磨,每株3个叶片接种TZSV 1 mL。接种TZSV 10 min后,用ddH2O冲洗植株叶片。用PBS缓冲液接种的植株作为对照。接种5 d后,当症状出现时采集样品,每个处理设置5个重复。
1.2.2 RNA提取和RT-PCR 感病植株叶片总RNA按照RNA提取试剂盒(Roche,America)说明书提取,cDNA由cDNA第一链合成试剂盒(全式金,中国)逆转录获得,目的片段则Q5高保真DNA聚合酶(High-fidelity DNA Polymerase,NEB,England)进行PCR得到。PCR体系由1 μL DNA、10 μL Q5 反应缓冲液、1 μL 2.5 mmol/L dNTPs、2.5 μL 正向引物、2.5 μL 反向引物、0.5 μL Q5 DNA聚合酶及32.5 μL ddH2O组成。PCR反应条件为98 ℃ 40 s;98 ℃ 10 s,55 ℃ 20 s,72 ℃ 30 s,共35个循环;72 ℃终延伸2 min。扩增产物用1%的凝胶电泳30 min后,紫外凝胶成像分析系统观察。
1.2.3 VIGS载体构建 目的DNA纯化后,连接到pEASY-Blunt-Zero载体(全式金,北京)上送往广州华大基因有限公司进行测序,以确保碱基序列不发生突变。将含N和NSm基因序列的pEASY-Blunt-Zero载体和pTRV-pTV00载体用BamHI和HindIII限制性内切酶进行双酶切,并将酶切产物进行纯化回收,纯化后产物与pTRV-pTV00载体使用T4 DNA连接酶连接。转化大肠杆菌DH5α感受态细胞,筛选出阳性克隆送往广州华大基因技术有限公司测序。用序列正确的重组质粒电击转化农杆菌感受态细胞。
1.2.4 农杆菌注射 通过电击转化法将重组载体pTRV-PTV00-N和pTRV-PTV00-NSm转到GV3101农杆菌中。将等体积已转入农杆菌的pTRV-pBINTRA重悬菌液分别与pTRV-PTV00-N和pTRV-PTV00-NSm的重悬菌液充分混合,制成注射菌液,对本氏烟和K326进行注射侵染。
使用1 mL注射器,每株注射3个叶片。PDS阳性对照叶片在接种后约10~14 d发白,接种TZSV。阳性对照为注射空载后pTRV-pTV00接种TZSV和只接种TZSV的植株。接种后约5 d,采集样品,以健康植株作为空白对照。
1.2.5 RT-qPCR 将N和NSm基因序列构建到pEASY-T1 Simple载体上,构建成重组质粒。连续10倍梯度稀释获得(10-1~10-6)质粒,作为标准品构建标准曲线。反应体系:cDNA 1 μL,正向引物2.5 μL,反向引物2.5 μL,FastStart Universal SYBR Green Master(Rox)10 μL,ddH2O补足到10 μL。反应条件为95 ℃ 10 min;95 ℃ 15 s,55 ℃ 20 s,72 ℃ 30 s,循环40次。
沉默效率(%)=(C-T)/C×100
式中,C为接种TZSV的叶片中N和NSm基因的平均拷贝数;T为N和NSm基因在接种沉默载体叶片中的平均拷贝数。
1.2.6 ID-ELISA 取叶片0.2 g在500 μL PBS缓冲液中研碎成汁液。将100 μL粗提物加入酶联免疫吸附板孔中,37 ℃ 孵育2 h,用加0.05% TWeen-20的PBS制成PBST缓冲液洗涤。用抗体缓冲液(含2%牛血清蛋白的PBS缓冲液)稀释TZSV N和NSm多克隆抗体。随后,每孔加入100 μL ap标记的山羊抗兔IgG(Sigma,美国)。将底物显色剂在底物缓冲液中溶于对硝基苯基磷酸二钠(Sigma-Aldrich)至最终浓度为1 mg/mL。用ELx808酶标仪(Bio-Tek,USA)测定405 nm处的吸光度。以健康叶片为阴性对照,PBS缓冲液为空白对照,接种TZSV叶片为阳性对照。
2 结果与分析
2.1 N和NSm基因的VIGS载体
通过RT-PCR获得目的片段,结果显示N和NSm目的基因的片段长度分别为208、186 bp,与预期结果一致(图1A~B)。将含有N和NSm基因序列分别连接到pTRV-pTV00载体上,通过双酶切进行验证,从图1C~D可以看出,双酶切后N和NSm目的基因片段长度符合要求,说明重组pTRV-pTV00-N、pTRV-pTV00-NSm病毒载体成功构建,可用于后续试验。
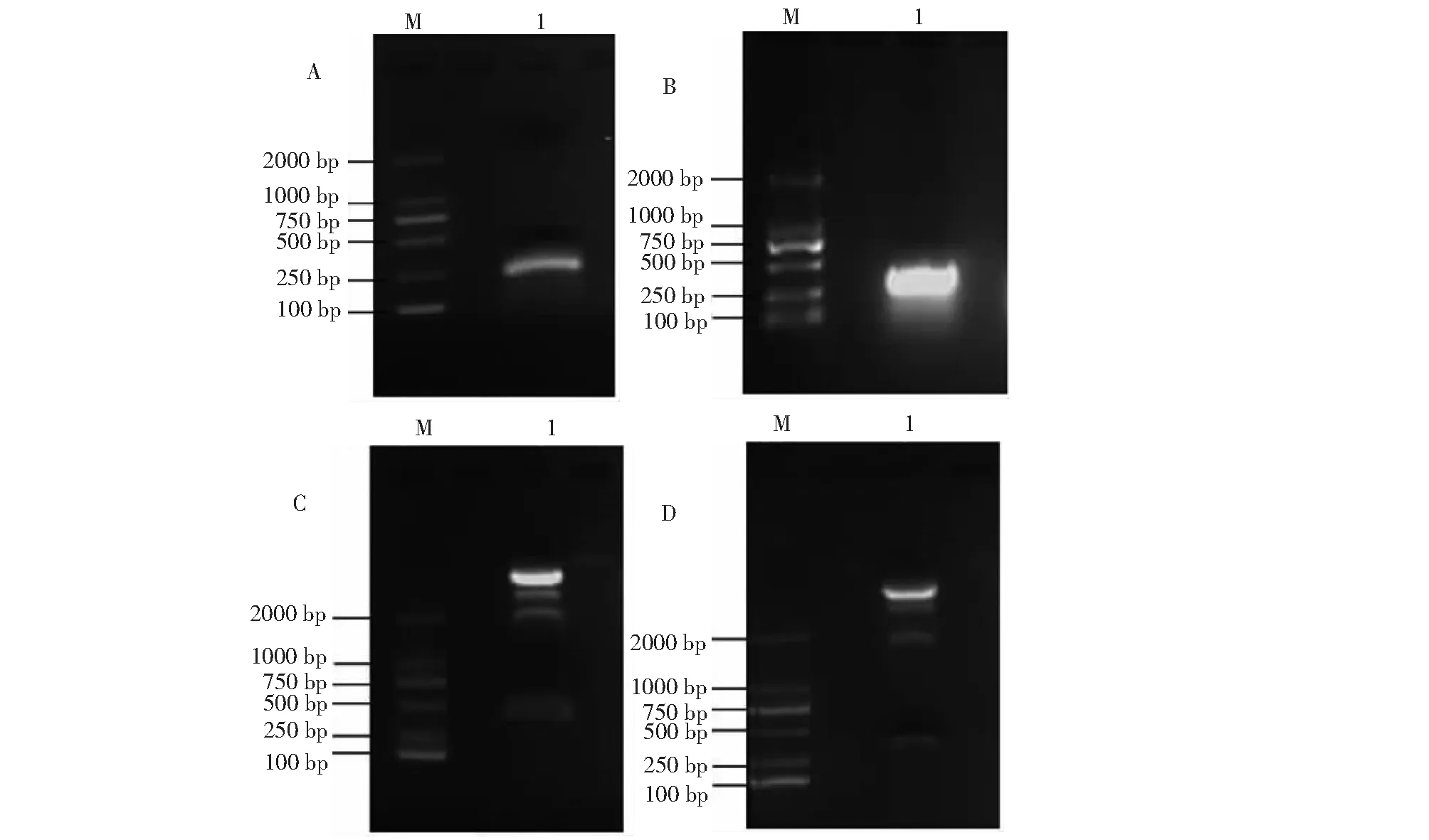
A: PCR扩增N 基因序列; B: PCR扩增NSm基因序列; C: 酶切验证构建的N基因VIGS载体; D:酶切验证构建的NSm基因VIGS载体; M: DNA Marker 2000。
2.2 N和NSm基因的RT-qPCR标准曲线建立
含N和NSm基因的重组质粒浓度分别为230.39、147.19 ng/μL,OD260/280值分别为1.82、1.91,质粒质量符合RT-qPCR要求。通过软件自动分析得到TZSVN和NSm基因RT-qPCR的扩增曲线和标准曲线。其中,N和NSm基因标准曲线方程分别为Y=-3.333X+33.66、Y=-3.815X+36.07;扩增效率分别为95.01%、96.31%;相关系数分别为0.993、0.991。结果表明,重组质粒可以作为标准品进行RT-qPCR检测。
2.3 RT-qPCR检测TZSV沉默效率
接种TZSV 5 d后通过症状观察发现,未注射pTRV-pTV00-N、pTRV-pTV00-NSm重组载体而只接种TZSV的阳性对照植株心叶表现出严重皱缩症状(图2-C),注射含有pTRV-pTV00-N、pTRV-pTV00-NSm重组载体后接种TZSV的处理植株叶片未表现病毒侵染症状(图2A~B),初步说明载体构建成功且对病毒侵染具有防御作用。为进一步确定N、NSm基因的沉默效率,采用RT-qPCR技术来检测TZSVN和NSm基因的表达量。RT-qPCR分析表明,与只接种TZSV未注射任何载体的阳性对照相比,N和NSm基因在本式烟和栽培烟K326体内的表达量均显著降低,TZSVN和NSm基因在本氏烟中的沉默效率分别为99.75%、90.07%;N和NSm基因在栽培烟K326中的沉默效率为94.31%、90.32%(图3)。综上所述,构建的 pTRV-pTV00-N 和pTRV-pTV00-NSm载体可用于后续基因功能和抗病性的研究,2种烟草类型均可作为试验材料。
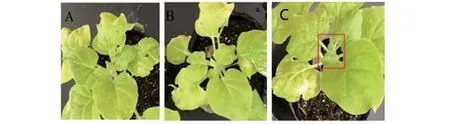
A: 先注射TRV-PTV00-N载体,后接种TZSV植株; B: 注射pTRV-PTV00-NSm载体,后接种TZSV植株; C:只接种TZSV未注射其它载体的植株。

A.本氏烟中N和NSm基因沉默后接种TSZV 5 d后的沉默效率;B.K326中N和NSm基因沉默后接种TSZV 5 d后的沉默效率;VIGS-N:注射pTRV-pTV00-N沉默载体后接种TZSV; VIGS-NSm: 注射pTRV-pTV00-NSm 沉默载体后接种TZSV; pTV00-TZSV: 注射pTRV-pTV00空载体后接种TZSV; TZSV:只接种TZSV未注射其它载体;柱形图上带有不同*表示不同处理与对照差异达到显著水平(P<0.05)。
2.4 ID-ELISA检测N和NSm蛋白表达量
为进一步分析N和NSm基因沉默后对N和NSm蛋白表达量的影响以及对TZSV侵染的抑制情况,采用ID-ELISA法测定N和NSm的蛋白含量。N蛋白和NSm蛋白在本氏烟和栽培烟K326 两种寄主内第7天的表达量最高。N蛋白在本氏烟和K326 两种寄主内处理(先注射pTRV-pTV00-N,后接种TZSV)与对照(只接种TZSV)相比降低,且N蛋白在第5和7天显著降低(表2);NSm蛋白的表达量在本氏烟和K326 两种寄主内处理(先注射pTRV-pTV00-NSm,后接种TZSV)与对照(只接种TZSV)相比在第3、5、7和9天均显著降低(表3)。结果表明,TZSV的N和NSm蛋白在本氏烟和K326中的表达也同样受到抑制,进而抑制TZSV侵染。

表2 ID-ELISA检测N蛋白表达量

表3 ID-ELISA检测NSm蛋白表达量
3 讨 论
植物病毒引起的病害导致农产品质量下降、产量减少,严重危害了农业的产量安全和质量安全。2008年,TZSV在云南省烟草和其他寄主中被鉴定为Orthotospovirus的新种[1]。TZSV寄主范围广泛,可侵染7科20多种植物,包括重要经济作物和杂草[17-18]。TZSV对中国西南地区的番茄、烟草等农业生产造成了严重威胁。本研究通过构建N和NSm基因的VIGS载体为研究该病毒的致病机制,以及田间TZSV的防治提供一定的理论和实用价值。
本研究利用TRV载体构建N和NSm基因的VIGS载体,将pTRV-pTV00-N、pTRV-pTV00-NSm注射到植物体内,当PDS基因沉默的植株叶片呈白色时接种TZSV,使用RT-qPCR技术检测N和NSm基因表达量,结果发现N和NSm基因沉默效率均超过90%。ID-ELISA结果显示,N和NSm蛋白含量均显著下降,其中NSm蛋白含量连续9 d显著下降。TRV诱导的VIGS体系对植物伤害较小,因此再次接种TZSV对寄主植物不会造成影响。当接种TZSV植株出现症状时立即采样检测,可测得高效的沉默效率。同时,温度对植株的沉默表型也有影响[19],在此试验中,严格控制温度使得沉默效率较高且持续时间较长。
TRV作为VIGS载体,被广泛用于研究病毒与宿主的相互作用以及植物基因的功能研究[20]。在本研究中,以TRV为载体的VIGS系统成功沉默TZSVN和NSm基因。TRV寄主范围广泛,但物种和品种之间对TRV的敏感性存在显著差异[21-22]。例如,对21个非洲菊品种进行TRV敏感性试验,只有5个品种在新发育的叶片上表现出光漂白的PDS沉默症状[23]。在本研究中,本氏烟叶片被漂白,而K326烟草叶片未发生表型变化,表明TRV VIGS载体对不同宿主品种表现出不同的敏感性。VIGS方法可用于反向遗传学研究,确定未知基因的功能,有助于阐明未知的生物合成途径,缩小现有基因组数据与重要药用植物或观赏植物生物化学信息之间的差距。因此,病毒诱导的基因沉默技术可以得到更广泛的应用。
目前田间采用传统的化学药剂,物理和生物防治等方法控制和预防TZSV侵染,由于各种措施的弊端使TZSV的侵染仍严重威胁经济作物和观赏植物产量和质量。生物源农药由于其对环境影响较小得到了广泛的应用,如宁南霉素、几丁寡糖壳寡糖,圆叶肿柄菊素 A等[24-26]。近年来,VIGS技术也常被用于防御病毒侵染,有研究发现,将外源植物病毒dsRNA引入寄主中,可以干扰苜蓿花叶病毒(AMV)、辣椒轻斑驳病毒(PMMoV)和烟草蚀纹病毒(TEV)的复制,预防其对烟草的侵染[27]。本研究将TZSVN和NSm基因构建到pTRV-pTV00的VIGS载体上,抑制基因和蛋白的表达,为田间防控TZSV提供了技术手段和试验材料。
4 结 论
本研究以TRV为载体构建了TZSVN和NSm基因的沉默系统并成功应用于本氏烟和K326。通过RT-qPCR检测发现沉默效率均高于90%。ID-ELISA检测结果显示,N和NSm蛋白含量均下降,其中NSm蛋白含量连续9 d显著下降。本结果为研究TZSV的致病机理奠定了重要的材料和技术基础,为TZSV的田间抗病育种和防治提供了理论依据。
