胃黄斑瘤与胃泌素17、胃蛋白酶原及幽门螺杆菌的关系
2023-03-30陈敏孙海兵费梦雪
陈敏 孙海兵 费梦雪
近年来,由于胃镜检查的普及,胃黄斑瘤的检出率逐年升高,且由于胃黄斑瘤的临床表现缺乏特异性,胃镜为胃黄斑瘤的主要发现途径[1]。胃黄斑瘤虽然能够在无治疗干预的情况下缩小或消失,但近几年研究发现,胃黄斑瘤与胃癌具有一定的相关性,该类患者患胃癌的患病率显著高于无胃黄斑瘤的患者。因此,寻找除胃镜外与胃黄斑瘤相关的血清指标能够有助于胃黄斑瘤的早发现以及早治疗。胃黄斑瘤的发病机制包括幽门螺杆菌(Helicobacter pylori,Hp)感染、胃黏膜的慢性炎症以及老化、脂质代谢异常、胆汁反流等。胃蛋白酶原(pepsinogen,PG)以及胃泌素-17(gastrin-17,G-17)均为胃部黏膜分泌的血清学指标,且郭玉峰等[2]研究表示胃蛋白酶原Ⅰ高水平为胃癌癌前病变的危险因素,且PGⅡ以及胃泌素-17 低表达均为胃癌癌前病变的保护因素。因此,本研究通过比较胃黄斑瘤患者以及健康体检者的G-17、PGⅠ、PGⅡ以及Hp 抗体阳性率,探讨G-17、PGⅠ、PGⅡ、以及Hp 与胃黄斑瘤的关系。
1 资料与方法
1.1 一般资料
选取2017年2月至2022年3月于合肥市第二人民医院消化内科确诊为胃黄斑瘤的患者75 例作为观察组,并选取同期进行胃镜检查并获得正常结果的健康体检者81 名作为对照组。观察组男34例,女41 例,平均(63.10±10.38)岁;对照组男52 名,女39 名,平均(61.5±9.38)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①符合胃黄斑瘤的相关诊断标准[3];②无原发性血脂代谢异常疾病;③临床资料完整;④患者及其家属均签署知情同意书。排除标准:①进行过抗Hp感染治疗;②入组2 周内服用免疫抑制剂、非甾体类、糖皮质激素;③合并其他恶性肿瘤;④合并遗传性息肉病。本研究通过医院伦理委员会批注。
1.2 方法
抽取研究对象清晨空腹静脉血5 mL,在2 000 r/min,离心半径8 cm 的条件下离心5 min,取上层清液进行检测。G-17、PG-1、PG-2 采用酶联免疫吸附法检测,试剂盒由必欧翰生物技术(合肥)有限公司提供[4]。根据国家消化病研究中心提出的界限值,PGⅠ≤70 ng/mL 为PGⅠ阳性,PGⅡ>15 ng/mL 为PGⅡ阳性[5]。血清Hp Ig G 抗体采用酶联免疫吸附(ELISA)法检测,试剂盒选用上海行健生物科技有限公司产品,Hp 阳性判断:抗体滴度≥20 k U/L[6]。
1.3 统计学方法
采用SPSS 21.0 软件进行统计分析,计量资料以()表示,采用t检验;计数资料以n(%)表示,采用χ2检验;采用多元Logistic 回归分析分析影响胃黄斑瘤的危险因素,并采用ROC 曲线估计G17、PGⅠ、PGⅠ/PGⅡ、Hp 对胃黄斑瘤的诊断价值,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者G17、PGⅠ、PGⅡ、PGⅠ/PGⅡ水平的比较
观察组的G-17、PGⅡ水平显著高于对照组,且PGⅠ、PGⅠ/PGⅡ水平显著低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者G17、PGⅠ、PGⅡ、PGⅠ/PGⅡ水平的比较(±s)Table 1 Comparison of G17,PGⅠand PGⅡlevel between the two groups(±s)
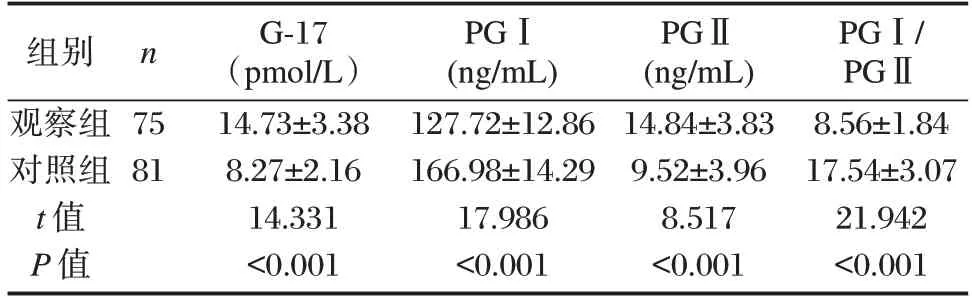
表1 两组患者G17、PGⅠ、PGⅡ、PGⅠ/PGⅡ水平的比较(±s)Table 1 Comparison of G17,PGⅠand PGⅡlevel between the two groups(±s)
组别观察组对照组t 值P 值n 75 81 G-17(pmol/L)14.73±3.38 8.27±2.16 14.331<0.001 PGⅠ(ng/mL)127.72±12.86 166.98±14.29 17.986<0.001 PGⅡ(ng/mL)14.84±3.83 9.52±3.96 8.517<0.001 PGⅠ/PGⅡ8.56±1.84 17.54±3.07 21.942<0.001
2.2 两组患者Hp 抗体阳性率的比较
观察组的Hp 阳性率显著高于对照组,差异具有统计学意义(P<0.05)。见表2。

表2 两组患者Hp 阳性率的比较[n(%)]Table 2 Comparison of Hp positive rate between two groups[n(%)]
2.3 影响胃黄斑瘤的多因素Logistic 回归分析
以胃黄斑瘤的发生作为因变量(有=1,无=2),以G-17、PGⅠ、PGⅡ水平、Hp(阳性=1,阴性=2)作为自变量进行多因素Logistic 回归分析,结果显示,G-17、PGⅠ、PGⅡ水平、Hp 为婴幼儿肺炎病情的独立影响因素(P<0.05)。见表3。

表3 影响胃黄斑瘤的多因素Logistic 回归分析Table 3 Multivariate Logistic Regression Analysis of Factors Affecting Gastric Macula
2.4 G-17、PGⅠ、PGⅠ/PGⅡ、Hp 单独检测诊断胃黄斑瘤的价值
绘制G-17、PGⅠ、PGⅠ/PGⅡ、Hp 对诊断胃黄斑瘤的ROC 曲线,ROC 曲线显示G-17、PGⅠ、PGⅠ/PGⅡ、Hp 单独检测诊断胃黄斑瘤对应的AUC 为0.942、0.980、0.938、0.709,其对应的约登系数为0.428、0.478、0.435、0.139。见表4、图1。

图1 G-17、PGⅠ、PGⅠ/PGⅡ、Hp 阳性率诊断胃黄斑瘤的ROC 曲线Figure 1 ROC curve of G-17,PG Ⅰ,PG Ⅰ/PG Ⅱ,Hp positive rate in diagnosis of gastric macular tumor

表4 G-17、PGⅠ、PGⅠ/PGⅡ、Hp 阳性率对胃黄斑瘤的诊断价值Table 4 Diagnostic value of G-17,PGⅠ,PG Ⅰ/PGⅡ,Hp positive rates for gastric macular tumor
3 讨论
胃黄斑瘤又称为脂质岛、胃黄色瘤,其主要的确诊途径为上消化道内镜,是一种较为罕见的良性病变,大小约在1~10 mm 之间。胃黄斑瘤的可能病因包括有Hp感染、胃黏膜慢性炎症或者是老化、胆汁反流以及脂质代谢异常等[1]。其中Hp感染会导致胃粘膜内的氧自由基的含量大幅度的增加,从而使低密度脂蛋白过度氧化最终形成胃黄斑瘤;长期慢性炎症以及细胞老化同样会导致胃黏膜细胞坏死破裂,使得大量的脂质流出,形成大量泡沫细胞,并在固有层大量聚集最终成为胃黄斑瘤;而胆汁反流会使胃粘膜运输脂质的能力下降,使得脂质堆积进而导致泡沫细胞的积累,最终导致胃黄斑瘤的发生[7-8]。因此,可以得出胃黄斑瘤的发生主要与体内脂质含量异常有关。胃黄斑瘤虽然是胃部的良性病变,大部分在未加以干预的情况下可以恢复,但其与胃癌的发生具有密切关系,有研究[9]表明,患有胃黄斑瘤的患者胃癌的患病率高于未患有胃黄斑瘤的患者。此外,Sayar等[10]研究表明胃黄斑瘤患者的萎缩性胃炎、肠上皮化生、异型增生以及胃癌的发生率均高于健康人群。据此可以得出,胃黄斑瘤可以作为癌前病变以及早期胃癌的预测指标。
G-17 主要是由胃窦G 细胞分泌而成的,能够促进胃窦的分泌功能并且增强胃肠道的运动,在胃部出现病变后,其水平会出现异常的现象[11]。PG 主要有两种亚型,分为Ⅰ和Ⅱ型,是临床检测胃部疾病主要的生物标志物,其水平能够反映胃黏膜的功能障碍以及部分病变。本研究通过对比分析G-17、PGⅠ、PGⅡ在健康人群以及胃黄斑瘤人群的表达水平发现,胃黄斑瘤患者的血清G-17、PGⅡ高于健康人群,而血清PGⅠ、PGⅠ/PGⅡ水平低于健康人群,且血清G-17、PGⅡ高水平以及PGⅠ低表达水平是胃黄斑瘤的独立危险因素,提示G-17、PGⅠ、PGⅡ的表达水平在胃黄斑瘤患者以及健康人群中具有差异。分析其原因为:胃黄斑瘤患者中有58.5%的病变发生在胃窦部,导致胃窦黏膜萎缩,使得胃泌素细胞数减少,使之分泌的G-17 减少,而G-17 可以直接进入血液,因此导致血清G-17 水平减少,使得其刺激胃酸分泌的作用减弱,使得其对胃泌素细胞的抑制作用减弱,最终表现为G-17 分泌增多[12]。而血清PGⅠ能够反映胃粘膜腺体的萎缩程度,而PGⅡ则与胃底腺萎缩、肠上皮化生以及恶性肿瘤有关[13]。有研究[14]表示,胃黄斑瘤与腺体萎缩、肠化生以及糜烂具有密切的关系,且萎缩是胃黄斑瘤的危险因素,因此,胃黄斑瘤患者的PGⅠ和PGⅡ表达水平会发生相关变化。Hp感染具有23.66%的感染率,能够促进胃黏膜细胞的活跃增生,提高DNA 突变的风险,是引起慢性胃炎、消化性溃疡以及胃癌的主要因素[15-16]。本研究结果显示,胃黄斑瘤患者的Hp阳性率明显高于健康人群,且Hp 阳性为胃黄斑瘤的独立危险因素,提示Hp 阳性率与胃黄斑瘤的发生具有一定的相关性。
此外,刘旭初等[17]研究发现PGⅠ以及PGⅠ/PGⅡ水平在胃黏膜发生病变时会发生明显的改变,对于癌前良性病变以及早期胃癌均具有较高的诊断价值。因此,本研究通过ROC 曲线分析G-17、PGⅠ、PGⅠ/PGⅡ、Hp 单独检测诊断胃黄斑瘤对应的AUC 为0.942、0.980、0.938、0.709,对应的约登系数为0.428、0.478、0.435、0.139,对胃黄斑瘤具有较好的诊断价值。
综上所述,G-17、PGⅠ、PGⅡ水平以及Hp 阳性率与胃黄斑瘤的发生具有密切关系,诊断胃黄斑瘤的价值较高,能够为临床诊断提供参考价值。
