乙肝相关性肝细胞癌中HBx、miR-122表达及临床意义
2023-03-30陈东海洪玫张依琳周红梅
陈东海 洪玫 张依琳 周红梅
原发性肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化系统恶性肿瘤,恶性程度高、5年生存率低[1-2]。我国是全球范围内慢性乙型病毒性肝炎发病的大国,乙型肝炎病毒(hepatitis B virus,HBV)慢性感染是我国HCC 的主要原因。HBV DNA X 基因编码的乙肝病毒X 蛋白(Hepatitis B virus X protein,HBx)在HBV 感染导致乙肝相关HCC 的发生发展中起重要作用。HBx 具有促进癌细胞增殖、迁移、侵袭及细胞周期进展、新生血管增多等生物学作用[3-4],国内一项细胞实验证实HBx 通过抑制微小RNA(microRNA,miR)-122 表达的方式发挥促癌作用[5]。为了深入认识HBx 调控miR-122 在乙肝相关HCC 发生发展中的作用,本研究将通过临床样本的检测和分析观察乙肝相关HCC 中HBx、miR-122 表达的相关性及临床意义。
1 资料与方法
1.1 临床资料
选择2018年3月至2020年4月期间在焦作煤业集团有限责任公司中央医院接受手术切除的75例乙肝相关HCC 患者作为研究对象,纳入标准:①有HBV 感染史;②参照《原发性肝癌规范化病理诊断指南(2015年版)》[6],术后病理诊断为HCC;③临床资料完整;④留取HCC 组织和距离肿瘤病灶2 cm 以上的癌旁组织,分别制备蜡块及液氮冷冻保存。排除标准:①未接受过抗病毒、抗肿瘤治疗;②既往有其他恶性肿瘤病史。本研究取得医院伦理委员会批准,取得入组患者的知情同意。
1.2 试剂与仪器
HBx 特异性一抗为SantaCruz 公司,EliVision Super 免疫组化试剂盒为福建迈新生物科技公司,总RNA 提取试剂盒、MMLV 反转录试剂盒、SYBR Green 荧光定量PCR 试剂盒为北京索莱宝生物科技公司。
1.3 HBx 表达的免疫组化检测
取石蜡包埋的HCC 组织和癌旁组织,制作病理切片后进行免疫组化检测,脱蜡、抗原修复、加入HBx 一抗(1∶200 稀释)孵育、PBS 液洗3 遍、加入二抗(1∶200 稀释)孵育、PBS 液清洗3 遍、加入ABC 复合物及DAB 显色剂、复染、透明、封固。在显微镜下观察染色情况,参照《原发性肝癌规范化病理诊断指南(2015年版)》[6],根据染色强度进行评分:无染色为0 分、淡黄色为1 分、棕黄色为2分、棕褐色为3 分;根据阳性染色细胞百分率进行评分:0%~5%为0 分、5%~25%为1 分、26%~50%为2 分、51%~75%为3 分、>75%为4 分。两项评分相乘,乘积≤4 分为阴性、>4 分为阳性。
1.4 miR-122 及下游cyclinG1、XIAP、β-catenin 表达的荧光定量PCR 检测
取液氮冷冻的HCC 组织和癌旁组织,采用总RNA 提取试剂盒(北京诺为生物技术公司,货号QER090150)提取组织中的总RNA,采用MMLV反转录试剂盒(北京诺为生物技术公司,货号MM070150)将细胞中提取得到的RNA 反转录为cDNA,采用SYBR Green 荧光定量PCR 预混液(北京诺为生物技术公司,货号33033-1)对cDNA 中的miR-122、cyclinG1、XIAP、β-catenin 进行PCR 检测,PCR 的体系为:cDNA 1 μL、MMLV 反应混合液10 μL、上下游引物各0.6 μL,去离子水补足至20 μL;PCR 的反应程序为:95℃预变性3 min,95℃15 s、特异性退火温度25 s、72℃30 s,共进行40 个循环的PCR 反应,反应结束后得到得到循环曲线及循环阈值(Cycle threshold,Ct),以β-actin 为内参、按照公式2-ΔΔCt计算miR-122、cyclinG1、XIAP、β-catenin的mRNA 表达水平。
1.5 预后的随访
采用电话回访的方式进行预后随访,随访截止时间为术后24 个月,随访内容为发生复发、转移、死亡,从手术指复发或转移为无病生存(disease free survival,DFS),从手术至死亡为总生存(overall survival,OS)。
1.6 统计学后处理
采用SPSS 22.0 软件进行统计学处理,计数资料用n(%)表示,用卡方检验;计量资料采用()描述,行t检验。相关性分析采用Pearson 检验,DFS 和OS 采用K-M 曲线描述、采用log-rank 检验进行分析。P<0.05 为差异有统计学意义。
2 结果
2.1 HCC 组织与癌旁组织中HBx、miR-122 及下游cyclinG1、XIAP、β-catenin 的表达水平比较
HCC 组织中HBx 的阳性表达率及cyclinG1、XIAP、β-catenin的mRNA 表达水平高于癌旁组织,miR-122 的表达水平低于癌旁组织,差异有统计学意义(P<0.05)。见表1。
表1 HCC 组织与癌旁组织中HBx、miR-122、cyclinG1、XIAP、β-catenin 表达的比较[n(%),(±s)]Table 1 Comparison of HBx,miR-122,cyclinG1,XIAP,β-catenin expression between HCC tissue and adjacent tissues[n(%),(±s)]

表1 HCC 组织与癌旁组织中HBx、miR-122、cyclinG1、XIAP、β-catenin 表达的比较[n(%),(±s)]Table 1 Comparison of HBx,miR-122,cyclinG1,XIAP,β-catenin expression between HCC tissue and adjacent tissues[n(%),(±s)]
组织来源HCC 组织癌旁组织χ2/t 值P 值HBx(52/75)(22/75)24.004 0.000 miR-122 0.61±0.08 1.00±0.18 17.147 0.000 cyclinG1 1.75±0.34 1.00±0.21 16.253 0.000 XIAP 1.64±0.29 1.00±0.22 15.227 0.000 β-catenin 1.59±0.22 1.00±0.16 18.783 0.000
2.2 HBx 不同表达的HCC 组织中miR-122、cyclinG1、XIAP、β-catenin 表达水平的比较
HBx 阳性表达的HCC 组织中miR-122 的表达水平低于HBx 阴性表达的HCC 组织,cyclinG1、XIAP、β-catenin的mRNA 表达水平高于HBx 阴性表达的HCC 组织,差异有统计学意义(P<0.05)。见表2。
表2 HBx 不同表达的HCC 组织中miR-122、cyclinG1、XIAP、β-catenin 表达水平的比较(±s)Table 2 Comparison of miR-122,cyclinG1,XIAP,β-catenin expression between HCC tissue with different HBx expression(±s)
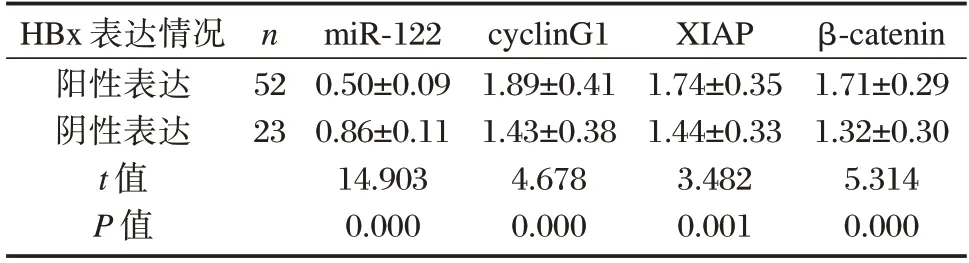
表2 HBx 不同表达的HCC 组织中miR-122、cyclinG1、XIAP、β-catenin 表达水平的比较(±s)Table 2 Comparison of miR-122,cyclinG1,XIAP,β-catenin expression between HCC tissue with different HBx expression(±s)
HBx 表达情况阳性表达阴性表达t 值P 值n 52 23 miR-122 0.50±0.09 0.86±0.11 14.903 0.000 cyclinG1 1.89±0.41 1.43±0.38 4.678 0.000 XIAP 1.74±0.35 1.44±0.33 3.482 0.001 β-catenin 1.71±0.29 1.32±0.30 5.314 0.000
2.3 HCC 组织中miR-122 表达水平与cyclinG1、XIAP、β-catenin 表达水平的相关性
HCC 组织中miR-122 的表达水平与cyclinG1(r=-0.361)、XIAP(r=-0.412)、β-catenin(r=-0.391)的mRNA 表达水平呈负相关(P<0.05)。
2.4 不同临床病理特征HCC 组织中HBx、miR-122 表达水平的比较
不同性别、年龄、肿瘤数量的HCC 组织中HBx、miR-122 表达水平的比较,差异无统计学意义(P>0.05)。临床分期Ⅲ~Ⅳ期、合并脉管浸润的HCC 组织中HBx 的阳性表达率高于临床分期Ⅰ~Ⅱ期、未合并脉管浸润的HCC 组织,miR-122 的表达水平低于临床分期Ⅰ~Ⅱ期、未合并脉管浸润的HCC 组织,差异有统计学意义(P<0.05)。见表3。
表3 不同临床病理特征HCC 组织中HBx、miR-122 表达水平的比较[n(%),(±s)]Table 3 Comparison of HBx,miR-122 expression among HCC tissues with different clinicopathological features[n(%),(±s)]
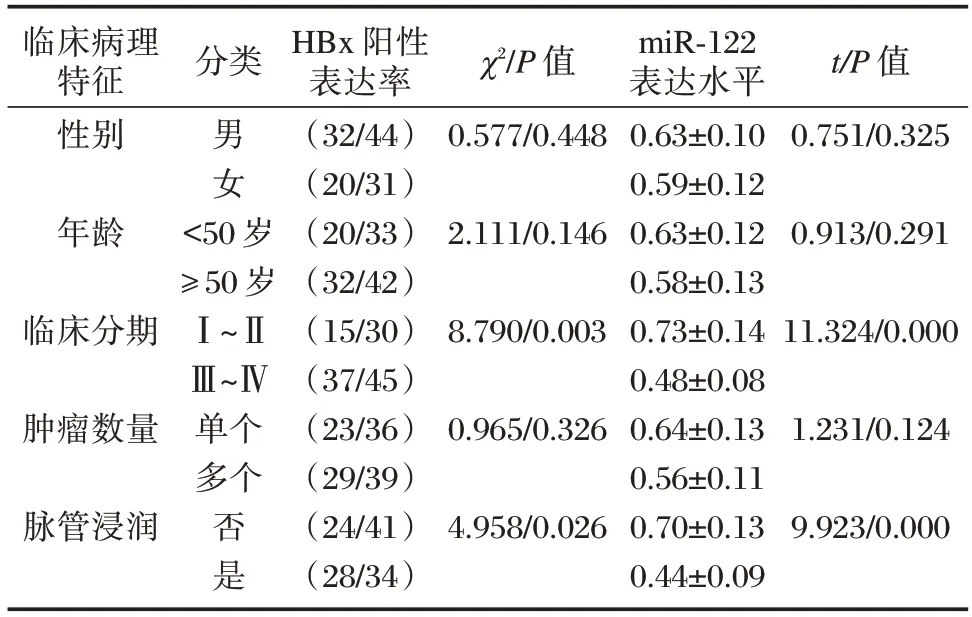
表3 不同临床病理特征HCC 组织中HBx、miR-122 表达水平的比较[n(%),(±s)]Table 3 Comparison of HBx,miR-122 expression among HCC tissues with different clinicopathological features[n(%),(±s)]
临床病理特征性别年龄临床分期肿瘤数量脉管浸润分类男女<50 岁≥50 岁Ⅰ~ⅡⅢ~Ⅳ单个多个否是HBx 阳性表达率(32/44)(20/31)(20/33)(32/42)(15/30)(37/45)(23/36)(29/39)(24/41)(28/34)χ2/P 值0.577/0.448 2.111/0.146 8.790/0.003 0.965/0.326 4.958/0.026 miR-122表达水平0.63±0.10 0.59±0.12 0.63±0.12 0.58±0.13 0.73±0.14 0.48±0.08 0.64±0.13 0.56±0.11 0.70±0.13 0.44±0.09 t/P 值0.751/0.325 0.913/0.291 11.324/0.000 1.231/0.124 9.923/0.000
2.5 不同Hbx 及miR-122 表达的HCC 患者DFS与OS 比较
经log rank 检验,HBx 阳性表达、miR-122 表达<中位数的HCC 患者累积DFS 率、累积OS 率均低于HBx 阴性表达、miR-122 表达≥中位数的HCC患者(P<0.05)。见图1。

图1 不同miR-122、Hbx 表达的HCC 患者DFS 与OS 比较Figure 1 Comparison of DFS and OS in HCC patients with different miR-122 and HBx expression
3 讨论
乙肝相关HCC 在HBV 慢性感染的基础上发展而来,是我国HCC 的主要原因[7]。HBx 是HBV基因X 区编码的蛋白质,被认为是一种“病毒癌蛋白”,在HBV 慢性感染导致肝细胞恶变中起到促进作用。已有国内外相关的细胞实验证实过表达HBx 对HCC 细胞的多种恶性生物学行为均具有促进作用[3-5]。本研究及既往其他学者的临床研究[8]均证实乙肝相关HCC 中HBx 的表达水平明显增加。
本研究在证实乙肝相关HCC 中HBx 阳性表达率增加的基础上进一步对HBx 下游的调控分子进行了探索。HBV 感染宿主细胞后表达产生HBx,HBx 能够通过下游不同的生物学途径改变宿主细胞中癌细胞的表达,最终实现促癌的生物学作用。近些年关于HBx 的基础研究认为表观遗传学机制是其发挥基因表达调控作用的重要机制之一,HBx 通过调控多种miRs 表达的方式在转录后水平调节癌基因表达[9]。一项细胞实验证实,具有抑癌作用的miR-122 受到HBx 的调控,过表达HBx 显著抑制HCC 细胞中miR-122 的表达[5]。本研究的临床样本检测结果显示HCC 组织中miR-122 的表达水平降低且HBx 阳性表达使HCC 组织中miR-122的表达进一步降低。此外,随着HCC 的临床分期增加以及发生脉管浸润,HBx 的阳性率增加、mR-122 的表达降低。以上结果提示乙肝相关HCC 中HBx 表达增加可能抑制下游miR-122 的表达、削弱miR-122 的抑癌作用,进而促进HCC 的病理进展。
MiR-122 是具有抑癌作用的miR,受其调控的靶基因包括cyclinG1、XIAP、β-catenin 等具有促进增殖、抑制凋亡、加速细胞周期等促癌作用的癌基因[10]。本研究的分析结果及既往其他学者的临床研究[11]均证实乙肝相关HCC 中三种癌基因cyclinG1、XIAP、β-catenin 的表达均明显增加。为了进一步验证乙肝相关HCC 中HBx 对miR-122 表达的影响,本研究对miR-122 下游三种癌基因的表达进行了分析,乙肝相关HCC 中HBx 阳性表达使HCC 组织中cyclinG1、XIAP、β-catenin 的表达增加,三种癌基因表达的变化与miR-122 表达的变化一致,也从miR-122 靶基因表达的角度进一步验证乙肝相关HCC 中HBx 表达增加对miR-122 表达的抑制作用。
HCC 的预后差,肿瘤临床分期增加、脉管浸润发生均与HCC 的复发、转移及死亡有关[12-13]。本研究对乙肝相关HCC 患者的DFS 和OS 预后进行了随访,分析预后与HBx、miR-122 表达的关系可知:HBx 阳性表达使患者的累积DFS 率和OS 率降低,而miR-122 表达增加使患者的累积DFS 率和OS 率增加,表明具有促癌作用的HBx 和具有抑癌作用的miR-122 影响HCC 预后,前者阳性表达导致预后不良、后者高表达使预后良好。
综上所述,乙肝相关HCC 中HBx 阳性表达与miR-122 表达降低具有相关性,两者共同促进HCC的病理进展及预后不良。
