基于流式细胞术和K-mer方法测定6种槭属植物基因组大小
2023-03-30马秋月王玉虓李倩中李淑顺颜坤元杜一鸣解志军李淑娴欧阳芳群鲁成代
马秋月,王玉虓,李倩中*,李淑顺,闻 婧,朱 璐,颜坤元,杜一鸣,解志军,李淑娴,欧阳芳群,鲁成代
(1.江苏省农业科学院休闲农业研究所,江苏 南京 210014;2.南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;3.襄阳市林业科学技术推广站,湖北 襄阳 441000;4.北京市植物园,北京 100093;5.天水市五小叶植物保护研究所,甘肃 天水 741000)
槭属(Acer)隶属于无患子目(Sapindales)槭树科(Aceraceae),全世界约有200多种,我国就有151种,是槭树分布种类最多的国家[1]。槭属植物树姿优美,叶形秀丽,不同季节叶色变异丰富,是园林绿化及景观营建中极具代表性的重要观赏树种,亦是优良的盆景树种。此外,部分槭属植物除具有观赏价值外,还具有油用、药用、材用、化工用等多种用途,如元宝枫(Acertruncatum)[2]、青楷槭(A.tegmentosum)[3]等。因此,该属植物在未来的食品、医疗及化工等领域开发应用前景广阔。
以往研究者们主要对槭属植物的栽培与育种领域进行相关研究[4-7],近年来该属植物的分子生物学特性如分子标记开发、叶色变异及代谢产物合成机制相关研究也逐渐受到关注[2,8-9]。基因组特征研究是植物基因资源开发和分子机制研究的前提,其中基因组大小测定是进行物种全基因组测序、遗传资源开发与利用等的基础[10-12]。关于不同种槭树基因组大小及特征研究的报道较少,严重阻碍了该属植物分子生物学研究。
植物基因组大小(又称DNAC值)是指一个物种单倍体核的DNA含量,一般用质量(pg)或核苷酸碱基对数目(Mb)来表示(1pg约978 Mb)[10-12]。基因组大小测定方法主要包括基于K-mer分析的基因组测序法[13]、流式细胞术[14]以及孚尔根微显影法[15],前两者是测定基因组大小的常用方法,其中基于K-mer分析的基因组测定法具有高通量测序、速度快、数据量大等优点[2],流式细胞术法具有操作简单、分辨率高、准确率高等优点[10,14,16-17]。
已知的槭属植物多为二倍体(2n=2x=26)[18],但不同种间具有不同大小的基因组。近年来,随着高通量测序技术的快速发展,测序成本大幅度降低,使得大量的非模式树种如银杏(Ginkgobiloba)[16]、簸箕柳(Salixsuchowensis)[19]、鹅掌楸(Liriodendronchinense)[20]等的全基因组测序工作得以开展。目前仅19种槭树科植物的基因组大小被收录于植物DNAC值数据库(https://cvalues.science.kew.org),平均大小为0.90 pg,其中最大的DNA 1C值为1.70 pg,最小的为0.4 pg。本研究采用流式细胞术和基于K-mer 分析的基因组Survey测序对槭属植物中的建始槭(A.henryi)、秀丽槭(A.elegantulum)、五小叶槭(A.pentaphyllum)、青楷槭、血皮槭(A.griseum)、三角枫(A.buergerianum)进行基因组大小测定,以期为该属植物的倍性研究、功能基因组学分析以及遗传改良等研究奠定基础。
1 材料与方法
1.1 试验材料
供试材料三角枫、秀丽槭、建始槭的嫩叶采自江苏省南京市溧水区江苏省农业科学院槭树良种基地(119°02′E,31°65′N),青楷槭嫩叶采自吉林省白山市二道区(128°08′E,42°27′N),五小叶槭嫩叶采自甘肃省天水市(104°10′E,34°55′N),血皮槭嫩叶采自中国林业科学研究院(116°24′E,40°00′N)。用于流式测定内标植物的玉米(Zeamays‘CE-777’)和大豆(Glycinemax‘Polanka’)由南京林业大学林木遗传与生物技术重点实验室提供。
1.2 流式细胞术试验检测方法
1.2.1 解离液的筛选与荧光染料的制备
以6种槭树和内标植物嫩叶为试材,分别将6种解离液WPB、GPB、Tris-MgCl2、LB01、Galbraith’s、Otto进行逐一测试。其中所用荧光染料碘化丙啶(PI)配制后(50 μg/mL)避光保存于4 ℃冰箱。
1.2.2 细胞核悬液制备与DNA特异性染色
细胞核悬液制备参照马秋月等[7]的方法:将待测样品植株分别称取新鲜幼嫩的叶片3份(每份约1 g)放置于培养皿,加入4 ℃预冷的1.5 mL 解离液,用刀片迅速切碎,将解离液经37 μm滤膜过滤至1.5 mL EP管中,冰上孵育5 min,1 000 r/min离心5 min后弃上清,再将150 μL预冷的解离液加入收集的沉淀细胞中,吸取250 μL涡旋混匀后的混合液,并加入0.5 μL预冷的PI荧光染料,混匀后置于4 ℃冰箱避光染色15 min后上机检测。对照样品玉米和大豆的细胞核悬液的制备方法同上。将对照样品与待测样品的细胞核悬液等体积混合。
1.2.3 流式细胞仪测定与基因组大小计算
测定前,将流式细胞仪(BD InfluxTM,USA)预热30 min,采用488 nm蓝光激发,收集670/30 FL2 通道的荧光;依据碘化丙啶(PI)嵌入量与细胞核DNA成正比关系,通过测定的荧光强度,进而计算DNA的相对含量。采用FACSTMSortware 1.0.0.650软件进行相关样品的统计分析与图像绘制。其中测试样品低速收集8 000~10 000个颗粒[每个样品进行3次平行实验,变异系数(CV)均控制在5%以内[21]],本试验所有的待测样品峰为P4,内标峰均为P5峰。核DNA含量的计算方法为:待测样核DNA含量(pg)=对照样本细胞核DNA含量×(待测样本G0与G1期峰荧光强度之比/对照样本G0与G1期峰荧光强度之比);其中,G0为分裂停止期,G1为细胞DNA复制未开始期。已知内标物种玉米和大豆的2C基因组大小为 5.43 pg和2.50 pg。
1.3 K-mer分析法测定基因组大小
1.3.1 基因组DNA提取与序列测序
采用北京艾莱德植物基因组DNA提取试剂盒(DN14)提取DNA[22],利用Nanodrop 2000 分光光度计(德国,Eppendrof)和1%(质量分数)琼脂糖凝胶电泳进行DNA浓度和质量检测。合格的DNA样品经过随机打断后(长度为350 bp)构建文库,并利用Illumina HiSeqTMXten测序平台进行高通量测序。获得的原始数据经过质控过滤后(去除接头、污染和低质量reads)进行K-mer分析。
1.3.2 基因组大小计算与杂合度分析
利用SOAPdenovo软件 (https://github.com/aquaskyline/SOAPdenovo 2)进行数据拼接与组装,采用K-mer分析法[15]估算6种槭属植物基因组的大小、杂合度、重复比例。根据基因组大小等于K-mer总数与K-mer期望深度的比值,即可估测出待测树种的基因组大小。此外,分别根据K-mer曲线的分布情况以及标准泊松分布与实际数据曲线峰值后的面积差值,计算获得杂合率(杂合峰值与纯合峰值的比值)及重复序列比例。本试验基于K值为17进行预测,并利用Jellyfish 2.1.4软件[23]进行统计分析。
2 结果与分析
2.1 细胞解离液的筛选
细胞解离液促使植物细胞破碎后分散细胞器,从而解离出细胞核,但不同植物在不同解离液作用下,其解离效果差异较大[14,17,24]。本研究以6种槭树嫩叶为实验材料,比较6种解离液(LB01、WPB、GPB、Gal、Otto、Tris-MgCl2)的解离效果后发现,WPB的解离效果最好(图1和图2),待测样品和内标的粒子清晰集中,基本无重叠峰和杂峰,且区分度良好,能够将待测和内参实验样品区分开;因此,WPB是本研究中流式测定体系的最佳解离液。

图1 6种槭树与内标混合样品散点图Fig.1 The scatter plots of the mixed cell nucleus suspensions of six Acer species

A—E的内标为大豆,F的为玉米。The internal standard of A-E is Glycine max ‘Polanka’,and that of the F is Zea mays CE-77.图2 6种槭树与内标混合样品流式细胞仪检测结果Fig.2 The result of mixed samples of six Acer species and internal standard
2.2 流式细胞仪测定的基因组大小
通过内标法对6种槭树的混合细胞核悬液样品PI发射的荧光强度进行流式测定分析。由图2可知,待测样品与内标间区分度良好,且DNA含量CV均在5.0%以内,试验结果可靠稳定[17,24-25]。已知大豆1C基因组大小为1.25 pg,根据待测样品与大豆峰值的倍数关系,以大豆为内标能成功检测出待测样品基因组大小。通过3次平行重复检测后,5种槭树样品平均基因组大小分别为建始槭(691.12±8.69) Mb、三角枫(863.90±8.69) Mb、秀丽槭(896.50±4.35) Mb、血皮槭(893.24±8.69) Mb、五小叶槭(766.10±8.69) Mb。然而以大豆为内标显示其与青楷槭会出现主峰相近或部分重叠,但以玉米(1C基因组大小为2.72 pg)为内标,成功测出青楷槭的基因组大小为(1 154.04±13.04) Mb(表1)。由表1可以看出,6种槭树科植物的基因组大小存在一定的差异。
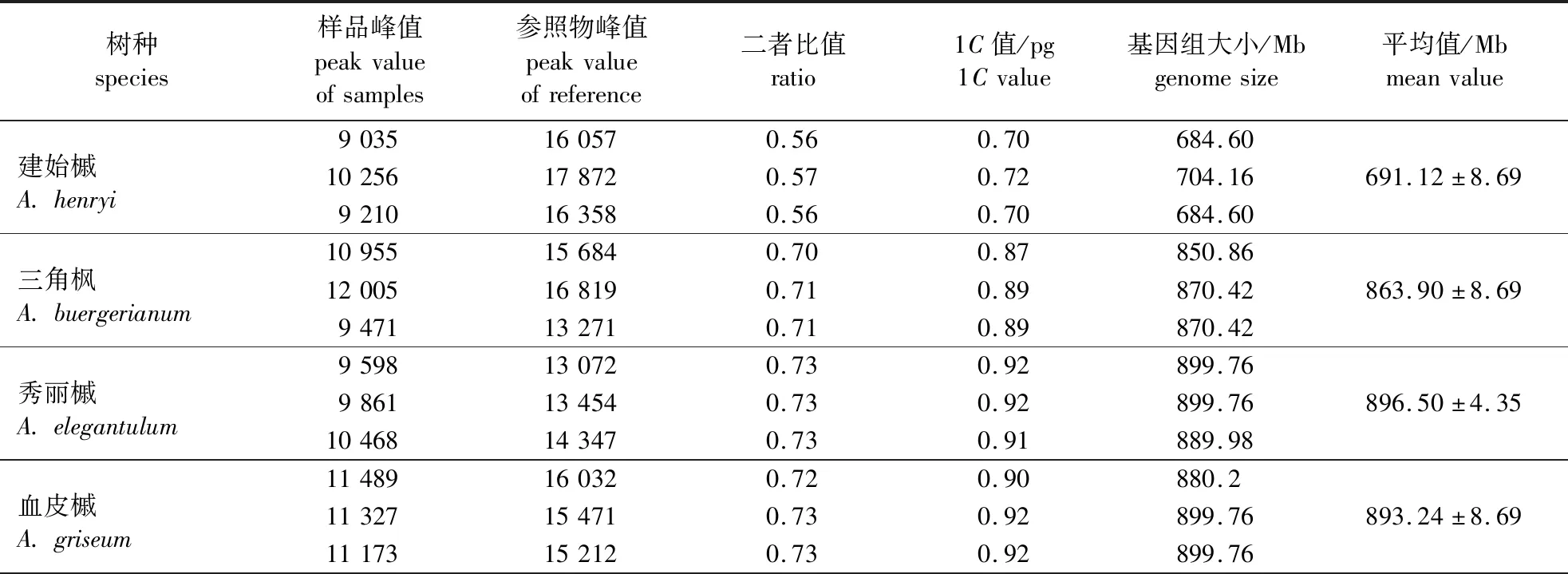
表1 6种槭属植物基因组大小Table 1 Genome size survey for six Acer species

表1 (续)
2.3 K-mer分析法测定的基因组大小
基于高通量测序平台Illumina HiSeqTMXten 分别对6种槭树进行测序,经过过滤及质控评估后,文库Q20(错误率为1%)均在96%以上,Q30(错误率为0.1%)在92%以上,错误率均不高于0.04%,表明序列质量较好(表2)。
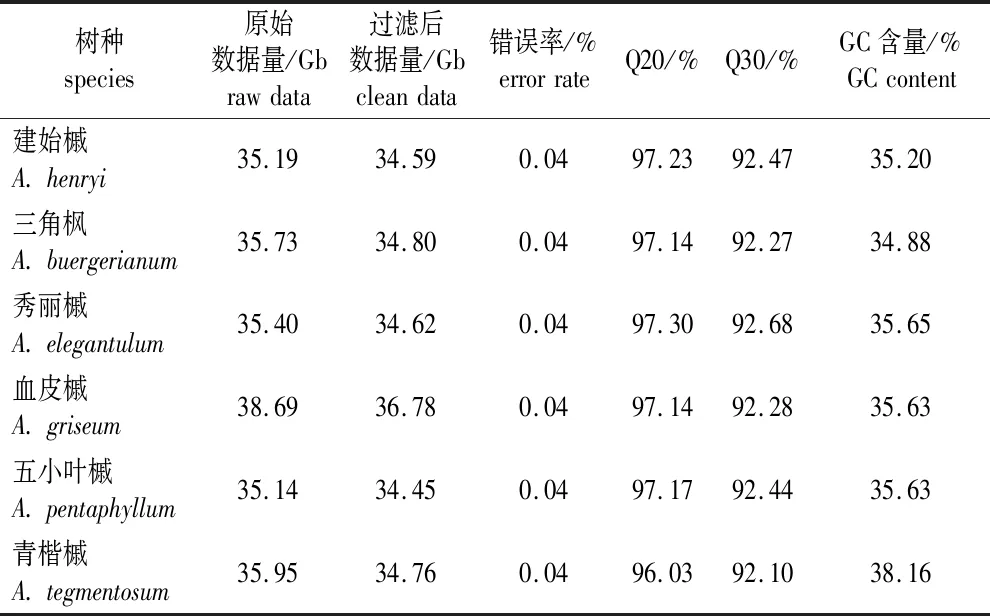
表2 测序数据统计及质量评估Table 2 Sequencing data statistics and quality assessment
利用Jellyfishv 2.1.4软件对上述6种高质量测序数据进行K-mer分析(K值为17)。从图3可以看出,K-mer分布曲线成峰较好,除五小叶槭和青楷槭外,其他均呈双峰分布。其中建始槭的17-mer期望深度(图中主峰)分别在21和44附近,三角枫和秀丽槭在15和32附近,血皮槭在17和35附近;而五小叶槭和青楷槭为单峰分别在35和22附近。依据公式,基因组大小等于K-mer总数与K-mer期望深度的比值,本研究估测及修正后6种槭树的基因组大小分别为建始槭(561.72 Mb)、三角枫(743.0 Mb)、秀丽槭(777.87 Mb)、血皮槭(771.51 Mb)、五小叶槭(650.64 Mb)、青楷槭(1 103.46 Mb)。如图3所示,前四者的主峰1/2位置处均有明显的杂合峰,说明均存在杂合现象,而后两者杂合峰不明显;通过预估建始槭、三角枫、秀丽槭、血皮槭、五小叶槭、青楷槭的杂合率分别为1.00%、1.24%、1.31%、1.08%、0.28%、0.81%。此外,还发现主峰后均存在拖尾现象,分析发现其重复率分别为58.10%、63.83%、66.44%、67.44%%、63.73%、76.82%,研究发现6种槭树基因组的确存在较复杂的基因组重复序列(表3)。

图3 6种槭树基因组的17-mer曲线分布Fig.3 Distribution of 17-mer in the genomes of six Acer species

表3 基于17-mer的6种槭树基因组分析Table 3 The 17-mer analysis of six Acer species
3 讨 论
3.1 基因组大小测定方法的比较
本研究首次通过对6种常用解离液的筛选和比较,建立和筛选建始槭、三角枫、秀丽槭、血皮槭、五小叶槭、青楷槭的最适解离液,结果发现以WPB为细胞核解离液时没有重叠峰,且区分度良好,所获得的粒子清晰集中,CV值均可控制在5%以内,保证了该研究的准确性和可靠性。不同植物材料其最适解离液具有较大差异,如已报道的银缕梅属中的银缕梅(Parrotiasubaequalis)和波斯铁木(P.persica)以WPB作为细胞解离液效果较好,而解离液Galbraith’s对兰属植物中的对莲瓣兰(Cymbidiumtortisepalum)和墨兰(C.sinense)解离效果最好[27];然而同属植物间也存在一定差异,以往研究中发现槭属植物中的鸡爪槭(A.palmatum)和元宝枫(A.truncatum)以LB01为解离液时效果最好[14]。这样的结果表明不同解离液对不同植物材料的解离效果存在很大差异[24-25],不同解离液中化学成分的差异性以及植物组织表现出的不同细胞特异性等是其解离效果差异的主要原因。
用于检测基因组大小的方法主要包括流式细胞术、孚尔根光密度测量法、实时荧光定量PCR、基于基因组测序的K-mer分析法等[14,25-26]。目前因高通量测序平台结合K-mer分析也已成熟地应用于不同植物基因组大小的估测[17,25],如铁皮石斛(Dendrobiumofficinale)[28]、黄瓜(Cucumissativus)[29]、人参(Panaxginseng)[30]等。
本研究基于Illumina HiSeqTMXten平台分别对6种槭树植物的基因组大小进行K-mer分析,结果显示,6种槭树的基因组大小分别为建始槭(561.72 Mb)、三角枫(743.00 Mb)、秀丽槭(777.87 Mb)、血皮槭(771.51 Mb)、五小叶槭(650.64 Mb)、青楷槭(1 103.46 Mb)。基于流式细胞仪测定的结果分别为:建始槭[(691.12±8.69) Mb]、三角枫[(863.90±8.69) Mb]、秀丽槭[(896.50±4.35) Mb]、血皮槭[(893.24±8.69) Mb]、五小叶槭[(766.10±8.69) Mb]、青楷槭[(1 154.04±13.04) Mb]。两种方法预测后6种槭树均为二倍体,K-mer分析结果均略小于流式细胞术预测结果,与以往报道中对波斯铁木(Parrotiapersica)[25]、绣球 (hydrangeamacrophylla)[17]、黄瓜[29]和人参[30]等植物的基因组大小研究结果类似。但不同植物间也存在一定差异,如在铁皮石斛[28]、新疆沙冬青 (Ammopiptanthusmongolicus)[26]中K-mer的分析结果略大于流式细胞测定的基因组大小,其主要原因是流式细胞测定会受到植物细胞结构及其次生代谢产物的影响,而基于K-mer的分析可克服植物内源性物质的干扰[29-30],但在未来开展植物全基因组的测定工作中,二者的比较和分析具有重要的参考价值。
3.2 槭树科植物基因组大小的比较
一般体细胞DNA的含量用2C代表[31]。植物基因组大小作为生物多样性的主要特征参数之一,在比较基因组学、进化分析、生态学等研究领域中都具有重要意义[10-12]。Soltis等[32]将被子植物基因组大小划分为DNA 1C值≤1.4 pg 为极小基因组,1C值≥1.4~3.5 pg的为小基因组。鹅耳栎叶槭 (A.carpinifolium)为首次被报道基因组大小的槭属植物,其基因组大小为0.38 pg[33],此后陆续有研究者对不同槭树基因组大小进行测定与评估,发现不同品种的基因组大小差异较大。尽管槭树种类超过200多种,但目前仅19种槭树科植物的基因组大小数据被植物DNAC值数据库(https://cvalues.science.kew.org)所收录。除美国红枫(A.rubrum)DNA 1C值为1.70 pg外,其余品种均小于1.4 pg,属于极小基因组[32],最小的樟叶槭(A.coriaceifolium)仅0.4 pg。
槭属植物的种类繁多,已有研究表明该属植物基因组大小存在一定差异,说明经过长期的自然选择,其遗传变异较为丰富。尽管本研究中6种槭树均为二倍体,不同槭树的基因组大小也存在一定差异,如青楷槭的基因组大小约为建始槭的2倍。以往研究报道基因组内大量的非编码DNA,基因组多倍化和转座子的积累是基因组增大的内在主要动力[33-34],是导致不同植物基因组大小产生差异的主要原因。已有研究表明,植物的多样性及物种灭绝的风险性与植物基因组的大小有一定的关系[35]。该现象在其他物种中也极为普遍,例如枣属(Ziziphus)[36]、草莓属(Fragaria)[37]等。
本研究筛选出适合6种槭树流式测定的最佳细胞核解离液为WPB,且以玉米和大豆为内标,基于流式细胞术成功区分并估测6种槭树的基因组大小,同时利用K-mer分析法成功分析6种槭树的基因组特征。以往将K-mer分析预测的杂合度大小一般分为两种,分别为微杂合(0.5%≤杂合率<0.8%)和高杂合(杂合率≥0.8%)[38]。本研究中五小叶槭的杂合度最低为0.28,属于低杂合;青楷槭为0.81近于微杂合,其余为高杂合基因组植物。此外,基因组重复序列比例≥50%被认为是高重复基因组,研究结果表明6种槭树重复序列均在58%以上,这为后续基于第3代全基因组测序工作的开展增加了难度[25,28,39]。本研究首次成功测得6种槭树植物的基因组大小,补充和丰富了槭树科植物的DNAC值数据库,为槭属植物的细胞学、基因组学以及系统进化等研究奠定了理论基础。
